Amminoacidi e Proteine:
Ruolo Metabolico e Nutrizionale
Il Fabbisogno proteico è costituito da due componenti:
Fabbisogno di azoto
Fabbisogno di amminoacidi essenziali
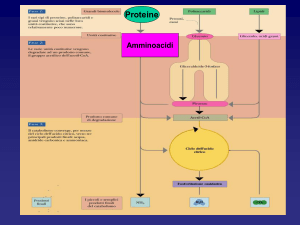
Overview del catabolismo degli amminoacidi nei mammiferi
Overview del catabolismo degli amminoacidi nei mammiferi
Ossidazione degli amminoacidi
• La degradazione degli
amminoacidi è un processo
complesso che coinvolge un
numero molto grande di
intermedi:
Ala
Ser
Cys
Gly
Thr
Trp
Piruvato
Ile
Leu
Thr
Trp
CO2
• Catena Carboniosa
• Azoto ammoniacale:
– Urea
– NH3
• Azoto basi azotate:
– Acido urico
– Urea
– NH3
Acetil-CoA
Glucoso
Asn
Asp
Ossalacetato
Fumarato
Asp
Phe
Tyr
Acetoacetato
Citrato
KREBS
Isocitrato
CO2
-chetoglutarato
Succinil-CoA
Ile
Met
Val
CO2
Leu
Lys
Phe
Tyr
Arg
Gln
Glu
Pro
His
Metabolismo della catena carboniosa degli amminoacidi
Lo scheletro carbonioso fornisce energia attraverso l’interazione con la
via glicolitica ed il ciclo di Krebs
In condizioni fisiologiche esiste una relazione tra il livello dei carboidrati
nella dieta ed il metabolismo degli amminoacidi
Aumenta quando l'apporto di energia è sufficiente ma viene fornito da
proteine a scapito dei carboidrati e dei lipidi
La sua efficienza (molecole di ATP prodotte) è inferiore rispetto alla degradazione degli
altri due substrati (carboidrati e lipidi):
Non tutto lo scheletro carbonioso degli amminoacidi è soggetto ad ossidazione
La formazione di urea (il prodotto finale del catabolismo azotato) richiede il consumo di 3
molecole di ATP
AMMINOACIDI GLUCOGENICI glicolisi o ciclo di Krebs
possono essere usati per la gluconeogenesi
AMMINOACIDI CHETOGENICI degradati ad acetil-CoA
soltanto LEUCINA e LISINA sono chetogenici puri
Amminoacidi più grandi quali
ISOLEUCINA
FENILALANINA, TIROSINA
TRIPTOFANO
sono sia glucogenici che chetogenici
gli altri sono glucogenici
Catabolismo del
gruppo amminico
• Il primo stadio della degradazione degli amminoacidi è la rimozione del
gruppo amminico attraverso le amminotransferasi: -chetoacido1 + AA2
Transaminazione
• Le reazione di transaminazione usano come coenzima il piridossal
fosfato.
• Il piridossal fosfato forma una base di Shiff con un residuo di Lys della
transaminasi
O
OH
HO
N
+
O
H
OH
CH3
O
NH3+
O
OH
P
O
O
N
+
CH3
H
H
Piridossina
(Vit B6)
Piridossal fosfato
(PLP)
O
OH
P
O
O
N
+
CH3
H
Piridossamina fosfato
(PMP)
Transaminazioni
O
O
O
Asp
O
Ossalacetato
NH3 +
O
O
O
O
O
H3 C
NH3 +
Ala
O
H3 C
O
O
O
O
CH3
NH3 +
O
O
H3 C
NH3 +
O
CH3
O
O
Leu
O
+
+
H3 C
O
O
-chetoglutarato
Glu
O
O
OH
p-idrossifenilpiruvato
NH3 +
O
O
-chetoisocaproato
O
OH
Tyr
Piruvato
O
O
O
O
O
O
Ruolo metabolico delle transaminasi
In aggiunta ad equilibrare il gruppo amminico tra gli -keto acidi disponibili
Permettono la sintesi di amminoacidi non essenziali
Aiutano a mantenere la varietà degli amminoacidi per la sintesi delle
diverse proteine
Convogliano il gruppo amminico degli amminoacidi in eccesso (derivanti
dalla dieta) verso la formazione del GLUTAMMATO che può essere
deaminato
Scheletro carbonioso degli amminoacidi deaminati può essere
catabolizzato per produrre energia o utilizzato per produrre glucosio o acidi
grassi
Pochi amminoacidi possono essere direttamente deaminati
Glutammato deidrogenasi
Glutammato Deidrogenasi
catalizza la reazione che porta
alla rimozione netta di N
dal pool degli amminoacidi
E’ uno dei pochi enzimi che utilizza sia NAD+ o NADP+ come accettore di elettroni.
Ossidazione del carbonio è seguita da idrolisi che porta al rilascio di NH4+.
+
H2O NH4
H2O
HO
CH2
H
C
COO
H2C
COO
H3C
C
COO
NH3+
NH3+
serine
C
O
aminoacrylate
pyruvate
Serine Dehydratase
Altri processi di deamminazione:
1. Serina Deidratasi catalizza:
serina piruvato + NH4+
2. Perossisomi L- e D-amminoacidi ossidasi catalizzano:
amminoacido + FAD + H2O -chetoacido + NH4+ + FADH2
FADH2 + O2 FAD + H2O2
Catalasi catalizza: 2 H2O2 2 H2O + O2
Trasporto dello ione ammonio sotto forma di Glutammina
L’ecceso di ione ammonio nei tessuti viene
convertito in Glutammina, un processo
catalizzato dalla GLUTAMMINA SINTETASI.
Attraverso il flusso sanguigno la Glutammina
raggiunge il fegato e NH4+ è liberato nei
mitocondri dall’enzima GLUTAMMINASI
Ciclo Glucosio-Alanina
Un altro modo di trasportare
lo ione ammonio dai tessuti muscolari
al fegato
O
H 2N
C
NH2
urea
La maggior parte degli animali terrestri convertono l’eccesso di ammonio in
urea, prima dell’escrezione.
Urea è meno tossica dello ione ammonio.
Il ciclo dell’ Urea avviene prevalentemente nel fegato.
I due gruppi amminici dell’urea derivano da NH3 (prodotto principalmente
dalla Glutammato Deidrogenasi) e dal gruppo N dell’aspartato.
L’ NH3 e HCO3- (gruppo carbonilico) sono dapprima trasformati in carbamil
fosfato.
Ciclo dell’urea
Complicanze metaboliche
Carenze ereditarie di qualsiasi enzima del ciclo dell’urea porta a
Iperammoniemia - elevata [ammonio] nel sangue.
Mancanza totale di ogni enzima del ciclo dell’Urea è letale.
Elevate concentrazioni di ammoniaca sono tossiche specialmente per il
cervello.
Disturbi se non trattati immediatamente dopo la nascita portano a gravi
alterazioni a livello dello sviluppo cognitivo.
Meccanismi di tossicità per [ammoniaca]:
1.
Alta [NH3] attiva Glutammina Sintasi:
glutammato + ATP + NH3 glutammina+ ADP + Pi
Porta a deplezione di glutammato – un neurotrasmettitore e precursore dei
GABA.
2.
Deplezione di glutammato e alta ammoniaca portano la Glutammato
Deidrogenasi a funzionare nel verso contrario:
glutammato + NAD(P)+ -chetoglutarato + NAD(P)H + NH4+
La deplezione di -chetoglutarato, un intermedio essenziale del Ciclo di Krebs
altera il metabolismo energetico nel cervello.
Ammoniaca può essere in parte riutilizzata
-chetoglutarato + NH4+ glutammato
glutammato + NH4+ + ATP glutammina + ADP + Pi
NH4+ + CO2 + folato glicina
Urea può essere ritrasformata in ammoniaca dalla microflora intestinale:
non è chiaro l’eventuale contributo
“perdita obbligatoria di azoto”
con le urine
Urea
10 - 30
g/die
dipende quantità proteine alimentari
NH3
0,4-1,2
g/die
dipende equilibrio acido-base
Amminoacidi
0,3 -1,2 g/die
Acido urico
0,2-0,7
g/die
dipende dalla dieta
Creatinina
0,3-0,8
g/die
dipende dalla massa muscolare (indice
del turnover proteico del muscolo)
secrezioni intestinali, turnover enterociti, desquamazione pelle, …
NH3 deriva dal catabolismo degli
amminoacidi
basi puriniche (tramite deaminasi)
basi pirimidiniche
Formazione di acidi non volatili dal catabolismo di
a.a. solforati
metionina, cisteina SO42fosfoproteine fosfati
fosfolipidi
acidi grassi e glucosio
acetoacetato, -idrossibutirrato, lattato
acidi nucleici
basi puriniche urati
nutrienti con anioni inorganici (superiori alla quantità di cationi
inorganici)
Richiede l’escrezione di un catione NH4+ (fornito dalla glutammina) per
permettere all’organismo di conservare cationi quali Na+, K+, Ca2+,
dieta ricca in proteine genera acidi non volatili
Proteolisi
• Idrolisi del legame peptidico
– Nell’intestino dell’uomo sono presenti diverse proteasi secrete da
diversi organi digestivi:
• Dallo stomaco: pepsina
• Dal pancreas: chimotripsina, tripsina, carbossipeptidasi
• Dall’intestino tenue: peptidasi intestinali, aminopeptidasi
Con l’eccezione della lipasi linguale e dell’amilasi salivare tutti gli enzimi
digestivi vengono secreti in forma di zimogeni
Digestione delle proteine
L’assorbimento di molecole
proteiche intatte avviene
raramente nell’adulto ma è più
frequente nel neonato.
Gli anticorpi materni arrivano
intatti grazie anche alla
presenza nel latte di inibitori di
peptidasi e vengono assorbiti.
Questo spiega i fenomeni
allergici a cui vanno incontro i
neonati non nutriti con latte
materno e il meccanismo di
trasferimento delle difese
anticorpali dalle nutrici al
neonato.
orletto a spazzola
1
3
5
2
6
4
Digestione delle proteine: 6 fasi
1. Idrolisi gastrica del legame peptidico; 2. Digestione da parte delle proteasi pancreatiche nel lume
dell’intestino tenue; 3. Idrolisi degli oligopeptidi da parte di peptidasi dell’orletto a spazzola degli enterociti;
4. Ulteriore digestione dei di- e tri-peptidi da peptidasi citoplasmatiche nell’enterocita;
5. Metabolismo degli AA negli enterociti; 6.Trasporto degli AA attraverso la membrana basolaterale e invio al
sangue portale e quindi al fegato
Alcuni alimenti contengono inibitori della tripsina (piselli,fagioli,lenticchie,soia) diminuendo in tal modo il
valore nutrizionale delle proteine
Origine
Zimogeno/ Enzima
Attivazione
Substrato
Prodotto
finale
Stomaco
Pepsinogeno/pepsina
pH 1-2,
autoattivazione
Proteine
Peptidi
Pancreas
Tripsinogeno/tripsina
Enteropeptidasi
Proteine,
peptidi
Peptidi,
dipeptidi
Tripsina
Proteine,
peptidi
Peptidi,
dipeptidi
Tripsina
Proteine,
peptidi
Peptidi,
dipeptidi
Tripsina
Estremità Cterminale
polipeptidi
Peptidi,
aminoacidi
Estremità Nterminale di
oligopeptidi
Peptidi,
aminoacidi
(membrana enterociti
duodenali)
Chimotripsinogeno/
chimotripsina
Pro-elastasi/elastasi
Pro-carbossipeptidasi
Intestino
tenue
(membrana
e
citoplasma)
Aminopeptidasi
Assente
Contenuto in proteine di un UOMO ADULTO: circa 12 kg/70 kg peso
actina, miosina, collagene ed emoglobina costituiscono circa la metà di tutte le proteine
40% nel muscolo: possono diventare fonte di amminoacidi in condizioni di stress, si
perdono però proteine funzionali
10% tessuti viscerali (fegato, intestino): scarsamente mobilizzate in condizioni di stress
30% nella pelle e nel sangue: diventano fonte di amminoacidi in deficit di proteine
alimentari
CONTINUO RICAMBIO PROTEICO
Serve energia sia per la sintesi che per la degradazione:
15-20 % del bilancio energetico
La continua demolizione e sintesi è fondamentale per
degradare e rimpiazzare proteine danneggiate
modificare la quantità relativa di differenti proteine in base alle
necessità nutrizionali e fisiologiche
rapido adattamento metabolico
La regolazione del turnover proteico è influenzata da:
stato nutrizionale (energetico e proteico)
da alcuni ormoni (insulina, glucocorticoidi, ormoni tiroidei, ormone
della crescita, citochine)
ORGANISMO
Ricambio giornaliero
1-2% proteine totali
Amminoacidi
70-80% riutilizzati
20-30% metabolizzati
Proteine dalla dieta
Proteine metabolizzate
70 grammi/giorno
250 grammi/giorno
% ricambio
muscolo 30-50%
fegato 25%
leucociti
emoglobina
diversa emivita
pochi minuti: proteine regolatorie
300 giorni: collageno