Farmacologia e Tossicologia, 2015
TOSSICOLOGIA-2
PROCESSI ADME
Reazioni di bioattivazione
JeanJean-Franç
François DESAPHY
Processi ADME
Assorbimento
Distribuzione
Metabolismo
Eliminazione
2008© J.F. DESAPHY
Processi ADME
Tossico nel sito di contatto
Effetti locali
Assorbimento
Tossico nel plasma
Distribuzione
Effetti sistemici
Tossico nei tessuti
Metabolismo
Metaboliti nei tessuti
Escrezione
Tossico e/o metaboliti nelle urine, feci, bile
2008© J.F. DESAPHY
Assorbimento
SITO DI CONTATTO
ASSORBIMENTO
Esposizione accidentale (inquinanti, tossine)
cute
tratto respiratorio
tratto gastrointestinale
difficile
facile ma selettivo
relativamente facile
metabolismo primo passaggio
Esposizione volontaria (farmaci e sostanze d’abuso)
+ parenterale
immediato
endovascolare (endovenosa, intra-arteriosa)
intramuscolare
sottocutanea
2008© J.F. DESAPHY
Assorbimento Cutaneo
complesso tessuto multistrati con ampia superficie esposta
3 mm
epidermide
strato corneo
strato lucido
strato granuloso
strato spinoso
strato basale
derma
ipoderma
0.1-0.8 mm
Strato corneo:
Cheratinociti morti in una matrice lipidica
Principale resistenza alla penetrazione degli ioni/sostanze acquosi
accumulo ed assorbimento lento di tossici lipofili
Epidermide:
Principale strato di biotrasformazione dei tossici
attività limitata (2-6% rispetto al fegato)
profarmaci esteri lipidici bioattivati dalle esterasi
detossificazione di alcuni pesticidi
bioattivazione del benzopirene a carcinogene
2008© J.F. DESAPHY
Assorbimento per via Respiratoria
Strutture protettive contro particelle: naso, bocca, faringe, trachea, bronchi
Assorbimento di gas/vapori maggiore a livello degli alveoli bronchiali
Piccolo spessore
0.4-1.5 µm
Cellule epiteliali
Membrana basale
Cellule endoteliali
Grande superficie di scambio aria/sangue
(50 x superficie della pelle)
2 tipi di tossici
gas, solventi, vapori: facile trasporto seguendo le leggi dei gas
diffusione passiva
coefficiente di ripartizione sangue/gas
aerosol, particolati, fumi: particelle ≠ gas
endocitosi
Ø 5-30 µm: naso, bocca, faringe
Ø 1-5 µm: trachea, bronchi, bronchioli
Ø <1 µm: alveoli
2008© J.F. DESAPHY
Assorbimento Intestinale
a: diffusione transcellulare
diffusione passiva
trasporto facilitato
trasporto attivo
Lumen intestinale
Tight junction
b: diffusione paracellulare
(<100-200 daltons)
c: endocitosi attraverso gli
enterociti
d: endocitosi attraverso le
cellule M nelle placche di Peyer
Circolo sanguigno
Circolo linfatico
2008© J.F. DESAPHY
Meccanismi di Assorbimento
Diffusione passiva
attraverso lipidi di membrana
liposolubilità e pKa
gradiente di concentrazione
Filtrazione
attraverso pori o giunzioni intercellulari
idrosolubilità
<4 Å
Trasporto facilitato
attraverso un carrier
(sfruttando una analogia strutturale)
secondo gradiente di concentrazione
Trasporto attivo
attraverso un carrier (analogia strutturale)
contro gradiente di concentrazione (ATP)
Pinocitosi-fagocitosi
mediante vescicole di membrana
Influenzato da
- la motilità gastrointestinale
- il flusso ematico splancnico
- i fattori fisico-chimici (pH, legame con ioni o proteine, ecc...)
- metabolismo da parte degli enzimi della parete intestinale
2008© J.F. DESAPHY
Liposolubilità e Diffusione Passiva
Coefficiente di ripartizione acqua/olio
Log P = (VA/VO) · [(CAi-CAf) / CAf]
VA= volumo di acqua
VO= volumo di olio
CAi= concentrazione iniziale in acqua
CAf= concentrazione finale dopo agitazione
Più grande è Log P, più lipofila è la sostanza
Un
xenobiotico
liposolubile
è
soggetto
ad
un
gradiente
di
concentrazione (∆Cm) lipidico molto
più grande rispetto ad un farmaco
poco solubile nei lipidi.
Per
uno
stesso
gradiente
di
concentrazione acquosa (C1 – C2), lo
xenobiotico liposolubile diffonderà
più rapidamente.
2008© J.F. DESAPHY
Ionizzazione e Diffusione Passiva
Basi e acidi forti sono scarsamente assorbiti in quanto sono completamente ionizzati.
Molti farmaci sono acidi o basi deboli, il cui stato di ionizzazione dipende dal pH.
pKa > 3
[
AH ]
pKa = pH + log
pKa < 10
[A ]
−
[
BH ]
pKa = pH + log
+
[B ]
[AH] exp(pKa –pH) [BH+]
=
=
[A+]
[B]
2011© J.F. DESAPHY
Ionizzazione e Diffusione Passiva
Assorbimento di xenobiotici acidi e basici nell’intestino (duodeno)
A+ / B
pH = 6.5
AH / BH+
Nell’intestino, il pH pari a
6.5 permette l’assorbimento
delle basi deboli ma gli acidi
permeano solo scarsamente
Nello stomaco, il pH pari a 3
favorisce l’assorbimento
degli acidi deboli pero la
superficie di assorbimento
è minore rispetto all’intestino
2011© J.F. DESAPHY
Ionizzazione e Distribuzione
Ripartizione teorica
Ripartizione reale
•Le membrane non sono totalmente
impermeabili alle sostanze cariche.
•Raramente si raggiunge l’equilibrio
perché i fluidi gastrici e renali non
sono statici
I gradienti di concentrazione sono
minori
A l’equilibrio, la concentrazione di forma neutra è uguale in tutti i compartimenti perché diffonde
liberamente. Quindi la differenza di concentrazione è data dalla forma carica che dipende dal pH ambiente.
2008© J.F. DESAPHY
Distribuzione
Passaggio dal corrente circolatorio ai diversi organi e tessuti
Molecole di xenobiotico legato
Molecole di xenobiotico libero
da Farmacologia 3a ed., Rang et al., Casa Editrice Anbrosiana, 2005
All’equilibrio, la distribuzione dipende da
• permeabilità attraverso le barriere tessutali
• legame all’interno dei compartimenti
• differenza di pH
• liposolubilità
2008© J.F. DESAPHY
Metabolismo
Un tossico somministrato per
via parenterale entra
direttamente in circolo
sistemico con accesso diretto
al resto dell’organismo
I tossici ingeriti sono dapprima
esposti al fegato e possono
essere estesamente
metabolizzati prima di
raggiungere il resto
dell’organismo
da Farmacologia 2nd edizione, Mycek et al., Zanichelli, 2000
2008© J.F. DESAPHY
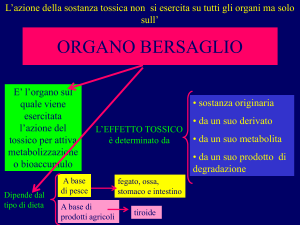
Metabolismo
Il metabolismo consiste in una serie di processi di biotransformazione dello
xenobiotico in metaboliti più facilmente eliminabili dall’organismo
XENOBIOTICO
biotrasformazione
bioattivazione
METABOLITI
REATTIVI
METABOLITI
STABILI
eliminazione
citotossicità
immunotossicità
genotossicità
2008© J.F. DESAPHY
Metabolismo
da Farmacologia 2a ed., Rang et al., Casa Editrice Anbrosiana, 2001
2008© J.F. DESAPHY
Metabolismo
Enzimi della Fase I
ADH: alcohol dehydrogenase
ALDH: aldehyde dehydrogenase
CYP: citochrome P450
DPD: dihydropyrimidine dehydrogenase
COMT: catechol-O-methyl transferase
NQO1: NADPH-quinone oxydoreductase
Enzimi della Fase II
GST: glutathion-S-transferase
HMT: histamine methyl-transferase
NAT: N-acetyl transferase
STs: sulfotransferases
TPMT: thiopurine methyltransferase
UGTs: uridine 5’-triphosphate glucuronosyl transferase
Metabolismo
Alcuni reazioni di fase I
Citocromi P450
epossidazione-idrossilazione
N-, O-, S-dealchilazione
desolforazione
dealogenazione
nitro-riduzione
Monossigenasi flavina-dipendenti
N-, S-, P-ossidazione
desolforazione
Coossidazione della prostaglandina sintetasi
deidrogenazione
N-dealchilazione
epossidazione-idrossilazione
Molibdeno idrossilasi
ossidazione
riduzione
Alcool deidrogenasi
ossidazione
Epossido idrolasi
idrolisi
SUBSTRATI
benzo(a)pirene, aflatossina, bromobenzene
etilmorfina, metilmercaptano
disolfuro di carbonio
tetracloruro di carbonio, cloroformio
nitrobenzene
nicotina, tiourea
fonofos
paracetamolo, benzidina
benzofetamina, dimetilalanina
benzo(a)pirene, 2-aminofluorene
pteridina, metotrexato
nitrocomposti aromatici, nitrosammine
metanolo, etanolo, glicoli, esteri glicolici
benzo(a)pirene, epossido
2008© J.F. DESAPHY
Metabolismo - CYP
Progetto genoma umano
57 geni codificanti per enzimi P450
P450 alcuni farmaci
substrati endogeni e xenobiotici tossici
1A1
1A2
benzo(a)pirene, dimetilbenzo(a)antracene
amine aromatiche, idrocarburi arilici
aflatossina, estradiolo, NKK
aflatossina, dietilnitrosamina, NKK
6-aminocrisene, aflatossina, NKK
?
?
2A6
2B6
2C8
2C9
verluskat
teofillina, caffeina, acetaminofene
cumarina, nicotina
ciclofosfamide
taxol, tolbutamide, carbamazepina
warfarina, fenitoina
diclofenac, tolbutamide
2C19 S-mefitoina, diazepam, propranololo
omeprazolo, indometacina, fenitoina
2D6 bufuralolo, propranololo
tioridazina, chinidna, fenitoina
2E1 isoniazide, enflurano
acetaminofene, alotano
3A4 nifedipina, etilmorfina
quinidina, taxol, verapamil
4A9 pochi farmaci
?
NKK: Nicotine-derived nitrosamine ketone
4(metilnitrosamino)1-(3-piridile)-1-butanone
(NKK nel fumo di tabacco)
dimetilnitrosamina, benzene, alcani alogenati
acrilonitrile, alcooli, stirene, cloruro di vinile
aflatossina, benzo(a)pirene, 7,8-diolo
ormoni steroidei, acidi biliari
acidi grassi, prostanoidi
2008© J.F. DESAPHY
Metabolismo – fase II
Reazioni
enzimi
gruppi funzionali coinvolti
Glucuronilazione
UDP-glucuroniltrasferasi
-OH
-COOH
-NH2
-SH
Solfatazione
solfatotrasferasi
-OH
-NH2
-SO2NH2
Metilazione
metiltrasferasi
-OH
-NH2
Acetilazione
acetiltrasferasi
-OH
-NH2
-SO2NH2
Coniugazione
Con aminoacidi
Coniugazione
Con glutatione
-COOH
Glutatione-S-trasferasi
epossido
-OH
2008© J.F. DESAPHY
Metabolismo – glutatione
O
Glutatione ridotto (GSH): γ-glutamil-cisteinil-glicina
HO
NH2
GSSG + NADPH +
H+
glutatione reduttasi
SH
O
N
H
H
N
O
OH
O
2 GSH + NADP+
ridotto
ossidato
Azione antiossidante
glutatione perossidasi
2 GSH + ROOH
perossido
GSSG + ROH + H2O
alcool
Azione detossificante
chelazione dei metalli (piombo, cadmio, mercurio, alluminio)
coniugazione a xenobotici e metaboliti tossici (paracetamolo, ecc...)
neutralizzazione della reazione da Fe2+ a Fe3+ operata da numerosi tossici
2008© J.F. DESAPHY
Reazioni di Bioattivazione
Principali enzimi in grado di attivare xenobiotici
Tipi di reazione
Enzimi
Ossidazione
citocromo P450
prostaglandina sintetasi
monoossigenasi dipendente da flavina
alcool e aldeide deidrogenasi
Riduzione
riduttasi
citocromo P450
microflora intestinale
Coniugazione
glutatione trasferasi (GST)
solfotrasferasi
glucoronidasi (UGT)
Deconiugazione
cisteina S-coniugato β-liasi
Idrolisi
microflora intestinale
idrolasi
2008© J.F. DESAPHY
Metaboliti Reattivi
A vita ultra-breve
il metabolita rimane legato all’enzima
altera la funzione enzimatica (substrato suicida)
inibitori enzimatici
A vita breve
il metabolita rimane in cellula o vicino
intrappolamento e/o rimozione
danno tessutale limitato
A vita lunga
il metabolita (reattivo o pro-reattivo) viene trasportato
a siti d’azione lontani, producendo effetti sistemici
2008© J.F. DESAPHY
Effetti tossici del Parathion
Insetticida organofosforico approvato oggi solo per uso in esterno
WHO classe Ia: estremamente tossico
O
S
CH3CH2O
CH3CH2O
P O
CYP3A4
NO2
parathion
Inibizione CYP3A4
ad opera dell’atomo di zolfo
(Substrato suicida)
Interazioni con farmaci
2008© J.F. DESAPHY
CH3CH2O
CH3CH2O
P O
NO2
paraoxon
Inibizione
irreversibile
acetilcolinesterasi
DETOSSIFICAZIONE
Effetto insetticida
Effetti tossici acuti
Effetti tossici cronici: polineuropatia
Composti organofosforici
DFP, isoflurophosphate
Potent, irreversible inhibitor
Tabun
Ethyl N-dimethylphosphoramido cyanidate
extremely toxic nerve gas
Sarin
Isopropylmethylphosphorofluoridate
extremely toxic nerve gas
Sorren
Pinacolylmethylphosphorofluoridate
extermely toxic nerve gas
Paraoxon, E600
O,O-diethyl O-(4-nitrophenyl)-phosphate
active metabolite of parathion
Parathion
agricultural insecticide
O,O-diethyl O-(4-nitrophenyl)-phosphorothioate
Renthion
agricultural insecticide
O,O-dimethyl O-(4-methylthio-m-tolyl hosphorothioate
high lipid solubility
Dimpylate, diazinon
garden and agro insecticide
O,O-diethyl 2-isopropyl-6-methyl-4-pyrimidinyl phosphorothioate
Malathion
insecticide of greater safety
O,O-dimethyl S-(1,2-dicarbethoxy-ethyl) phosphorodithioate
rapid detoxification by higher
organisms
2008© J.F. DESAPHY
Fosforilano la colinesterasi
inattivandola
Il sistema nervoso autonomo
Stato di sveglia
e fuga
Riposo e
digestione
acetilcolina
2008© J.F. DESAPHY
sinapsi nicotinica
(neuroni pre-gangliari)
sinapsi muscarinica
(organo effettore)
Noradrenalina/adrenalina
varicosità noradrenergica
(organo effettore)
2008© J.F. DESAPHY
Inibizione della colinesterasi
Miosi, dolore oculare,
congiuntivite,
riduzione della vista
Salivazione, sudorazione
bradicardia, ipotensione
Broncocostrizione,
eccessive secrezione
Nausea, vomito,
crampi addominali,
diarrea
incontinenza
Arresto cardiaco
Arresto respiratorio
Morte
sinapsi nicotinica
sinapsi muscarinica
varicosità noradrenergica
2008© J.F. DESAPHY
Composti organofosforici
Primi sintomi di tipo muscarinico: nausea, vomito, crampi addominali, diarrea,
broncospasmo, ipersecrezione bronchiale, edema polmonare, visione offuscata,
miosi, salivazione e sudorazione, bradicardia (incostante).
Sintomi di seconda comparsa di tipo nicotinico: astenia e paralisi muscolari,
tachicardia, ipertensione arteriosa, fibrillazione.
Sintomi centrali: confusione, atassia, convulsioni, coma.
Cause di morte: generalmente insufficienza respiratoria.
Antidoto: alte dosi di atropina (2 mg e.v. o i.m. ogni 20-30 min) fino ai primi segni
di atropinizzazione (colorazione della pelle, dilatazione della pupilla, tachicardia):
antagonista colinergico muscarinico
Somministrare subito la pralidossima (1-2 mg e.v. ogni 20-30 min)
Consultare un Centro Antiveleni
Somministrazione precoce
perché non raggiunge il SNC
2008© J.F. DESAPHY
Lega il tossico che non può
interagire con l’enzima
Effetti tossici del cloruro di vinile
Solvente
Monomero di PVC
H
H2 C
H
P450
Cl
vinilcloruro
H
O
Cl
H
H
H
O
H
Epossido di
cloroetilene
Cl
cloroacetaldeide
GST
GST
Legame covalente
con l’heme dell’enzima
Legame covalente
con macromolecole
Coniugazione con GSH
Inibizione P450
(Substrato suicida)
EPATOCANCEROGENESI
DETOSSIFICAZIONE
2008© J.F. DESAPHY
Effetti tossici del metanolo
Solvente, bevande di frode
detergenti, fotocopiatrici
CH3OH
alcool
HCHO
deidrogenasi
metanolo
aldeide
deidrogenasi
Formaldeide
Metabolita ultra breve
Depressione del SNC
sintomi iniziali dopo 1-2 ore: dolore addominale,
vomito, nausea, cefalea, vertigini, confusione
mentale
Sintomi ritardati dopo 15 ore: annebbiamento, cecità
EMODIALISI
SOMMINISTRAZIONE DI ETANOLO
ANTICONVULSIVANTI (fenitoina, diazepam)
ANTIACIDOSI (bicarbonato di sodio)
HCOOH
acido formico
Danno al nervo ottico
Edema della retina
CECITA’
acidosi metabolica
coma, convulsioni
MORTE
2008© J.F. DESAPHY
Attivazione della aflatossina B1
Micotossine da Aspergillus flavus / parasiticus
O
O
O
O
O
O
CYP450
O
O
O
O
OMe
aflatossina B1
O
OMe
2,3-epossido-aflatossina
O
O
si
a
l
o
r
do-id
i
s
s
Ep o
O
HO
HO
Legame covalente al DNA
O
O
OMe
2,3-diolo-aflatossina
EPATOTOSSICITA
EPATOCANCEROGENESI
DETOSSIFICAZIONE
2008© J.F. DESAPHY
Attivazione del Benzo(a)pirene
Combustione incomplete legno, carbone, oli minerali, scarico veicoli, fumo di sigaretta
Benzo(a)pirene
7,8-epossido-benzo(a)pirene
CYP1A1
(-) O
O
Epossido-idrolasi
HO
OH
7,8-diolo-9,10-epossido-benzo(a)pirene
HO
OH
(+) O
7,8-diolo-benzo(a)pirene
HO
OH
CANCEROGENESI
15 metaboliti fase I
Molti metaboliti di fase II
DETOSSIFICAZIONE
2008© J.F. DESAPHY
Effetti tossici della cicasina
ratticida naturale, farina della noce di cycas, Isole dell’Oceano Pacifico
O
CH3N
O
NCH2
β-glucoside
β-glucosidasi
Metilazossimetanolo glucoside
CH3N
NCH2OH
metilazossimetanolo
Animali somministrati per via intraperitoneale
o germ-free non sviluppano tumori
Enzima presente solo nella microflora intestinale
CANCEROGENESI
2008© J.F. DESAPHY
Metabolismo – acetaminofene
Acetaminofene (paracetamol)
CH3
HN
CH3
CH3
O
solfotrasferasi
O
HN
O
HN
UGT
OSO3-
O-glucuronide
OH
CYP2E1
CYP1A2
CYP3A4
CH3
CH3
N
LEGAME COVALENTE CON
GRUPPI SH DI PROTEINE
EPATOTOSSICITA
O
HN
O
GST
S-glutatione
O
N-acetil-p-benzochinone imina
OH
DETOSSIFICAZIONE
2008© J.F. DESAPHY
Organi di Rimossione
Reni
sostanze solubili in acqua
PM<65 000, filtrazione glomerulare
Nefrotossicità
Polmoni
sostanze volatili o gassosi
Fegato
biotrasformazione
eliminazione nella bile
Epatotossicità
da Farmacologia 2nd edizione, Mycek et al., Zanichelli, 2000
2008© J.F. DESAPHY
Organi di Rimossione
Cute
poco permeabile ma molto estesa
sostanze volatili
Sudore
0.7 L al giorno nell’adulto
sostanze solubili in acqua
Latte
ricco di lipidi e lipoproteine
sostanze idrofili e lipofili
DDE, metabolita del DDT
policlorobifenili
Rischi per il lattante
Capelli
via minore
analisi biochimica come test di esposizione
mercurio
sostanze d’abuso (cocaina)
2008© J.F. DESAPHY
Biodisponibilità
Biodisponibilità
Concentrazione plasmatica
del tossico
La biodisponibilità indica la percentuale di tossico che raggiunge la circolazione
sistemica dopo somministrazione.
Tossico iniettato
AUC
(iniettato)
Cmax
Biodisponibilità = AUC orale / AUC iniettato x 100
Tossico ingerito
AUC (orale)
Tmax
Tempo
2008© J.F. DESAPHY
FINE
2008© J.F. DESAPHY