4 > DOSSIER
“Dossier”
Dialogo sui farmaci • n. 1/2005
Il test di valutazione di riferimento per questo dossier è disponibile nella sezione Formazione a Distanza
nel sito internet: www.dialogosuifarmaci.it (con scadenza il 15 maggio 2005).
EPATITE C:
alcuni strumenti per il medico di famiglia
ASPETTI EPIDEMIOLOGICI
n Italia, la prevalenza di soggetti anti-HCV positivi (virus
dell’epatite C) è intorno al
3%, con un gradiente crescente
Nord-Sud:
• 3,2% Nord1;
• 10-12% in Campania e in Sicilia2, 3.
Il 65-70% di soggetti anti-HCV
positivi sono HCV-RNA positivi,
e dunque potenzialmente infettanti1, una percentuale compresa fra il 35%1 e il 50%3 di questi
ha valori di ALT normali. In tutti
gli studi di popolazione la prevalenza di soggetti anti-HCV e
HCV-RNA positivi cresce assai
nettamente con l’età2:
• 1,3% sotto i 30 anni;
• 5% fra 40 e 49 anni;
• 33% oltre i 60 anni.
Il dato indica un effetto di coorte:
l’Italia, come gli altri Paesi industrializzati, ha attraversato un’endemia di epatite C con un picco
tra gli anni ‘60 e ‘804, probabilmente in gran parte iatrogena
(trasfusioni di sangue ed emoderivati, siringhe non a perdere,
strumentazione mal sterilizzata)3.
Attualmente nel mondo industrializzato l’incidenza di nuovi
casi di epatite C è in riduzione.
La coorte di casi infettati ha alimentato in passato la mortalità
per cirrosi, che ora tende a decrescere, mentre aumenta la
I
I pazienti con epatite cronica
sono spesso asintomatici,
anche l’esame fisico
è negativo in assenza
di cirrosi.
La cirrosi iniziale da virus C
nella grande maggioranza
dei casi non ha segni
fisici patologici.
L’infezione acuta da HCV
decorre di solito inavvertita
e senza sintomi:
il 75% cronicizza.
Il medico di famiglia
identifica i soggetti a rischio
e gestisce con l’assistito l’iter
diagnostico e il trattamento.
tabella 1
LA TRASMISSIONE
• La trasmissione attraverso trasfusioni di
sangue o emoderivati è oggi un evento
eccezionale.
• La maggior parte delle nuove infezioni a
genesi identificata sono da droga parenterale.
• In molti casi la genesi dell’infezione rimane sconosciuta.
• Eccezionale o inesistente è l’infezione
sessuale per rapporti monogami5.
• La trasmissione verticale madre-neonato
avviene in circa il 5% dei casi6.
• La trasmissione per punture con ago
contaminato, di particolare interesse per
le professioni sanitarie, avviene in circa
il 3% delle punture7.
tabella 2
mortalità per carcinoma epatocellulare nella coorte di cirrotici
in fase avanzata, perché la migliore gestione terapeutica ne
ha allungato la sopravvivenza.
L’epatite C si trasmette esclusivamente p e r v i a p a r e n t e r a l e ;
altre modalità non sono mai
state chiaramente dimostrate
(ttabella 1).
STORIA NATURALE
pazienti con epatite cronica
sono in maggioranza asintomatici; alcuni manifestano
astenia e facile stancabilità. Anche l’esame fisico è negativo in
I
PRIMI INDIZI DI CIRROSI
DA VIRUS C
I primi indizi di cirrosi sono quelli dell’ipertensione portale:
• piastrinopenia (< 140.000/mmc);
• vena porta di calibro > 13 mm;
• assenza delle variazioni di calibro delle
vene splenica e mesenterica con il respiro8.
assenza di cirrosi. La cirrosi iniziale da virus C tuttavia nella
maggioranza dei casi non ha segni fisici patologici (ttabella 2).
L’infezione acuta da HCV decorre di solito inavvertita e senza sintomi. Con le riserve dovu-
GLOSSARIO
ALT: alanina aminotransferasi, enzima endocellulare della classe delle transaminasi rilasciato nel sangue dagli epatociti danneggiati.
AST: aspartato aminotransferasi, enzima endocellulare della classe delle transaminasi rilasciato nel sangue dagli epatociti danneggiati.
HCV-RNA: materiale genetico che indica la replicazione del virus e pertanto
la persistenza dell’infezione.
SVR, RISPOSTA VIROLOGICA SOSTENUTA: definita come la presenza di HCVRNA<100 copie ml-1,valore mantenuto anche a seguito della cessazione del
trattamento. La misura è usualmente eseguita dopo 24 settimane dal termine della terapia.
EVR, RISPOSTA VIROLOGICA PRECOCE: comportamento di HCV-RNA alla 12a
settimana di trattamento.
DOSSIER < 5
Dialogo sui farmaci • n. 1/2005
te alla difficoltà di identificare le
infezioni acute da HCV, si stima
che il 75% cronicizzi9, anche se
non mancano casistiche con
percentuali di cronicizzazione
attorno al 50%10.
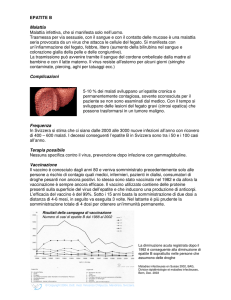
La storia naturale dell’epatite
cronica C è condizionata da molti fattori, è perciò difficile stabilire la prognosi nei singoli pazienti. In assenza di cirrosi, l’epatite
cronica C non pone a rischio la
vita e non altera in misura clinicamente significativa le funzioni
del fegato. Cruciale per la storia
naturale sono pertanto il rischio
e i tempi della progressione in
cirrosi (ttabella 3).
L’indice più accurato della probabilità di progressione è il grado di attività necro-infiammatoria e di fibrosi alla biopsia11. Il rischio di cirrosi è pressoché nullo
nei pazienti con sola portite, e
può raggiungere il 50% a 5 anni
in quelli con setti fibrotici (bridging) e attività necro-infiammatoria severa14.
In Europa e in Nord-America,
ma non in Giappone, il carcinoma epatocellulare (HCC) è pressochè esclusivo dei pazienti con
cirrosi, ed è più frequente nelle
cirrosi da virus C che in quelle
da altra eziologia15. L’incidenza
di HCC è di circa 2-3% per anno
ed è maggiore nel sesso maschile e nella cirrosi più avanzata16.
DIAGNOSI
pazienti con epatite cronica
sono in maggioranza asintomatici, pertanto la diagnosi
deriva generalmente dal risultato positivo della ricerca dei markers virali in soggetti nei quali
un controllo casuale ha rilevato
un aumento delle transaminasi
(AST/ALT, con ALT generalmente > AST).
Si ricerca prima l’anti-HCV, che
nei soggetti immunocompetenti
e senza ipo/a-gammaglobulinemia ha sensibilità e specificità
prossime al 100%4. Quasi tutti i
soggetti con iperAST/ALT e anti-HCV positivo sono HCV-RNA
I
tabella 3
RISCHIO E TEMPI DELLA
PROGRESSIONE IN CIRROSI
• Il tempo medio di progressione dalla diagnosi alla cirrosi è stato stimato in 30
anni11.
• La percentuale di pazienti che progredisce in cirrosi a 20 anni dalla diagnosi è
stimata attorno al 10-15%9 (cifra media
con ampia variabilità).
• Sono associati a maggior probabilità o
rapidità di progressione:
- l’età di infezione > 40 anni,
- la trasmissione post-trasfusionale,
- l’eccesso di peso,
- un consumo di alcool > 50-30 g/die9,11.
• Non supera il 2-4% l’incidenza di cirrosi
nelle giovani donne e nei bambini9.
• È assente o minima la progressione in
cirrosi nelle donne infettate da immunoglobuline anti-Rh contaminate12,13.
positivi; tuttavia, HCV-RNA viene generalmente ricercato, con
tecnica qualitativa, per conferma dell’infezione attiva, e perché solo i soggetti HCV-RNA
positivi sono candidati al possibile trattamento. Anche per
HCV-RNA le tecniche attuali
hanno sensibilità e specificità
prossime al 100%.
Nei soggetti con AST/ALT elevate e anti-HCV e HCV-RNA positivi è teoricamente possibile un’epatite acuta. In assenza di potenziali eventi infettanti questa possibilità è remota. Prima di decidere un’eventuale terapia è opportuno seguire nel tempo l’andamento di AST/ALT e di HCVRNA: si definisce epatite cronica
la persistenza delle alterazioni di
laboratorio per > 6 mesi.
Stabilita la diagnosi di epatite
cronica C, è necessario valutare
il danno del fegato conseguente
all’infezione. I test funzionali
sono troppo poco sensibili per
una valutazione accurata. È però importante, soprattutto per la
prognosi, stabilire se il paziente
è già cirrotico. La cirrosi iniziale
da virus C nella grande maggioranza dei casi non ha segni
fisici patologici, possono essere
presenti:
- fegato duro a margine acuto;
- milza palpabile;
- eritema palmare.
I primi indizi di cirrosi sono
quelli dell’ipertensione portale
(ttabella 2).
La possibile utilità di uno screening per l’epatite C in soggetti a
rischio è stata esaminata dallo
US Preventive Services Task
Force USA, che ha dato parere
negativo17; un dibattito con ragioni pro e contro lo screening è
stato pubblicato sullo stesso
giornale nel novembre 200417.
In Italia, la diffusione dell’infezione cronica da virus C è maggiore che negli Stati Uniti, un
dato che potrebbe incidere sull’eventuale utilità dello screening. Una Consensus Conference è stata indetta dall’Istituto
Superiore di Sanità per il 5-6
maggio 2005.
TRATTAMENTO
pazienti con epatite C vengono di solito afflitti con liimita zioni dietetiche, del tutto im motivate . È probabilmente opportuna la limitazione del sale
nei soggetti con cirrosi avanzata
anche se ancora anascitici, per
la possibilità di facilitare la comparsa di ascite già impending
(incombente). È invece necessaria la limitazione dell’alcool: a
meno di 30 g/die18 negli uomini
e a quantità più basse nelle donne, mentre va abolito nei cirrotici e nei pazienti in corso di trattamento.
Non ci sono farmaci specificamente a rischio nei soggetti con
epatite cronica. Tuttavia, nei cirrotici, la prescrizione di: anti-aggreganti, FANS e anticoagulanti
di solito per patologia cardiovascolare, espone al rischio di
emorragie digestive da varici o
da lesioni mucosali, ed esige la
difficile valutazione del rapporto rischio/beneficio.
L’attuale trattamento dell’epatite
cronica C è basato sulla combinazione di peg-interferone (pegbox 1). Molifn) e ribavirina (rb) (b
te informazioni provengono da
I
6 > DOSSIER
Dialogo sui farmaci • n. 1/2005
tabella 4
box 1
TRATTAMENTO
ALGORITMO DI COMPORTAMENTO
IN UN SOGGETTO
ANTI-HCV POSITIVO
GENOTIPO 1
GENOTIPI 2 O 3
➧
➧
48
24
1.000-1.200, sec. il peso
800
Probabilità di SVR%: senza cirrosi o bridging
57
87
Probabilità di SVR%: con cirrosi o bridging
41
75
Durata trattamento (settimane)
Dosi di ribavirina (mg/die)
Anti-HCV +vo
HCV-RNA
-vo
+vo
STOP
tre grandi RCT, e sono concordanti19-21. Tutti gli studi assumono come risposta terapeutica la
negativizzazione di HCV-RNA,
generalmente parallela alla normalizzazione di AST/ALT, persistente per 6 mesi dopo la fine del
trattamento. Le ragioni di questa
scelta sono tre:
1) circa la metà dei pazienti che
negativizzano HCV-RNA alla fine del trattamento si ripositivizzano;
2) quasi nessuno dei pazienti
con negativizzazione persistente per 6 mesi (risposta virologica
sostenuta, SVR) si ripositivizza;
3) i pazienti con SVR presentano
nel tempo un miglioramento fino
alla normalizzazione delle lesioni necroinfiammatorie ed entro
certi limiti della fibrosi pre-trattamento e non sono descritti casi
di progressione in cirrosi22-24.
Questi ed altri RCT di precedenti regimi di trattamento con interferone hanno concordemente
dimostrato che la probabilità di
SVR è maggiore per i genotipi 2
e 3 rispetto al genotipo 1, ed è
maggiore in assenza di cirrosi o
di fibrosi con setti (bridging). Altri fattori che riducono la probabilità di risposta sono l’eccesso
di peso25, l’età avanzata25 e il
consumo di alcool18. I dati della
tabella 4 sono ricavati da un trial
che impiegava peg-ifn α 2a 21;
sono simili i dati ottenuti con
peg-ifn α 2b19.
Nella pratica corrente, i risultati
della terapia dell’epatite C possono essere meno favorevoli. Gli
RCT infatti (particolarmente
quelli sponsorizzati da ditte farmaceutiche, come sono tutti
quelli dei trattamenti antivirali)
tendono a esagerare i vantaggi
del trattamento sperimentale28,
29. Discutibile è per esempio
l’aggregazione della cirrosi con
la fibrosi con bridging (setti),
che ha come conseguenza probabile la sopravvalutazione dell’efficacia del trattamento nei
pazienti con cirrosi.
C’è una forte spinta commerciale a trattare con peg-ifn + ribavirina il maggior numero possibile
di pazienti con epatite cronica
C. Per decidere se prescrivere
un trattamento che altera per
tempi non brevi la qualità di vita
ed è costoso, è opportuno considerare due elementi:
• a parte l’efficacia del trattamento su un end point surrogato
come la SVR, qual è la sua capacità di modificare in meglio la
storia naturale del paziente?
• quali sono le evidenze di tale
capacità? RCT, studi di coorte
metodologicamente validi, studi
retrospettivi, etc?
Il trattamento dei pazienti con
epatite cronica senza cirrosi
modifica la storia naturale della
malattia perché evita la progressione in cirrosi, e perché la
cirrosi è il passaggio obbligato
per lo scompenso funzionale
del fegato (ascite, emorragie da
ALT?
Stabilmente
normale
Elevata
Monitoraggio
Peg-IFN + ribavirina?
Biopsia:
attività necroinfiammatoria
intensa e/o fibrosi significativa?
No
Non indizi sospetti di cirrosi
e attesa di vita <
10 -20 anni;
Non indizi sospetti di cirrosi
e durata di infezione > 10-20
anni;
Fibrosi assente
o minima (F1).
Sì
Attesa di vita >
10-20 anni;
Assenza di seria
comorbidità;
Infezione contratta in età
avanzata;
Genotipo 2 o 3;
ALT molto elevata (> 4-5 x N);
Motivazione del
paziente.
12a settimana: EVR?
No
Sì
Stop
al trattamento
Continua
il trattamento
Cruciale per la storia naturale sono il ri
DOSSIER < 7
Dialogo sui farmaci • n. 1/2005
varici, encefalopatia), lo HCC e
la morte. Le evidenze sono numerose e concordanti22-24. È tuttavia dubbio il vantaggio del
trattamento in soggetti con
epatite istologicamente lieve
(attività necroinfiammatoria e
fibrosi assenti o modeste), specie se la mancanza di tendenza
alla progressione è suggerita
da una lunga durata della malattia (10-20 anni)14.
Nei pazienti giovani o di mezza
età senza seria comorbidità con
attesa di vita pari o superiore ai
20 anni e con AST/ALT elevate,
il bilancio beneficio/svantaggi è
favorevole e il trattamento è la
decisione generalmente più appropriata30,31, specie se il genotipo 2 o 3 consente una elevata
probabilità di risposta a un regime di 6 mesi di peg-ifn più ribavirina. Al contrario, è dubbio il
vantaggio del trattamento in
soggetti in cui l’assenza di indizi sospetti per cirrosi dopo 10-20
anni di durata dell’infezione
suggerisce che l’epatite non ha
tendenza alla progressione, nelle giovani donne, particolarmente se infettate da immunoglobuline anti-Rh, o nei soggetti in cui una comorbidità importante predice un rischio di mortalità più vicina rispetto a quella
ipotizzabile per l’epatite C, o
controindica il trattamento
(esempio, una grave depressione). Più difficile, quando ad
esempio l’infezione è stata contratta in età avanzata o si ha un
aumento notevole delle transaminasi che fanno temere una
progressione accelerata, o
quando si esclude il rischio di
progressione accelerata prima
di decidere di non trattare. In
questi casi, e più in generale
ogni volta che in base agli indizi clinici il bilancio beneficio/
svantaggi del trattamento è incerto, informazioni spesso decisive si ricavano dalla biopsia. Il
reperto istologico di attività necro-infiammatoria intensa e soprattutto di uno stadio relativamente avanzato di fibrosi sono
forti elementi a favore del trattamento14 .
Nei pazienti con cirrosi prevalgono i dati che riportano un rallentamento dello scompenso e
una ridotta incidenza di HCC.
Tuttavia, la qualità delle evidenze è bassa, e i vantaggi sono riportati soprattutto in studi retrospettivi32. Nonostante la povertà
di evidenze di efficacia sulla storia naturale della cirrosi, il trattamento con peg-ifn più ribavirina è autorizzato nella nota AIFA n. 32.
Nei pazienti che hanno una riattivazione dell’epatite dopo la
precedente risposta di fine trattamento con ifn standard associato o no a ribavirina (relapsers), il ri-trattamento con pegifn più ribavirina è autorizzato
nella nota 32 alla fine del trattamento. Dato che il trattamento
con peg-ifn più ribavirina ha
una maggior efficacia dei regimi
a base di ifn standard associato
o no a ribavirina, il ri-trattamento nei relapsers è logicamente
giustificato, anche se le evidenze della letteratura sono modeste33. Il ri-trattamento dei pazienti senza risposta di fine trattamento non è autorizzato dalla
nota 32 e avrebbe ancor meno
evidenze a sostegno.
Il monitoraggio del trattamento
con peg-ifn + ribavirina si basa
sulla determinazione qualiquantitativa dell’HCV-RNA, che
consente di prevedere nel corso
del trattamento la probabilità di
risposta sostenuta (SVR) ed
eventualmente di sospendere il
trattamento se questa probabilità è molto bassa, evitando gli inconvenienti clinici e i costi di un
trattamento prolungato. Le raccomandazioni della NIH Consensus Conference del 2002, ba-
schio
e i tempi della progressione a cirrosi
sate sui dati di due grandi RCT,
assumono come criterio per decidere se sospendere o seguitare
il trattamento il comportamento
di HCV-RNA la risposta virologica precoce (EVR), cioè alla 12a
settimana di trattamento. I pazienti nei quali alla 12a settimana di trattamento la concentrazione di HCV-RNA nel siero
(metodo quantitativo) si è ridotta
di almeno 2 logaritmi hanno una
probabilità di SVR pari al 68%
valore predittivo positivo ); nei
(v
pazienti nei quali una simile riduzione non si è ottenuta, la
vaprobabilità di SVR è del 2% (v
lore predittivo negativo ). Se si
usa la determinazione qualitativa dell’HCV-RNA, la probabilità di risposta sostenuta è
dell’80% se alla 12a settimana
HCV-RNA si negativizza (valore
predittivo positivo); mentre
scende al 15% se è ancora positivo (valore predittivo negativo).
Le raccomandazioni conseguenti sono di usare come criterio base il comportamento dell’HCVRNA quantitativo alla 12a settimana, che ha un maggior valore
predittivo negativo rispetto al
test qualitativo, e di sospendere
il trattamento se non c’è stata
una riduzione pari o superiore a
2 logaritmi34.
REAZIONI AVVERSE
egli RCT con trattamento
peg-ifn + ribavirina per 48
settimane, le sospensioni
per reazioni avverse (ADR) sono
tra il 1020e il 16%21; intorno al
30% sono le riduzioni di dose
dell’uno o dell’altro farmaco per
reazioni avverse. È probabile
che nella pratica l’incidenza di
ADR sia più alta, perché gli studi in generale sottostimano l’incidenza delle ADR35 e per il variabile rigore con cui i singoli
medici applicano i criteri di
N
8 > DOSSIER
Dialogo sui farmaci • n. 1/2005
box 2
DEPRESSIONE
COSTO DEI TRATTAMENTI DELL’EPATITE C
(a cura della redazione di Dialogo sui farmaci)
Confronto del costo del trattamento con ifn e ifn pegilati (in associazione o meno a ribavirina) di un
paziente per 48 settimane (peso del paziente 70 kg). Per la comparazione sono stati utilizzati i prezzi ex-factory IVA esclusa.
7 16.896,00
peg-ifn α2a (180 mcg sett) + ribavirina
alternative terapeutiche
peg-ifn α2b (1,5 mcg/kg sett)
+ ribavirina
7 14.496,00
7 9.840,00
peg-ifn α2a (180 mcg sett)
7 7.440,96
peg-ifn α2b (1,5 m cg/kg sett)
ifn α2a (180 mcg sett) + ribavirina
7 9.493,92
ifn α 2b (1,5 mcg/kg sett)
+ ribavirina
7 9.432,00
ifn α2a (180 mcg sett)
7 2.437,92
ifn α2b (1,5 mcg/kg sett)
7 2.376,00
7 2.000
7 6.000
7 10.000
7 14.000
a depressione combinata o
meno ad ansia, irritabilità e
insonnia, può essere severa
a rischio di suicidio e può obbligare alla sospensione del trattamento. Pazienti con storia di importante depressione pre-trattamento sono stati sistematicamente esclusi dagli RCT, e non
dovrebbero essere trattati nella
pratica corrente. Se il trattamento è ritenuto necessario
(elevato score istologico di attività necroinfiammatoria e di fibrosi), il contemporaneo uso di
antidepressivi può consentire la
terapia36.
L
7 18.000
DISFUNZIONE TIROIDEA
costo/48 settimane
I regimi terapeutici considerati sono autorizzati nella nota AIFA n. 32, anche se nella pratica i trattamenti più utilizzati sono quelli con peg-ifn + ribavirina. Il confronto dei costi vorrebbe sensibilizzare anche all’aspetto economico, in un momento caratterizzato da esigenze di contenimento della
spesa. La più recente novità nel trattamento dell’epatite cronica C è rappresentata dagli peg-ifn. In
commercio sono disponibili 2 diverse molecole: il peg-ifn α2a e il peg-ifn α2b. Nessuno degli studi
clinici attualmente pubblicati ha valutato l’efficacia del trattamento con peg-ifn α2a vs peg-ifn α2b.
Al termine del 2003 SCHERING PLOUGH ha annunciato l’inizio di un RCT multicentrico* (n~3000) disegnato per confrontare l’efficacia terapeutica di entrambi.
In attesa dei risultati dello studio IDEAL non vi sono dati che suggeriscano quale dei regimi terapeutici sia maggiormente efficace.
* Studio IDEAL (Individualized Dosing Efficacy vs flat dosing to Assess optimaL pegilated interferon therapy) in http://www.idealstudy.com
esclusione. ADR frequenti, ma
raramente causa di sospensione,
sono:
• astenia (50-64%);
• reazioni eritemato-papulose
nella sede di iniezione (3658%);
• febbre post-iniezione di pegifn (43-56%);
• artromialgie (27-56%)36.
Più rare ma più serie sono le
condizioni autoimmuni:
• ipo- o iper-tiroidismo;
• anemia emolitica da autoanticorpi;
• porpora trombocitopenica autoimmune;
• una varietà di effetti come aritmie cardiache, esacerbazione di
psoriasi, sindrome nefrosica e
altri.
Meritano una breve analisi:
• anemia (12-22%);
• depressione (21-34%);
• ipo- o iper-tiroidismo (1,6%)37,38
e percentuali di disfunzione
tiroidea (1,6%) riguardano la
comparsa di dati di laboratorio anormali (aumento o diminizione di TSH e ormoni tiroidei);
più rare sono le manifestazioni
cliniche. Le disfunzioni tiroideee
sono più frequenti nelle donne, e
soprattutto nelle donne nelle
quali è dimostrabile prima del
trattamento la positività di anti-tireoglobulina e anti-microsomi37.
La presenza di disfunzioni tiroidee ha motivato l’avvio del trattamento specifico, mantenendo
quello antivirale38.
L
MONITORAGGIO DEI PAZIENTI
NON TRATTATI
ANEMIA
anemia è prevalenteemolisi
mente dovuta all’e
d a r i b a v i r i n a con depressione midollare da pegifn. Può rendere necessaria
una riduzione del dosaggio
della ribavirina, che si riflette
in una ridotta efficacia del
trattamento. Un RCT recente
ha dimostrato l’efficacia di eritropoietina per prevenire/ correggere l’anemia senza ridurre
la dose di ribavirina39.
L’
a un terzo a metà dei soggetti HCV-RNA positivo
hanno transaminasi normali. Questi soggetti hanno in
genere lesioni istologiche minime, non hanno, o hanno minima
progressione della fibrosi in
biopsie ripetute e non sono riportati casi di progressione dall’epatite alla cirrosi40-43. In pazienti con ALT normali è stato
condotto un RCT con peg-ifn +
ribavirina, con percentuali di risposta sostenuta non differenti
D
DOSSIER < 9
Dialogo sui farmaci • n. 1/2005
da quelle ottenute nei pazienti
con transaminasi elevate44; ma
in mancanza di una dimostrata
potenzialità di progressione verso la cirrosi rimane incerta la base razionale al trattamento. Il
monitoraggio consiste nel dosaggio delle transaminasi ogni
3-4 mesi. Aumenti anche transitori ma ripetuti delle transaminasi devono farli equiparare ai
pazienti con transaminasi stabilmente alte.
Nei pazienti con transaminasi
BIBLIOGRAFIA
1.
2.
3.
4.
5.
6.
7.
8.
9.
10.
11.
12.
13.
14.
15.
Bellentani S et al. Prevalence of chronic liver disease in the general population of Northern Italy:
The Dionysos study. Hepatology 1994; 20: 1442-9.
Guadagnino V et al. Prevalence, risk factors & genotype distribution of hepatitis C virus infection
in the general population: a community-based
survey in Southern Italy. Hepatology 1997; 26:
1006-11.
Di Stefano R et al. Endemic hepatitis C virus infection in a Sicilian town: further evidence for iatrogenic transmission. J Med Virol 2002; 67: 339-44.
Bosch et al. Primary liver cancer: worldwide incidence and trends. Gastroenterology 2004; 127: 5-16.
Vandelli C et al. Lack of evidence of sexual transmission of hepatitis C among monogamous couples: results of a 10-year prospective follow-up
study. Am J Gastroenterol 2004; 99: 855-9.
Conte D et al. Prevalence and clinical course of
chronic hepatitis C virus infection and rate of HCV
vertical transmission in a cohort of 15.250 pregnant women. Hepatology 2000; 31: 751-5.
Lauer GM et al. Medical progress. Hepatitis C virus
infection (>HCV<). N Engl J Med 2001; 345: 41-52.
Pagliaro L et al. Portal hypertension in cirrhosis:
natural history. In: Bosch J and Groszmann RJ Eds.
Portal Hypertension. Pathophysiology and Treatment. Oxford: Blackwell Scientific Publications.
1994: 72-92.
Hoofnagle J H. Course and outcome of hepatitis C.
Hepatology 2002; 36: S21-S29.
Gerlach JT et al. Acute hepatitis C: high rate of
both spontaneous and treatment-induced viral
clearance. Gastroenterology 2003; 125: 80-8.
Poynard T et al. Opolon P for the OBSVIRC, METAVIR, and DOSVIRC Groups. Natural history of liver
fibrosis progression in patients with chronic hepatitis C. Lancet 1997; 349: 825-32.
Kenny-Walshe E. Irish Hepatology Research Group.
Clinical outcomes after hepatitis C infection from
contaminated Anti-D Immune Globulin. N Engl J
Med 1999; 340: 1228-33.
Wiese M et al. for the East German Hepatitis C
Study Group. Low frequency of cirrhosis in a hepatitis C (Genotype 1b) single source outbreak in
Germany: a 20 year multicenter study. Hepatology
2000; 32: 91-6.
Pagliaro L et al. Natural history of chronic hepatitis C (>HCV<). Ital J Gastroenterol 1999; 31: 28-44.
Simonetti RG et al. Hepatitis C virus infection as a
risk factor for hepatocellular carcinoma in patients
with cirrhosis. Ann Intern Med 1992; 116: 97-102.
Autore
elevate, l’entità dell’aumento
ha una certa correlazione con la
severità delle lesioni necroinfiammatorie alla biopsia e con il
ritmo di progressione della fibrosi45. La correlazione è però
imperfetta14, 46. Pertanto, l’eventuale decisione di non trattare non può essere basata sulle
sole transaminasi, ma sui criteri
considerati in precedenza (vedi
“Trattamento), ed eventualmente le informazioni della
biopsia.
F D EL Z OTTI e C M ELOTTI , MMG,
ULSS 20 di Verona - L M ASIERO ,
Servizio Epidemiologia e Biostatistica, ULSS 20 di Verona - F ANTONUCCI, Redazione Dialogo sui Farmaci
16. Donato MF et al. High rates of hepatocellular carcinoma in cirrhotic patients with high liver cell
proliferative activity. Hepatology 2001; 34: 523-8.
17. U.S. Preventive Services Task Force. Clinical Guidelines. Screening for hepatitis C virus infection in
adults: Recommendation statement. Ann Intern
Med 2004; 140: 462-79.
18. Peters MG et al. Alcohol use and hepatitis C. Hepatology 2002; 36: S220-5.
19. Manns MP et al. Peginterferon alfa-2b plus ribavirin compared with interferon alfa-2b plus ribavirin
for initial treatment of chronic hepatitis C: a randomised trial. Lancet 2001; 358: 958-65.
20. Fried MW et al. Peginterferon alfa-2a plus ribavirin
for chronic hepatitis C virus infection. N Engl J
Med 2002; 347: 975-82.
21. Hadziyannis SJ et al. Peginterferon alfa2a and ribavirin combination therapy in chronic hepatitis
C. A randomized study of treatment duration and
ribavirin dose. Ann Intern Med 2004; 140: 346-35.
22. Marcellin P et al. Long term histologic improvement and loss of detectable intrahepatic HCV RNA
in patients with chronic hepatitis C and sustained
response to interferon alfa. Ann Intern Med 1997;
127: 875-81.
23. Lau DTY et al. 10-year follow-up after Interferonalfa therapy for chronic hepatitis C. Hepatology
1998; 28: 1121-7.
24. Shiratori Y et al. Histologic improvement of fibrosis in patients with hepatitis C who have sustained
response to Interferon therapy. Ann Intern Med
2000; 132: 517-24.
25. Zeuzem S. Heterogeneous virologic response rates interferon-based therapy in patients with
chronic hepatitis C; who responds less well? Ann
Intern Med 2004; 140: 370-81.
26. Falck-Ytter Y et al. Surprisingly small effect of antiviral treatment in patients with hepatitis C. Ann
Intern Med 2002; 136: 288-92
27. Cawthorne CH et al. Limited success of HCV antiviral therapy in United States Veterans. Am J Gastroenterol 2002; 97: 149-55
28. Bekelman JE et al. Scope and impact of financial
conflicts of interest in biomedical research. A
systematic review. JAMA 2003; 289: 454-65.
29. Als-Nielsen B et al. Association of funding and
conclusions in randomized drug trials. A reflection of treatment effect or adverse events? JAMA
2003; 290: 921-8.
30. Wong JB et al. Watchful waiting with periodic liver biopsy vs immediate empirical therapy for
histologically mild chronic hepatitis C. A cost effectiveness analysis. Ann Intern Med 2000; 133:
665-75.
31. Salomon JA et al. Cost-effectiveness of treatment
for chronic hepatitis C infection in an evolving patient population. JAMA 2003; 290: 228-37.
32. Yoshida H et al. Interferon therapy prolonged life
expectancy among chronic hepatitis C patients.
Gastroenterology 2002; 123: 483-91.
33. Strader DB et al. AASLD Practice Guidelines. Diagnosis, management, and treatment of hepatitis
C. Hepatology 2004; 39: 1147-71.
34. Davis G. Monitoring of viral levels during therapy
of hepatitis C. Hepatology 2002; 36: S145-S151.
35. Ioannidis JPA et al. Completeness of safety reporting in randomized trials. An evaluation of 7 medical areas. JAMA 2001; 285: 437-43.
36. Aspinall RJ et al. Review article: the management
of side-effects during therapy for hepatitis C. Aliment Pharmacol Ther 2004; 20: 917-29.
37. Russo MW et al. Side effects of therapy for chronic
hepatitis C. Gastroenterology 2003; 124: 1711-19.
38. Bini EJ et al. Incidence of thyroid dysfunction during alfa-2b and ribavirin therapy in men with
chronic hepatitis C. Arch Intern Med 2004; 164:
2371-76.
39. Afdhal NH et al. Epoetin alfa maintains ribavirin
dose in HCV-infected patients: A prospective, double-blind, randomized controlled study. Gastroenterology 2004; 126: 1302-11.
40. Persico M et al. Natural history of hepatitis C virus
carriers with persistently normal aminotransferase levels. Gastroenterology 2000; 118: 760-4.
41. Mathurin P et al. Slow progression rate of fibrosis
in hepatitis C virus in patients with persistently
normal Alanine Transaminase activity. Hepatology
1998; 27: 868-72.
42. Martinot-Peignoux M et al. Prospective study on
anti hepatitis C virus positive patients with persistently normal serum alanine transaminase levels
with or without detectable serum hepatitis C virus
DNA. Hepatology 2001; 34: 1000-5.
43. Hui CK et al. A comparison in the progression of liver fibrosis in chronic hepatiris C between persistently normal and elevated transaminase. J Hepatol 2003; 38: 511-17.
44. Zeuzem S et al. PEGASYS Study NR16071 Investigator Group Peginterferon alfa 2a (40 kilodaltons)
and ribavirin in patients with chronic hepatitis C
and normal aminotransferase levels. Gastroenterology 2004; 127: 1724-32.
45. Ghany MG et al. Progression of fibrosis in chronic
hepatitis C. Gastroenterology 2003; 124: 97-104.
46. Pradat P et al. Predictive value of ALT levels for histologic findings in chronic hepatitis C: A European Collaborative Study. Hepatology 2002; 36:
973-7.
L PAGLIARO,
Istituto di Medicina
Generale e Pneumologia,
Università degli Studi di Palermo,
Ospedale V. Cervello
Hanno collaborato