PRIMO PRINCIPIO DELLA TERMODINAMICA
In una trasformazione adiabatica:
Eint
L
In una trasformazione isocora:
Eint
Q
In una trasformazione generica:
Eint
L Q
(7)
(Primo principio della termodinamica)
Applicazione del principio di conservazione dell’energia a
sistemi aventi un gran numero di particelle.
N.B.: La (7) è una forma ridotta del principio generale di
conservazione dell’energia: non include il termine relativo a
possibili variazioni di energia cinetica che si avrebbe se il
centro di massa del sistema fosse in moto rispetto al
riferimento del laboratorio.
Eint è una funzione di stato (dipende soltanto dallo stato del
sistema).
Eint dipende soltanto dallo stato iniziale (A) e finale (B) ma
non dalla trasformazione.
L dipende non solo dallo stato iniziale e finale ma anche dalla
trasformazione.
Q
Eint
L
Q si comporta come L
Per una trasformazione infinitesima:
dEint
dL dQ
dove dL e dQ sono quantità infinitesime e non differenziali
esatti (dEint invece lo è).
CALORE SPECIFICO DEI SOLIDI
In un solido ogni atomo può oscillare intorno alla posizione di
equilibrio in tre direzioni indipendenti.
Ciò implica:
Energia cinetica con 3 termini quadratici
(1/2 m vx2, 1/2 m vy2, 1/2 m vz2)
Energia potenziale con altri 3 termini quadratici
(1/2 k x2, 1/2 k y2, 1/2 k z2)
Quindi:
Ogni atomo possiede 6 gradi di libertà.
L’energia interna di un solido costituito da N atomi ed n moli,
per il teorema di equipartizione dell’energia, vale:
Eint
1
6N ( k T )
2
(n N A ) (3 k T )
3nR T
Se si fornisce al solido una quantità di calore Q, aumentando
la sua temperatura di T, la variazione di energia interna è:
Eint
3 nR T
Per il primo principio della termodinamica, essendo nullo il
lavoro compiuto sul sistema, si ottiene:
Eint
Q
L Q
3 nR T
Per la definizione di calore specifico molare, si ha quindi:
c
Q
n T
3nR T
n T
3R
Essendo R = 8.31 J/(mol K), si ricava in definitiva che:
c
25 J/(mol K),
in accordo con quanto trovato da Dulong e Petit (valore
asintotico del calore specifico molare alle alte temperature).
CALORI SPECIFICI DI UN GAS IDEALE
Il gas ideale è un tipico esempio in cui il valore del calore
specifico dipende dalla trasformazione.
Calore specifico molare a volume costante
Si definisce calore specifico molare a volume costante di un
dato sistema costituito da n moli la grandezza:
Q
n T
cV
V cost
Siccome in questo caso il calore viene ceduto al sistema
tramite una trasformazione isocora (L = 0), per il primo
principio della termodinamica si può scrivere:
Eint
Q
L Q
Q
n T
Eint
n T
cioè:
cV
(8)
Ricordando i risultati precedentemente ottenuti usando il
principio di equipartizione dell’energia, si ottengono, a
seconda dei vari tipi di gas perfetto, le seguenti espressioni
per la variazione di energia interna:
1)
Gas monoatomico
Eint
2)
Eint
3)
Eint
3
nR T
2
Gas biatomico
5
nR T
2
Gas poliatomico
3 nR T
Sostituendo questi valori nella (8), si ottiene infine:
cV
3
R, cV
2
5
R, cV
2
3R
per un gas ideale monoatomico, biatomico e poliatomico,
rispettivamente.
Calore specifico molare a pressione costante e
relazione di Mayer
Si definisce calore specifico molare a pressione costante di
un dato sistema costituito da n moli la grandezza:
cp
Q
n T
(9)
p cost
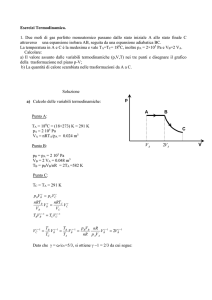
Consideriamo due trasformazioni, la prima isocora (A B) e
la seconda isobara (A C), che connettono lo stato A a
temperatura T con due stati B e C appartenenti ad una stessa
isoterma di temperatura T + T (v. figura).
Siccome il gas è ideale (Eint funzione solo della temperatura), la
sua energia interna negli stati B e C vale:
Eint ( B)
Eint (C)
Pertanto:
Eint ( A
B)
Eint ( A
C)
(10)
Nella trasformazione isocora, per il primo principio e per la
(8), risulta:
Eint ( A
B) Q
n cV T
Nella trasformazione isobara, per il primo principio, per la (9)
e per l’equazione di stato, si ha:
Eint ( A
C)
Q
L
n cp T
p V
n cp T
nR T
Sostituendo le due precedenti espressioni nella (10) si ricava:
n cV T
n cp T
nR T
da cui si ottiene la cosiddetta relazione di Mayer:
cp
cV
R
Sfruttando i valori del calore specifico molare a volume
costante prima ricavati, risulta infine:
cp
5
R, c p
2
7
R, c p
2
4R
per un gas ideale monoatomico, biatomico e poliatomico,
rispettivamente.
APPLICAZIONI DEL PRIMO PRINCIPIO DELLA
TERMODINAMICA
Trasformazioni adiabatiche ed esponente adiabatico
Per un gas ideale (monoatomico) la variazione infinitesima di
energia interna è data da:
dEint
3
n R dT
2
n cV dT
D’altra parte, per il principio della termodinamica, in forma
infinitesima, valido per una trasformazione adiabatica:
dEint
dL dQ dL
p dV
da cui:
p dV
n cV dT
(11)
L’equazione di stato si può scrivere in forma differenziale
come:
d ( pV )
p dV
d (n R T )
V dp
n R dT
che, per la (11) e la relazione di Mayer, diventa:
V dp
p dV
n R dT
n cV dT
n R dT
n c p dT
Dividendo membro a membro la precedente per la (11),
risulta:
V dp
p dV
n c p dT
n cV dT
cp
cV
Riordinando si trova:
dp
p
dV
V
Integrando tra lo stato iniziale e quello finale:
pf
dp
p
pi
Vf
dV
V
Vi
ln
pf
pi
ln
Vf
Vi
che può essere scritta come:
pi Vi
p f Vf
Ma, essendo i ed f due stati qualsiasi, arbitrariamente scelti, si
giunge alla formula più generale:
pV
costante
(12)
Questa equazione esprime la relazione fra la pressione ed il
volume di un gas ideale sottoposto ad una trasformazione
adiabatica.
Ricordando la definizione dell’esponente adiabatico ed i
valori dei calori specifici a pressione e a volume costante per i
vari tipi di gas ideale, si ha:
1)
Gas monoatomico
cp
cV
2)
5
1.67
3
Gas biatomico
cp
cV
3)
52
32
72
52
7
1.40
5
Gas poliatomico
cp
cV
4
1.33
3
Si osservi che:
pV
costante
( p V )V
1
costante
e, ricordando l’equazione di stato, si può scrivere:
TV
1
costante
(13)
Questa equazione esprime la relazione fra la temperatura ed il
volume di un gas ideale sottoposto ad una trasformazione
adiabatica.
N.B.: la costante che compare nella (13) differisce da quella
che compare nella (12) per il fattore moltiplicativo 1/(n R).
Trasformazioni isoterme
Siccome per un gas ideale la variazione di energia interna è
proporzionale alla variazione di temperatura, in una
trasformazione isoterma si ha:
Eint
0
E quindi, per il primo principio:
Q =
L
Se sul gas si compie un lavoro L (positivo) un’equivalente
quantità di calore si trasferisce dal gas all’ambiente esterno:
nulla del lavoro svolto rimane immagazzinato come energia
interna del gas.
Trasformazioni isocore
In questo caso, essendo L = 0, come abbiamo già visto, si ha:
Eint
Q
Tutto il calore assorbito (o ceduto) dal sistema si tramuta in
un incremento (o in un decremento) di energia interna.
Trasformazioni cicliche
In un ciclo:
Eint
0
Q =
L
(14)
In una trasformazione ciclica il calore assorbito dal sistema è
uguale al lavoro compiuto sul sistema cambiato di segno.
1) Se in un diagramma V-p un ciclo è percorso in senso
orario, allora L < 0 (lavoro positivo compiuto dal sistema) e,
per la (14), Q > 0 (calore netto assorbito dal sistema).
2) Se un ciclo è percorso in senso antiorario, allora L > 0
(lavoro positivo compiuto sul sistema) e, per la (14), Q < 0
(calore netto ceduto dal sistema all’ambiente).
Su un ciclo di tipo (1) si basa il funzionamento delle
macchine termiche.
Il calore Q1, assorbito da un termostato a temperatura T1, in
parte viene convertito in lavoro meccanico (L < 0), in parte
(Q2) viene restituito all’ambiente circostante a temperatura T2
(con T2 < T1) .
Cioè:
Q1 = Q2 + L
Q = Q1
Q2 = L
La macchina, anche se avviata, cessa di fornire lavoro se non
assorbe calore impossibilità del cosiddetto moto perpetuo
di prima specie
Su un ciclo di tipo (2) si basa il funzionamento delle
macchine frigorifere.
Espansione libera
In questo caso un gas è inizialmente concentrato nella parte
sinistra di un contenitore adiabatico. Aprendo il rubinetto il
gas si espande: nel processo non viene effettuato alcun lavoro
(L = 0) e non si ha nessuno scambio di calore con l’ambiente
(Q = 0).
Per il primo principio:
Eint
0
T
0
Durante l’espansione la temperatura del gas rimane costante.
L’espansione libera è un esempio tipico di processo di non
equilibrio: lo stato iniziale (a sinistra nella figura) e quello
finale (a destra) sono stati di equilibrio; durante l’espansione,
però, i parametri di stato del sistema non hanno valori definiti
e la trasformazione non può essere rappresentata con un
grafico nel piano V-p.