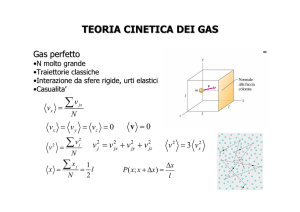
1.4 CALORE SPECIFICO
Il calore specifico indica quanta energia bisogna cedere ad un corpo per innalzarne la
temperatura di un grado.
Il calore specifico di un gas dipende dal numero dei gradi di libertà delle molecole che lo
compongono (occorrerà meno energia per scaldare un gas monoatomico che uno
biatomico, in quanto per il secondo sono in gioco altri gradi di libertà oltre quelli di tipo
traslazionale).
Si definisce calore specifico a volume costante:
CV
dU
dT
(molare)
dove con U rappresenta l’energia interna molare.
Il prodotto del calore specifico per la massa è detto capacità termica.
Per un gas monoatomico:
CV
3
R
2
(servono 3 cal per alzare di 1 °K la temperatura di una mole di gas)
In prima approssimazione il Cv non dipende quindi dalla temperatura.
Per il calore specifico a pressione costante si deve aggiungere anche il lavoro svolto
dal gas nella sua espansione durante il riscaldamento:
pV nmolRT
che, per nmoli = 1 e T = 1°K, vale proprio R.
Pertanto, l’energia che occorre fornire ad una mole di gas per innalzarne la temperatura di
un grado a pressione costante risulta :
CP
dU pV
CV R
dT
T
(molare)
Per un gas monoatomico:
CP
5
R
2
(le due calorie in più servono a far espandere il gas)
Per un gas biatomico i gradi di libertà sono 5, in quanto vanno aggiunti i due rotazionali,
pertanto:
U
5
RT
2
CV
5
R;
2
CP
7
R
2
Si definisce coefficiente adiabatico del gas il rapporto dei due calori specifici appena
definiti:
CP
CV
5
(per un gas monoatomico);
3
7
(per un gas biatomico)
5
Es.: Quanta energia serve per innalzare di un grado la temperatura dell’aria di una stanza di 5x5x3 m3?
La pressione della stanza rimane costante (1 atmosfera) durante il riscaldamento; dunque avremo:
E
Vn
5 5 3106 2.51019 7
CP
2 2 10 4 cal
23
No
6 10
2
è la stessa quantità di energia necessaria per alzare di un grado la temperatura di 20 litri d’acqua; in
realtà serve molta più energia in quanto bisogna riscaldare anche gli oggetti contenuti nella stanza…