Esercitazione XI - Trasformazioni termodinami-
che
Il primo principio della termodinamica aerma che la variazione dell'energia
interna di un sistema ∆Eint è uguale alla somma dell'energia data al sistema
come calore Q e del lavoro fatto sul sistema W ,
∆Eint = Q + W .
Nel caso in cui il sistema in esame sia del gas contenuto in un pistone, il
lavoro W fatto su di un gas quando il suo volume varia da Vi a Vf è
Z Vf
W =−
P dV .
Vi
Nel caso di un gas ideale P , V e T sono legate dall'equazione di stato
P V = nRT ,
dove n è il numero di moli da cui è costituito il gas e
J
.
moleK
Per denizione, una mole di gas è quella quantità di gas che contiene NA
molecole, dove
R = 8, 314
NA = 6, 02 × 1023 (Numero di Avogadro) .
Studiamo ora alcune fondamentali trasformazioni dei gas perfetti
Isobara
Durante una trasformazione isobara la pressione del gas rimane costante
P = cost.
Il lavoro W fatto sul gas quando il suo volume varia da Vi a Vf è
Z Vf
Z Vf
W =−
P dV = −P
dV = −P (Vf − Vi ) .
Vi
Vi
La variazione dell'energia interna ∆Eint è
∆Eint = Q + W .
Isocora
Durante una trasformazione isocora il volume del gas rimane costante
V = cost.
Il lavoro W fatto sul gas è nullo in quanto Vi = Vf ,
W =0.
La variazione dell'energia interna ∆Eint è
∆Eint = Q .
1
Isoterma
Durante una trasformazione isoterma la temperatura del gas rimane costante
T = cost.
Per calcolare il lavoro W fatto sul gas quando il suo volume varia da Vi a Vf
uso che
P V = nRT
nRT
,
V
⇒ P =
da cui
Z
Z
Vf
W =−
Vf
P dV = −
Vi
Vi
nRT
dV = −nRT
V
Z
Vf
Vi
dV
= −nRT ln
V
µ
Vf
Vi
¶
.
Poiché l'energia interna Eint di un gas perfetto dipende solo dalla sua temperatura si ha
∆Eint = 0 ,
da cui
µ
Q = −W = nRT ln
Vf
Vi
¶
.
Adiabatica
Durante una trasformazione adiabatica il gas non scambia calore con l'esterno,
Q=0.
Si dimostra che in una trasformazione adiabatica
P V γ = cost. ⇒ P =
cost.
,
Vγ
dove per un gas monoatomico γ = 5/3 ≈ 1, 67.
Il lavoro W fatto sul gas quando il suo volume varia da Vi a Vf è
Z
Z
Vf
W =−
Vf
P dV = −
Vi
Vi
´ P V −P V
cost.
cost. ³ −γ+1
f f
i i
−γ+1
dV
=
V
−
V
=
.
i
Vγ
γ−1 f
γ−1
La variazione dell'energia interna ∆Eint è
∆Eint = W .
2
Calori specici molari dei gas perfetti
In una trasformazione isocora il calore Q che è necessario fornire a n moli di gas
per far variare la sua temperatura di una quantità ∆T è
Q = nCV ∆T ,
dove CV è il calore specico molare a volume costante.
In una trasformazione isobara il calore Q che è necessario fornire a n moli
di gas per far variare la sua temperatura di una quantità ∆T è
Q = nCP ∆T ,
dove CP è il calore specico molare a pressione costante.
Vale che
CP − CV
CP
CV
=
R,
=
γ.
Per un gas monoatomico CP = 25 R e CV = 32 R.
Trasformazioni
Esercizio 1
Un recipiente contenente n = 2 moli di un gas perfetto alla pressione PA =
1atm è a contatto con un termostato che lo mantiene alla temperatura TA =
300K . Lentamente si comprime il gas no a farne dimezzare il volume. In
seguito staccato il recipiente dal termostato e mantenendo la pressione costante,
si porta il recipiente ad un volume pari ad un terzo di quello iniziale. Calcolare
• La temperatura e la pressione nale del gas.
• Il lavoro totale compiuto dal gas.
Soluzione
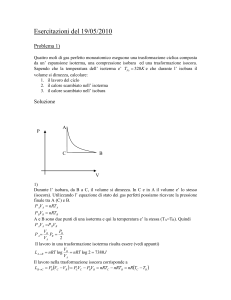
Sia A lo stato iniziale del gas, B lo stato del gas dopo la compressione che
ne dimezza il volume e C lo stato in cui il volume è ridotto a un terzo di quello
iniziale.
La presenza di un termostato fa si che
A → B = isoterma ,
mentre per ipotesi
B → C = isobara .
Si vogliono calcolare TC e PC .
Per ipotesi PC = PB e per la legge dei gas perfetti
3
PB =
nRTB
nRTA
=2
= 2PA ⇒ PC = 2atm .
VB
VA
Analogamente
TC =
P C VC
1 P B VA
2 P A VA
2
=
=
= TA = 200K .
nR
3 nR
3 nR
3
Il lavoro totale WAC compiuto sul gas nella trasformazione A → B → C è la
somma del lavoro WAB compiuto durante l'isoterma e del lavoro WBC compiuto
durante l'isobara,
WAC
=
WAB
=
WBC
=
WAB + WBC ,
µ
¶
µ ¶
VB
1
−nRTA ln
= −nRTA ln
= 3458J ,
VA
2
1
1
−PB (VC − VB ) = PA VA = nRTA = 1663J ,
3
3
da cui
WAC = 5121J .
Il lavoro compiuto dal gas è W = −5121J .
Esercizio 2
Calcolare il lavoro compiuto da n = 3 moli di gas perfetto durante la
trasformazione A → B → C ,
A → B = isocora
B → C = isoterma ,
dove
PA = 2atm
TA = −70◦ C
PB = 2PA
TB = 133◦ C
PC = PA
TC = TB .
Soluzione
Il lavoro WAC fatto sul gas nella trasformazione A → B → C è
WAC = WAB + WBC ,
dove WAB è il lavoro fatto sul gas nella trasformazione isocora e WBC è il
lavoro fatto sul gas nella trasformazione isoterma.
Dato che in una generica trasformazione isocora il lavoro fatto sul gas è nullo
si ha WAB = 0.
Rimane da calcolare WBC e usando l'espressione generale del lavoro in una
isoterma si ha
4
µ
WBC = −nRTB ln
VC
VB
¶
.
Si è scritto TB ma si sarebbe potuto egualmente scrivere TC in quanto TB =
TC . TB lo conosciamo ma dobbiamo convertirlo in Kelvin. Si ricordi che
0◦ C = 273, 15K ,
da cui
TB = TC = 406K .
Si osservi che non ci interessa davvero sapere chi siano VB e VC bensì il loro
rapporto. Dato che
VB =
nRTB
nRTC
, VC =
,
PB
PC
e TB = TC e PB = 2PC si ha
VC
PB
=
=2.
VB
PC
Sostituendo questi valori nella formula per WBC si ha che il lavoro fatto sul
gas è
W = AC = WBC = −3 × 8, 314J/moleK × 406K ln 2 = 7019J .
Perciò il lavoro fatto dal gas è −7019J .
Si osservi che con i dati a disposizione avremmo potuto calcolare VB e VC ,
VB
=
VC
=
3 × 8, 314J/moleK × 406K
nRTB
=
= 0, 025m3 ,
PB
4 × 105 P a
nRTC
3 × 8, 314J/moleK × 406K
=
= 0, 05m3 ,
PC
2 × 105 P a
dove si è usato il fattore di conversione atmosf ere − P ascal
1atm = 1, 013 × 105 P a .
Cicli
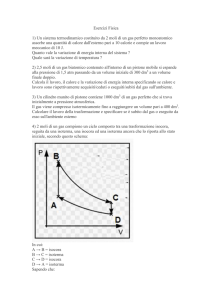
Esercizio 3
Calcolare il calore Q̂ ceduto da 1 n = 2 moli di gas monoatomico durante il
ciclo A → B → C → D → A,
A → B = isocora
B → C = isoterma
C → D = isocora
D → A = isoterma ,
1 Si osservi sin da ora che il calore Q̂ ceduto dal gas è opposto al calore Q assorbito dal gas:
Q̂ = −Q.
5
dove
PC
4
= TA .
PA = 2 × 105 P a
PB = 4PA
PC = 2, 285 × 105 P a
PD =
TA = 122K
TB = 4TA
TC = 4TA
TD
Soluzione
Poiché abbiamo a che fare con un ciclo ∆Eint = 0 e il calore Q assorbito dal
gas (o equivalentemente ceduto al gas) è
Q = −W ,
dove W è il lavoro fatto sul gas. Si ha
W = WAB + WBC + WCD + WDA = WBC + WDA ,
in quanto il lavoro compiuto nelle trasformazioni isocore è nullo. Sfruttando
l'espressione generale del lavoro compiuto in una isoterma si ha
¶
µ
¶
PB
VC
= −nRTB ln
,
−nRTB ln
VB
PC
µ
¶
µ
¶
VA
PD
−nRTD ln
= −nRTD ln
.
VD
PA
µ
WBC
=
WDA
=
Dai dati del problema si ha
TB = 488K , TD 122K ,
PB
4PA
PD
PC
=
= 3, 5 ,
=
= 0, 286 ,
PC
PC
PA
4PA
da cui
µ
Q = −W = nR(TB − TD ) ln
4PA
PC
e inne
Q̂ = −Q = −7624J .
6
¶
= 7624J ,