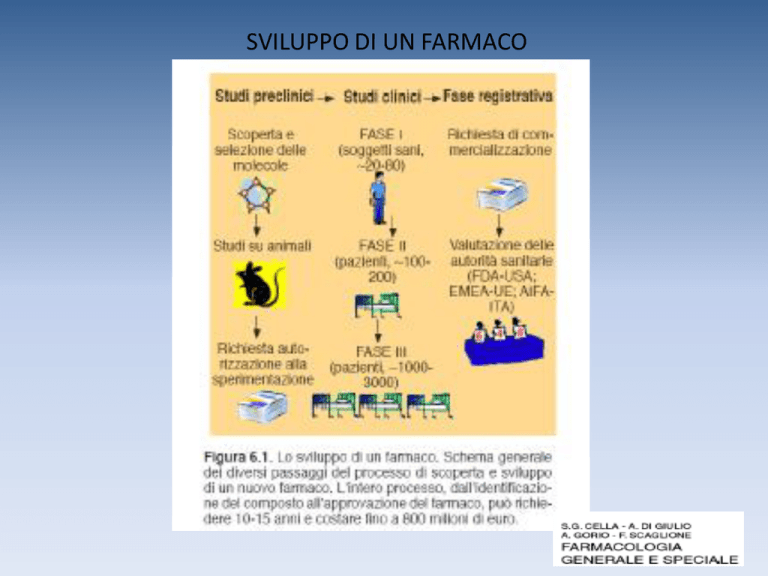
SVILUPPO DI UN FARMACO
Storicamente l’identificazione e lo sviluppo di nuovi
farmaci di è evoluta da
Approccio EURISTCO (empirico)
Approccio MECCANICISTICO
Approccio ORIENTATO AL BERSAGLIO
Approccio EURISTICO ( è la molecola
che guida il processo):
•Valutazione di prodotti naturali o di
sintesi per loro attività in tradizionali
modelli animali
•Sforzi concentrati su standardizzazione
di processi di sintesi o estrazione,
miglioramento della stabilità o
dell’attività apportando modifiche
strutturali sulla base del bersaglio
L’avvento della tecnologi a del DNA ricombinante della
chimica combinatoriale e della modellistica molecolare
(cristallografia, simulazione al computer (in silico)) hanno
posto le basi per un rovesciamento dell’approccio molecolainvestigatore:
1. Maggiore razionalità nella selezione e sintesi di farmaci
mirati ad una patologia
2. Rivoluzione col diffondersi di topi KnocK out per
determinati geni
ORIENTAMENTO AL BERSAGLIO
La possibilità di inattivare un gene e
descriverne gli effetti funzionali permette
di sviluppare farmaci innovativi con
criterio mirato al bersaglio.
Questo approccio supera quello euristico,
ma continua ad avvalersi del
meccanicistico sul piano della ingegneria
farmaceutica
Fenotipi murini KO e sviluppo di farmaci orientati al bersaglio: alcuni
recenti esempi
da Annunziato L. e Di Renzo G. “Trattato di Farmacologia capitolo 2 , Idelson-Gnocchi 2010
Principali fasi e attività della sperimentazione preclinica di un nuovo farmaco
da Annunziato L. e Di Renzo G.
“Trattato di Farmacologia
capitolo 2 , Idelson-Gnocchi
2010
VALUTAZIONE DEL CANDIDATO CLINICO
Una volta selezionato il bersaglio l’attenzione si sposta
sulla nuova entità molecolare (NME) che si vuole
sviluppare “clinical candidate”
•Spesso sono molecole già presenti nel portafoglio –
prodotti che si ritengono strutturalmente idonei per
modellare sul bersaglio (agonisti, antagonisti specifici,
inibitori a basso peso molecolare)
•Oppure si lancia un programma di sintesi guidata dalla
conoscenza della struttura bersaglio ( modellistica
molecolare al sito attivo di enzimi o domini recettoriali)
o si sviluppano anticorpi monoclonali specifici.
Si cominciano quindi gli studi molecolari di
primo livello che valutano l’attività su modelli
animali al contesto Farmaco-Bersaglio che si è
selezionato. Un aspetto saliente è anche la
formulazione farmaceutica identificando
veicoli appropriati e loro eventuale tossicità
Valutazione funzionale di un preclinical candidate
da Annunziato L. e Di Renzo G. “Trattato di Farmacologia capitolo 2 , Idelson-Gnocchi 2010
Iniziano quindi gli studi di” secondo livello”
che sono inizialmente la valutazione della
tossicità d’organo e di sistema
Segue il terzo livello : ADME sia in vivo
che in vitro che in silico
La fase cruciale della valutazione
del Cinical Candidate è
sicuramente la valutazione della
sicurezza o tossicità.
ATTIVITÀ versus TOSSICITÀ
Negli ultimi 40 anni sono aumentate
le prove biologiche per ridurreil
rischio che che nuove molecole
candidate adivenire farmaci abbiano
effetti tossici sull’uomo.
Obbiettivo:
•Valutare effetti collaterali
•Valutare gravi effetti tossici
Sulla base di precisi studi condotti secondo
normative si deve :
1. Definire la massima dose che non induce
effetto diretto o indiretto su organi e sistemi
(NOEL):
2. Definire la dose che induce effetti nocivi
/tossici (NOAEL) sia la loro natura
3. Definire la relazione tra dose terapeutica e
dose tossica
4. Individuare il bersaglio dell’effetto tossico
(cellula, organo, sistema) sia del prodotto
originale che dei suoi metaboliti
5. Definire la reversibilità o meno degli effetti
nocivi
Terminologie della fase preclinica
ADME( assorbimento, distribuzione metabolismo, eliminazione)
DE50 (Dose efficace 50 o mediana)
DL50 (Dose letale 50 o mediana)
DLT. (Dose Limitante la Tossicità)
DT50 (Dose tossica 50 o mediana)
HED (Dose equivalente umana)
MOS (margine di sicurezza)
MRS (Dose sicura massima raccomandata)
NOAEL (Livello di non Effetto avverso osservabile)
QSAR ( studio delle relazioni struttura chimica/attività)
Prove di tossicità nell’animale: repertori e costi
da Annunziato L. e Di Renzo G. “Trattato di Farmacologia capitolo 2 , Idelson-Gnocchi 2010
Indice terapeutico
% Risposta effetto massimale
100
90
80
70
60
50
40
30
20
10
0
0
2
4
Log dose (mg/Kg)
Comparazione di:
ED= dose efficace
TD= dose tossica
LD= dose letale
6
8
% Risposta (scala Probit)
Indici di sicurezza (margini)
100
90
80
70
60
50
40
30
20
10
0
0
LD10
2 ED25
4
ED90
ED75
Log dose (mg/Kg)
Comparazione di:
Curva dose/effetto terapeutico
Curva dose/effetto nocivo (1°caso)
Curva dose/effetto nocivo(2°caso)
6
8
L’indice della sicurezza del farmaco è talvolta
definito come rapporto LD50/ED50 detto anche
indice terapeutico, ma questo può essere
ingannevole se le curve risposta-Log dose per
effetto desiderato e morte non sono parallele.
Perciò è preferibile calcolalo come LD10/ED90
Il MARGINE DI SICUREZZA è un evoluzione
ulteriore di questi indici ed è NOAEL/ED80
Eseguite le prove di tossicità il farmaco può essere sottoposto
all’esame delle autorità regolatorie per un giudizio di
ammissibilità agli studi clinici di FASE 1
Alcuni studi preclinici possono essere riattivati se nelle prime
indagini nell’uomo si trovano risultati diversi o solo
parzialmente coerenti con quelli ottenuti nell’animale
Frequentemente è possibile trovare metaboliti diversi o più
abbondanti
Un metabolita nelle urine o nelle feci di un paziente differente
da quelli rilevati nell’animale viene considerato attentamente
per la sua di potenziale tossicità
Biodiversità farmacometabolica tra uomo e ratto e suo impatto sulla
tossicità inaspettata di alcuni farmaci
da Annunziato L. e Di Renzo G. “Trattato di Farmacologia capitolo 2 , IdelsonGnocchi 2010












