L’Unità didattica in breve
D1
Evaporazione e condensazione
Meccanica, Macchine ed Energia – articolazione Energia 2 – Giuseppe Anzalone, Paolo Bassignana, Giuseppe Brafa Musicoro • Copyright © Ulrico Hoepli Editore S.p.A.
Tutti gli aeriformi possono essere liquefatti. In particolare, i vapori
sono aeriformi che si trovano in configurazioni termodinamiche non
lontane dal punto di liquefazione. Qualora i vapori risultino fortemente
surriscaldati e rarefatti, quindi lontani dalle configurazioni termodinamiche di passaggio di stato, possono essere considerati come gas ideali.
L’evaporazione è un passaggio di stato lento, che avviene attraverso una superficie di separazione fra la zona del liquido e quella del vapore; l’ebollizione avviene in tutta la massa liquida, in modo tumultuoso.
En­trambi i processi sono reversibili; la trasformazione inversa è detta
condensazione. Al di sotto di una temperatura limite, detta di satu­
razione, si ha l’evaporazione. Raggiunta la temperatura limite si innesca l’e­bollizione: la temperatura di ebollizione cambia al variare della
pres­sione cui è sottoposto il liquido: esistono formule che permettono di
calcolare la pressione, nota la temperatura di ebollizione. A pressione
atmosferica, l’acqua bolle a 100 °C.
La trasformazione del liquido in vapore
Partendo da un liquido freddo, quale può essere l’acqua a temperatura
ambiente, la sequenza delle trasformazioni è la seguente:
— riscaldamento del liquido freddo, fino al raggiungimento della temperatura di ebollizione;
— apporto di calore al liquido saturo, per avviare l’ebollizione; questo
processo av­viene a pressione e a temperatura costanti, finché tutta
la massa liquida non si è trasformata in vapore;
— ulteriore calore trasmesso al vapore secco per ottenere vapore surriscaldato.
Da notare che l’ebollizione non è istantanea ma procede gradualmen­te, con
il titolo del vapore che passa dal valore 0 al valore 1. Il titolo del vapore
è una grandezza adimensionata, che rappresenta il grado di umidità della
miscela liquido-vapore: il titolo 0 rappresenta il liquido saturo, il titolo 1,
cioè 100% di vapore, rappresenta il vapore saturo secco. Tutte le condizioni intermedie sono vapori saturi umidi. Il ca­lo­re di va­porizzazione
r è a quantità di calore che consente di ottenere la vaporizzazione completa
di 1 kg di liquido a una data pressione e temperatura. Il calore di vaporizzazione è anche detto calore latente. An­che la condensazione avviene con
una trasformazione isotermobarica, du­rante la quale si sottrae al vapore
il suo calore di vaporizzazione: gradualmente il titolo scende fino alla completa scomparsa dello stato aeri­for­me (titolo 0) e rimane solo il liquido.
Il vapore surriscaldato
Il vapore surriscaldato è un vapore privo di umidità che si trova a pressione e temperatura elevate, lontane dalle condizioni di passaggio di sta­to.
1
IL VAPORE ACQUEO
D1
È ottenuto fornendo calore a pressione costante al vapore saturo sec­co,
così da innalzare la temperatura. Il valore della capacità termica mas­sica
cp non può essere considerato costante, in quanto fortemente in­fluen­zato
dal­la pressione e dalla temperatura. Nella pratica si adotta un valore me­
dio di cp, relativo all’intervallo compreso fra le temperature di inizio trasformazione, quando il vapore è saturo secco, e di fine surriscaldamento.
Meccanica, Macchine ed Energia – articolazione Energia 2 – Giuseppe Anzalone, Paolo Bassignana, Giuseppe Brafa Musicoro • Copyright © Ulrico Hoepli Editore S.p.A.
Temperatura ed entalpia nelle trasformazioni da liquido
in vapore surriscaldato
L’entalpia, grandezza che esprime il contenuto energetico totale del
fluido, è fondamentale per eseguire calcoli relativi agli scambi energetici e ai lavori svolti da liquidi e vapori. All’entalpia dell’acqua a 0 °C si
attribuisce convenzionalmente il valore 0. Il calore sensibile qs è la
quantità di calore che dev’essere fornito all’acqua a 0 °C, per raggiungere la sua temperatura di ebollizione. L’entalpia del liquido saturo coincide con il calore sensibile qs. Nel caso del vapore saturo umido, avente
titolo x, l’entalpia è pari alla som­ma del calore sensibile e del prodotto
fra calore latente r e titolo x. Nel caso del va­pore saturo secco, l’entalpia comprende il calore sensibile e il ca­lore latente al 100%. Nel caso di
un vapore surriscaldato fino alla temperatu­ra finale tfin, l’entalpia comprende il calore di surriscaldamento, oltre ai ca­lori sensibile e latente.
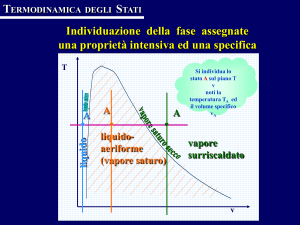
I diagrammi di stato del vapore
I vapori non seguono le leggi dei gas. Lo studio del loro comportamento
e delle trasformazioni si basa sulla consultazione di diagrammi, su cui
sono riportate le trasformazioni reali.
Il diagramma di Andrews riporta le curve limite superiore e in­
feriore sul piano (p,v), al cui interno c’è la zona del vapore saturo umido.
La curva di sinistra, avente x = 0, è circa parallela all’asse delle or­dinate,
fino a una pressione di circa 100 bar, dato che il volume massico dell’acqua cambia leggermente al variare della pressione e della temperatura.
La curva di destra, avente x = 1, diminuisce al crescere dei volumi massici, con an­damento grosso modo iperbolico nel suo tratto inferiore. La
differenza fra i volumi massici dell’acqua e quelli del rispettivo vapore
saturo secco ten­de a ridursi a 0 nel punto critico K, punto di convergenza delle due cur­ve limite e delle curve isotitolo. A esso corrispondono la
pressione criti­ca pK = 221,29 bar, la temperatura critica tK = 374,1 °C e
il volume mas­sico critico vK = 3,09 × 10–3 m3/kg. Le isotermobariche sono
segmenti orizzontali con gli estremi sulle curve limite inferiore e superiore. Al di fuori delle curve limite le isoterme sono iperboli, ma solo se
passanti a grande distanza dalla zona di passaggi di stato; avvicinandosi
alla cur­va limite superiore, le isoterme presentano un punto di flesso
obliquo. L’i­soterma critica ha il punto di flesso nel punto K e insieme alla
curva limite inferiore delimita, alla sua sinistra, la zona del liquido.
Esistono rappresentazioni grafiche in forma di mappa tridimensionale (p,v,T); sono superfici curve diversamente o­rien­tate che s’intersecano
fra loro; in essa si evidenziano le due curve limite e il punto critico K.
2
IL VAPORE ACQUEO
D1
Meccanica, Macchine ed Energia – articolazione Energia 2 – Giuseppe Anzalone, Paolo Bassignana, Giuseppe Brafa Musicoro • Copyright © Ulrico Hoepli Editore S.p.A.
Intersecando la mappa tridimensionale con i vari piani, si ottengono
famiglie di diagrammi di più immediata lettura, quale appunto il diagramma di Andrews in (p,v) e il piano in (T,p); su quest’ultimo si individua il punto triplo che definisce la condizione in cui possono coesistere
contemporaneamente le tre fasi.
Il diagramma di Gibbs riporta le curve limite superiore e inferiore
sul piano (T,S); hanno la forma di campana, con all’interno la zona del
vapore saturo umido. Ricordando che il prodotto (T∆S) è pari alla quantità di calore ∆Q, le aree sottese alle trasformazioni risultano uguali ai calori scambiati. Le vaporizzazioni isotermobariche sono segmenti orizzontali con gli estremi sulle curve limite: la loro lunghezza è pari al rapporto
fra il calore latente r e la temperatura assoluta T dell’isotermobarica;
esse sono intersecate dalle curve isotitolo, a loro volta convergenti nel
punto K. Lontano dalle curve limite, le isobare si presentano come curve
crescenti di tipo esponenziale. Avvicinandosi alla curva limite superiore,
le isobare appaiono sempre meno ripide e si appiattiscono man mano che
ci si avvicina al punto critico. L’isobara critica ha un punto di flesso con
tangente orizzontale nel punto critico.
Il diagramma di Mollier riporta le curve limite superiore e inferiore
sul piano (h,S); esso ha la forma irregolare che cresce fino a un massimo, per poi decrescere con andamento circa piatto per i valori ad alta
en­tropia; al di sotto delle linee limite, c’è la zona del vapore saturo umido.
Le due linee di saturazione si raccordano nel punto K, posto non al vertice del tratto convesso, ma spostato sul fianco sinistro. Al suo interno le
isotermo­bariche si presentano come un fascio di rette crescenti, a pendenza costante, e divergenti; sono intersecate dalle curve isotitolo, a loro volta convergenti nel punto K; in prossimità dell’origine le isotermobariche
sono tangenti alla curva del liquido saturo e si confondono con la medesima. Al di fuori della curva del vapore saturo secco, ogni isotermobarica si
sdoppia in due, l’isoterma e l’isobara, che si sviluppano separatamente nel
campo di esistenza del vapore surriscaldato. Ogni isobara taglia la curva
di saturazione senza discontinuità con l’isotermobarica, procedendo con
andamento crescente circa esponenziale. Le isoterme escono con un brusco cambiamento di curvatura e proseguono con andamento appiattito.
Il diagramma di Mollier consente di valutare tutti i parametri tipici
del vapore in ogni sua configurazione. Essi sono: pressione, temperatura, titolo, volume massico, entalpia ed entropia.
Il lavoro erogato dal vapore
L’entalpia h misura il contenuto energetico globale del sistema, nel caso
specifico del vapore, sia esso saturo o surriscaldato. La variazione di en­
tal­pia, a fronte di un’espansione, rappresenta il lavoro ideale Lid o ter­
mico-teorico Ltt: infatti le espansioni che avvengono nelle turbomacchine consentono di trasferire l’energia posseduta dal vapore, espres­sa
dall’entalpia, in energia meccanica di rotazione.
Le espansioni sono considerate adiabatiche ideali, cioè isentropiche:
nei diagrammi (T,S) e (h,S) so­no rappresentate mediante segmenti verticali, la cui quota vale (hiniz– hfin). La potenza ideale è pari al prodotto del
lavoro ideale per la portata massica di vapore in macchina.
3
IL VAPORE ACQUEO
D1
Meccanica, Macchine ed Energia – articolazione Energia 2 – Giuseppe Anzalone, Paolo Bassignana, Giuseppe Brafa Musicoro • Copyright © Ulrico Hoepli Editore S.p.A.
PROBLEMI DI RIEPILOGO
D1
1.Calcolare analiticamente la pressione cui corrisponde la temperatura di
ebollizione dell’acqua t = 220 °C, confrontando i risultati ottenuti per via
algebrica con i dati riportati nella tabella.
2.Calcolare analiticamente a quale temperatura bolle l’acqua pressurizzata
a p = 66 bar.
3.Una miscela di vapore acqueo saturo umido al 16% si trova in equilibrio,
a pressione p = 1,75 bar. Calcolare la temperatura di ebollizione e i valori
del volume massico, dell’entalpia e dell’entropia della miscela.
4.Calcolare il titolo x e il volume massico di una massa m = 350 kg di
vapore acqueo saturo umido, a pressione p = 7 bar, noto il volume del
serbatoio che vale V = 77,49 m3 . Calcolare inoltre il calore latente r e la
temperatura a cui si trova la miscela.
5.Calcolare l’energia termica necessaria per vaporizzare e poi surriscaldare, alla temperatura t2 = 480 °C, la massa di 100 kg d’acqua, che si
trova alla temperatura iniziale di t1 = 53 °C e alla pressione p1 = 35 bar,
specificando i valori dei calori di riscaldamento, di vaporizzazione e di
surriscaldamento.
6.Ricavare analiticamente la variazione di entropia ∆S, nel caso della condensazione completa di un vapore acqueo saturo secco che si trova a
pressione p = 110 bar, basandosi sui valori di entalpia hs = 2706 kJ/ kg e
hl = 1450 kJ/kg. Verificare, infine, il risultato ottenuto con i valori desunti dalle apposite tabelle.
7.Un vapore acqueo saturo umido ha titolo x = 0,88 e si trova alla pressione
p = 0,1 bar. Ricavare, dal diagramma di Mollier, i valori di temperatura,
entalpia, entropia; calcolare, infine, il calore di condensazione, necessario
per portare il vapore dalla condizione attuale a quella di liquido saturo.
8.Un vapore acqueo saturo umido, che ha titolo x1 = 0,84 e che si trova alla
pressione p1 = 60 bar, esegue una trasformazione a entalpia costante
fino al punto 2, in cui x2 = 0,97. Rilevare l’entropia S1 e i valori finali di
temperatura, pressione ed entropia.
9.Calcolare il valore medio della capacità termica massica cp, a pressione costante, per un vapore surriscaldato a tsurr = 650 °C e a pressione
p = 170 bar, partendo dalla condizione di vapore saturo secco.
10.Un vapore surriscaldato si trova a temperatura t1 = 400 °C e a pressione
p1 = 14 bar; esso espande fino a toccare la curva limite. Calcolare il lavoro
termico-teorico e i valori di pressione, temperatura e volume massico a
fine espansione.
4
IL VAPORE ACQUEO
D1