TERMODINAMICA
DEGLI
STATI
Individuazione della fase assegnate
una proprietà intensiva ed una specifica
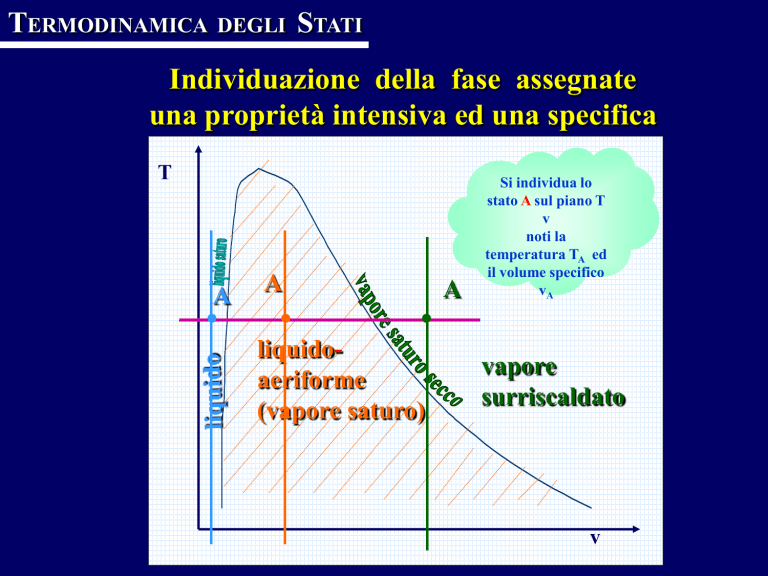
T
A
A
liquidoaeriforme
(vapore saturo)
A
Si individua lo
stato A sul piano T
v
noti la
temperatura TA ed
il volume specifico
vA
vapore
surriscaldato
v
TERMODINAMICA
DEGLI
STATI
Individuazione della fase assegnate
una proprietà intensiva ed una specifica
vA < vl(TA) liquido
sottoraffreddato
ildata
volume
specifico
vA > se
vs(T
) latemperatura
vapore
A
assegnato
v
è
minorei di
A leggono
TA si
surriscaldato
quello del
liquido
saturo vl
valori
del volume
sostanza
èliquido
se specifico
illavolume
specifico
del
liquido sottoraffreddato
assegnato
vsaturo
di
A è maggiore
vl
quello
del
vapore
saturo
e del
vapore
saurosecco
vl(T
A) < vA < vs(TA)
vs specifico
se il volume
secco
vs
vapore
saturo
la sostanza
è
assegnato
vA è compreso
tra
vapore
surriscaldato
quello
del liquido
vl e quello
del vapore saturo secco vs
la sostanza è
vapore saturo
T
A
A
A
TA
vl
vs
v
TERMODINAMICA
DEGLI
STATI
pA = 10 bar
p
vA = 0,05 m3/kg
p [bar] vl [m3/kg] vs [m3/kg]
0,1
0,0010
14,7
1
0,0010
1,69
5
0,0011
0,375
10
0,0011
0,194
50
0,0013
0,0394
100
0,0015
0,0180
200
0,0020
0,0058
pA
vl
vs
v
TERMODINAMICA
DEGLI
pA = 10 bar
STATI
p
vA = 0,05 m3/kg
A
pA
vl = 0,0011 m3/kg
vs = 0,194 m3/kg
vl
vl(pA) < vA < vs(pA)
vapore saturo
vv
v
TERMODINAMICA
DEGLI
STATI
Individuazione della fase assegnate
una proprietà intensiva ed una specifica
i (p , T)
s (v, u, h, s)
i
sA < sl(iA)
A
A
specifico
p pressione
liquido
sottoraffreddatov volume
iA
u energia interna specifica
T temperatura
h entalpia specifica
sA > ss(iA)
s entropia specifica
vapore surriscaldato
sA sl
sl(iA) < sA < ss(iA)
vapore saturo
sA
ss
A
sA
s
INDIVIDUAZIONE
SOSTANZA :
T
[°C ]
FASE
ESERCZIO
Acqua
p
[bar ]
150
DELLA
v
h
[m3/kg ] [kJ/kg ]
6,50
0,10
350
1,20
FASE
V
0,15
130
50
s
[kJ/kg K]
VS
2125
V
1600
LS
1,650
7,50
TERMODINAMICA
VS
V
DEGLI
STATI
TERMODINAMICA
DEGLI
STATI
calore specifico a volume costante
u
cv
T v
Il calore specifico a
volume costante è una
proprietà
termodinamica essendo
definito da una relazione
in cui compaiono solo
proprietà
termodinamiche
calore specifico a pressione costante
h
cp
T p
Il calore specifico a
pressione costante è una
proprietà
termodinamica essendo
definito da una relazione
in cui compaiono solo
proprietà
termodinamiche
TERMODINAMICA
DEGLI
STATI
Relazioni di Gibbs
1a)
du
dv
ds
p
T
T
2a)
dh
dp
ds
v
T
T
Queste due relazioni
legano proprietà
termodinamiche
direttamente misurabili
(p, T, v)
a proprietà
termodinamiche
non direttamente
misurabili
(u, h, s)












