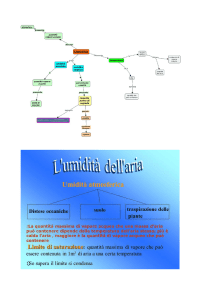
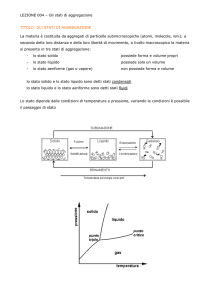
Tensione di vapore
Se una sostanza allo stato liquido si trova in un recipiente avente come base superiore un pistone
mobile, e alziamo il pistone, il volume aumenta di una quantità ΔV, si crea una depressione e alcune
molecole del liquido evaporano per contrastare la pressione esercitata sul pistone dall’esterno, superando la forza di coesione. Le molecole però non sono in grado di controbilanciare la pressione esercitata dall’esterno sul pistone, e una volta raggiunta la superficie interna di questo, ricadono all’interno
dell’acqua. All’inizio il numero di molecole che ricadono nel liquido è inferiore rispetto al numero che
evapora, però quando il primo numero aumenta diminuisce il numero delle molecole che evaporano.
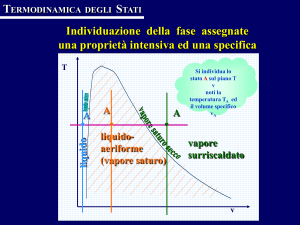
In questa situazione si dice che il vapore è saturo e la pressione da esso esercitata si chiama pressione o tensione del vapore saturo. La formazione del vapore è data dalla ricerca di un equilibrio
tra la pressione interna ed esterna e, aumentando o diminuendo il volume del recipiente, le molecole
evaporeranno o condenseranno fino ad avere un bilanciamento delle pressioni. Quando la pressione
del vapore tende a diminuire, il vapore non è più saturo; questo accade dopo che anche l’ultima goccia
del liquido evapora.
1
© 2015 Franco Lucisano Editore • L’Industria agroalimentare