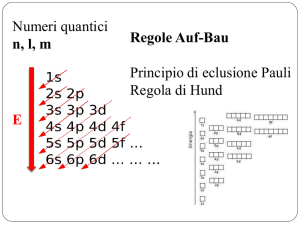
Legame Chimico I
Modelli molecolari di metanolo
Chimica generale ed Inorganica: Chimica Generale
LEGAME CHIMICO - TEORIA DI LEWIS
La configurazione elettronica dei gas nobili è responsabile della loro inerzia
chimica.
Gli atomi degli altri elementi si combinano tra loro per raggiungere le
configurazioni elettroniche dei gas nobili
Gli elettroni esterni (di valenza), giocano un ruolo fondamentale nel
legame chimico
In alcuni casi gli elettroni vengono trasferiti da un atomo ad un altro
(Legami ionici)
In altri casi due o più coppie di elettroni vengono condivise tra gli atomi
(Legami Covalenti)
Ottetto (doppietto per l’idrogeno)
Legame Chimico I
Chimica generale ed Inorganica: Chimica Generale
simboli e formule di Lewis
Elettroni di valenza
Legame Chimico I
Chimica generale ed Inorganica: Chimica Generale
simboli e formule di Lewis
Esempio
Struttura di Lewis del cianogeno C2N2
Il numero totale degli elettroni di valenza è 4+4+5+5=18
Identificare gli atomi centrali, (criterio minore elettronegatività)
Elettronegatività del carbonio < elettronegatività dell’azoto
N-C-C-N
Sottrarre due elettroni per ogni legame della struttura di scheletro
18 – 6 = 12 elettroni
Completare gli ottetti degli atomi terminali (N)
••
••
••
••
N-C-C-N
••
••
Utilizziamo Coppie di elettroni solitarie per completare
L’ottetto dei C
••
NC-CN
••
••
••
••
••
N-C-C-N
••
••
Esempi Classici
H2, Cl2, O2, N2, H2O, NH3, NH4+, CS2, PCl3, HCN, COCl2, C2H2,
CH3COOH, NO2+
Risonanza
O3, H2CO3, CO32-, C6H6
Carica Formale
NOCl, SO2, SO3
Ottetto Espanso e Ridotto
BF3, PCl5, SF4, SF6
Legame Chimico I
Chimica generale ed Inorganica: Chimica Generale
espansione
FIGURA 11-8 Schema sommario per la scrittura di strutture di Lewis
dell’ottetto
Legame Chimico I
Chimica generale ed Inorganica: Chimica Generale
insufficienze del modello di Lewis
O2, NO, BH3
reattività dei gas nobili
Legame Chimico I
Chimica generale ed Inorganica: Chimica Generale
insufficienze del modello di Lewis
FIGURA 11-9 Forma geometrica di una molecola
modello VSEPR
acronimo dall'inglese (Valence
Shell Electron Pair Repulsion),
cioè repulsione delle coppie
elettroniche nel guscio di valenza
Legame Chimico I
Chimica generale ed Inorganica: Chimica Generale
modello
VSEPR
FIGURA
11-11 Forme molecolari basate sul gruppo elettronico di geometria tetraedrica: CH , NH , ed H O
4
3
2
Legame Chimico I
modello VSEPR
Chimica generale ed Inorganica: Chimica Generale
Legame Chimico I
modello VSEPR
Chimica generale ed Inorganica: Chimica Generale
Legame Chimico I
modello VSEPR
Chimica generale ed Inorganica: Chimica Generale
Legame Chimico I
modello VSEPR
formule alternative
[ICl4]-
Chimica generale ed Inorganica: Chimica Generale
Legame Chimico I
modello VSEPR
Chimica generale ed Inorganica: Chimica Generale
Legame Chimico I
modello VSEPR
Chimica generale ed Inorganica: Chimica Generale
Legame Chimico I
modello VSEPR
Chimica generale ed Inorganica: Chimica Generale
Legame Chimico I
Chimica generale ed Inorganica: Chimica Generale
Legame Chimico I
Chimica generale ed Inorganica: Chimica Generale
Elettronegatività descrive la capacità di
FIGURA 11-4 Legami non polari e covalenti
polari
un atomo
a competere per gli elettroni
di legame dell’atomo a cui è legato
sbilanciamento della carica elettronica
Legame covalente polare
Legame Chimico I
Chimica generale ed Inorganica: Chimica Generale
(δ+)⎯⎯(δ-)
dipoli
r
molecolari
Μ = rδ
Legame Chimico I
molecole polari
FIGURA 11-14 Molecole polari in un campo elettrico
Chimica generale ed Inorganica: Chimica Generale
Liquidi e Solidi
Chimica generale ed Inorganica: Chimica Generale
Butano e acetone
interazioni dipolari
Liquidi e Solidi
Chimica generale ed Inorganica: Chimica Generale
Forze intermolecolari
Forze di van der Waals
Interazione dipolo-dipolo
Interazione ione-dipolo
Interazione dipolo-dipolo indotto
Forze di London (di dispersione)
polarizzabilità
Liquidi e Solidi
legame a idrogeno
Chimica generale ed Inorganica: Chimica Generale
Liquidi e Solidi
Chimica generale ed Inorganica: Chimica Generale
legame a idrogeno: H2O
Liquidi e Solidi
Chimica generale ed Inorganica: Chimica Generale
legame a idrogeno: intrae inter-molecolare
H - N, O, F