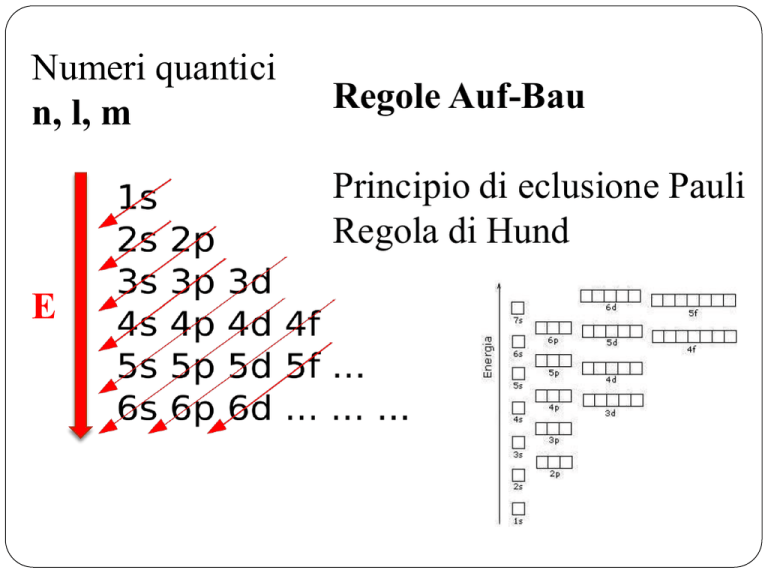
Numeri quantici
n, l, m
Regole Auf-Bau
Principio di eclusione Pauli
Regola di Hund
E
Periodicità Chimica
Chimica generale ed Inorganica: Chimica Generale
Volume atomico (Meyer)
FIGURA 10-1 Una illustrazione della legge periodica - la variazione del volume atomico con il numero atomico
Quando gli elementi sono
disposti in ordine crescente di
massa atomica, alcune proprietà
ricorrono con periodicità
Oltre il volume altre proprietà
ricorrono periodicamente, durezza
comprimibilità punti di ebollizione
Periodicità Chimica
Chimica generale ed Inorganica: Chimica Generale
La tavola periodica è costituita da 18 gruppi
Periodicità Chimica
periodicità
nei raggi
atomici
FIGURA 10-4 Raggi atomici
In un atomo maggiore è il
numero di livelli elettronici e
maggiore è la sua dimensione.
Nel gruppo il raggio atomico
aumenta dall’alto al basso
pm=10-12m
Chimica generale ed Inorganica: Chimica Generale
Periodicità Chimica
Chimica generale ed Inorganica: Chimica Generale
metalli non metalli e metalloidi
Raggi atomici, covalenti e ionici
Periodicità Chimica
Chimica generale ed Inorganica: Chimica Generale
andamenti periodici dei raggi
FIGURA 10-8 Un confronto tra alcuni raggi atomici e ionici
Periodicità Chimica
Chimica generale ed Inorganica: Chimica Generale
Energia di ionizzazione
Periodicità Chimica
Chimica generale ed Inorganica: Chimica Generale
Energie di ionizzazione nel primo periodo
Periodicità Chimica
Chimica generale ed Inorganica: Chimica Generale
Affinità elettronica
FIGURA 10-9 Energie di prima ionizazione in funzione del numero atomico
EA è una misura della variazione di energia che si verfica quando un atomo gassoso acquista elettroni:
F(g) + e- F-(g) EA= -328kJ/mol si ha emissione di energia e il processo si dice esotermico
Trasformandosi in F- l’atomo di fluoro passa da 1s22s22p5 + e- a 1s22s22p6 ossia la
configurazione elettronica del Neon.
ELETTRONEGATIVITÀ (EN)
L’elettronegatività descrive la capacità di un atomo di competere per gli elettroni di legame
Con gli altri atomi al quale è legato .
La differenza di elettronegatività tra due atomi permette di quantizzare il carattere polare di
un legame covalente tra i due atomi.
Periodicità Chimica
Chimica generale ed Inorganica: Chimica Generale
andamenti periodici
FIGURA 10-11 Proprietà atomiche e tabella periodica – Un riassunto
LEGAME CHIMICO - TEORIA DI LEWIS
La configurazione elettronica dei gas nobili è responsabile della loro inerzia
chimica.
Gli atomi degli altri elementi si combinano tra loro per raggiungere le
configurazioni elettroniche dei gas nobili
Gli elettroni esterni (di valenza), giocano un ruolo fondamentale nel
legame chimico
In alcuni casi gli elettroni vengono trasferiti da un atomo ad un altro
(Legami ionici)
In altri casi due o più coppie di elettroni vengono condivise tra gli atomi
(Legami Covalenti)
Ottetto (doppietto per l’idrogeno)
Elettroni di valenza
Li
BBe
Carbonio
HHe
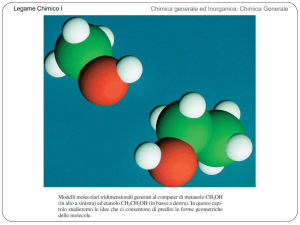
Legame Chimico I
Chimica generale ed Inorganica: Chimica Generale
elettroni di core e di valenza
legame ionico
Na+ Cllegame covalente
Cl—Cl
legame covalente polare
Li—Cl
ottetto
Legame Chimico I
Chimica generale ed Inorganica: Chimica Generale
Elettronegatività descrive la capacità di
FIGURA 11-4 Legami non polari e covalenti
polari
un atomo
a competere per gli elettroni
di legame dell’atomo a cui è legato
sbilanciamento della carica elettronica
Legame covalente polare
Legame Chimico I
Chimica generale ed Inorganica: Chimica Generale
legame covalente polare
legame covalente coordinativo - acidi e basi di Lewis
Legame Chimico I
molecole polari
FIGURA 11-14 Molecole polari in un campo elettrico
Chimica generale ed Inorganica: Chimica Generale
Legame Chimico I
Chimica generale ed Inorganica: Chimica Generale
(δ+)⎯⎯(δ-)
dipoli
r
molecolari
Μ = rδ
Legame Chimico I
lunghezze di legame
Chimica generale ed Inorganica: Chimica Generale
Legame Chimico I
Chimica generale ed Inorganica: Chimica Generale
energie di legame
Legame Chimico I
Chimica generale ed Inorganica: Chimica Generale
simboli e formule di Lewis
Elettroni di valenza
Legame Chimico I
Chimica generale ed Inorganica: Chimica Generale
simboli e formule di Lewis
Esempio
Struttura di Lewis del cianogeno C2N2
Il numero totale degli elettroni di valenza è 4+4+5+5=18
Identificare gli atomi centrali, (criterio minore elettronegatività)
Elettronegatività del carbonio < elettronegatività dell’azoto
N-C-C-N
Sottrarre due elettroni per ogni legame della struttura di scheletro
18 – 6 = 12 elettroni
Completare gli ottetti degli atomi terminali (N)
••
••
••
••
N-C-C-N
••
••
Utilizziamo Coppie di elettroni solitarie per completare
L’ottetto dei C
••
NC-CN
••
••
••
••
••
N-C-C-N
••
••
Esempi Classici
H2, Cl2, O2, N2, H2O, NH3, NH4+, CS2, PCl3, HCN, C2H2,
CH3COOH
Risonanza
O3, H2CO3, CO32-, C6H6
Carica Formale
NO2+, COCl2, NOCl
Ottetto Espanso e Ridotto
BF3, PCl5, SF4, SF6
Carica Formale
•
•
•
•
La somma delle cariche formali è zero per una molecola neutra,
o pari alla carica per uno ione
Le cariche formali devono essere le più piccole possibili in valore
assoluto
Atomi elettronegativi cariche formali negative
Cariche dello stesso segno su atomi adiacenti sono improbabili
Legame Chimico I
Chimica generale ed Inorganica: Chimica Generale
espansione
FIGURA 11-8 Schema sommario per la scrittura di strutture di Lewis
dell ottetto
Legame Chimico I
Chimica generale ed Inorganica: Chimica Generale
insufficienze del modello di Lewis
O2, NO, BH3
reattività dei gas nobili