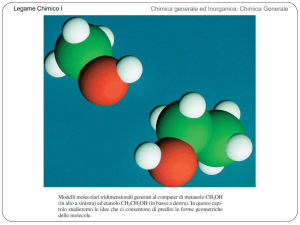
Legame Chimico
I
Chimica Generale ed Inorganica
Chimica Generale
prof. Dario Duca
Legame Chimico I"
Chimica generale ed Inorganica: Chimica Generale"
elettroni di core e di valenza"
"
"
"
"
legame ionico"
"
"
Na+ Cl-"
"
legame covalente"
"
"
Cl—Cl"
"
legame covalente polare"
Li—Cl"
ottetto"
Legame Chimico I"
Chimica generale ed Inorganica: Chimica Generale"
simboli e formule di Lewis"
Legame Chimico I"
Chimica generale ed Inorganica: Chimica Generale"
simboli e formule di Lewis"
Legame Chimico I"
Chimica generale ed Inorganica: Chimica Generale"
sbilanciamento della carica elettronica"
FIGURA 11-4 Legami non polari e covalenti polari
elettronegatività di Mulliken"
"A =
!
I.E.A + E.A.A
2
Legame Chimico I"
Chimica generale ed Inorganica: Chimica Generale"
! A ! ! B = 0,102 "
elettronegatività di Pauling"
" = "E ( A ! B) !
"E ( A ! A) + "E (B ! B)
2
Legame Chimico I"
Chimica generale ed Inorganica: Chimica Generale"
FIGURA 11-7 Percento di carattere ionico di un legame chimico in funzione della differenza di elettronegatività
teoria V.B."
"
risonanza ionico-covalente"
Na+ Cl- Na- Cl+ Na—Cl"
Legame Chimico I"
Chimica generale ed Inorganica: Chimica Generale"
legame covalente polare"
legame covalente coordinativo - acidi e basi di Lewis!
Legame Chimico I"
elemento!
Chimica generale ed Inorganica: Chimica Generale"
Z!
uma!
molecola!
p.f. /K!
p.e. /K!
17"
35,45"
Cl2"
172"
239"
Br!
35"
79,90"
Br2"
266"
332"
J!
53"
126,90"
J2"
387"
458"
FIGURA
Cl! 10-12 I tre elementi alogeni
andamenti periodici e non ..."
molecola!
p.f /°C!
molecola!
p.f. /°C!
CF4"
-183,7"
HF"
-83,6!
CCl4"
-22,9"
HCl"
-114,2"
CBr4"
90,1"
HBr"
-86,8"
CJ4"
171"
HJ"
-50,8"
Legame Chimico I"
risonanza e carica formale"
Chimica generale ed Inorganica: Chimica Generale"
Legame Chimico I"
risonanza C6H6"
Chimica generale ed Inorganica: Chimica Generale"
Legame Chimico I"
Chimica generale ed Inorganica: Chimica Generale"
espansione
FIGURA 11-8 Schema sommario per la scrittura di strutture di Lewis
dell ottetto"
SO2"
4
!
PO3"
4
ClO"4
Legame Chimico I"
espansione dell ottetto"
Chimica generale ed Inorganica: Chimica Generale"
FIGURA 11-8 Schema sommario per la scrittura di strutture di Lewis
Legame Chimico I"
Chimica generale ed Inorganica: Chimica Generale"
insufficienze del modello di Lewis"
"
O2, NO"
reattività dei gas nobili"
Legame Chimico I"
Chimica generale ed Inorganica: Chimica Generale"
insufficienze del modello di Lewis"
FIGURA 11-9 Forma geometrica di una molecola
modello VSEPR"
Legame Chimico I"
Chimica generale ed Inorganica: Chimica Generale"
modello
VSEPR"
FIGURA
11-11 Forme molecolari basate sul gruppo elettronico di geometria tetraedrica: CH , NH , ed H O
4
3
2
Legame Chimico I"
modello VSEPR"
Chimica generale ed Inorganica: Chimica Generale"
Legame Chimico I"
Chimica generale ed Inorganica: Chimica Generale"
modello VSEPR"
FIGURA 11-12
geometrie
di gruppo elettronico illustrate
lone-pair
e Diverse
doppi
legami"
Legame Chimico I"
modello VSEPR"
Chimica generale ed Inorganica: Chimica Generale"
Legame Chimico I"
modello VSEPR"
Chimica generale ed Inorganica: Chimica Generale"
Legame Chimico I"
modello VSEPR"
formule alternative"
"
"
[ICl4]-"
Chimica generale ed Inorganica: Chimica Generale"
Legame Chimico I"
modello VSEPR"
Chimica generale ed Inorganica: Chimica Generale"
Legame Chimico I"
modello VSEPR"
Chimica generale ed Inorganica: Chimica Generale"
Legame Chimico I"
modello VSEPR"
Chimica generale ed Inorganica: Chimica Generale"
Legame Chimico I"
Chimica generale ed Inorganica: Chimica Generale"
Legame Chimico I"
Chimica generale ed Inorganica: Chimica Generale"
(δ+)⎯⎯(δ-)"
dipoli"
r"
molecolari " "
Μ = rδ"
Legame Chimico I"
molecole polari"
FIGURA 11-14 Molecole polari in un campo elettrico
Chimica generale ed Inorganica: Chimica Generale"
Legame Chimico I"
lunghezze di legame"
Chimica generale ed Inorganica: Chimica Generale"
Legame Chimico I"
Chimica generale ed Inorganica: Chimica Generale"
energie di legame"
Legame Chimico I"
energie di legame"
Chimica generale ed Inorganica: Chimica Generale"
Legame Chimico I"
Chimica generale ed Inorganica: Chimica Generale"
Chimica Generale ed Inorganica
Chimica Generale
prof. Dario Duca