SEZIONE SCIENTIFICA - Patologia in pillole
PATOLOGIA IN PILLOLE
Nr. 75
S. Leoni
Storia clinica
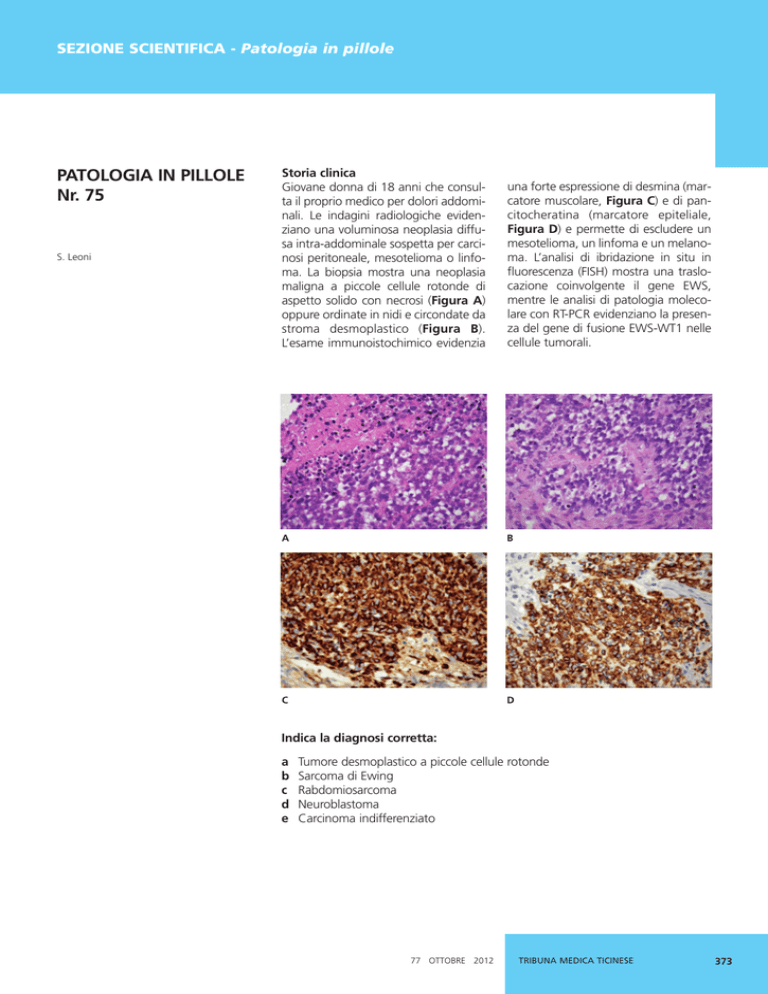
Giovane donna di 18 anni che consulta il proprio medico per dolori addominali. Le indagini radiologiche evidenziano una voluminosa neoplasia diffusa intra-addominale sospetta per carcinosi peritoneale, mesotelioma o linfoma. La biopsia mostra una neoplasia
maligna a piccole cellule rotonde di
aspetto solido con necrosi (Figura A)
oppure ordinate in nidi e circondate da
stroma desmoplastico (Figura B).
L’esame immunoistochimico evidenzia
una forte espressione di desmina (marcatore muscolare, Figura C) e di pancitocheratina (marcatore epiteliale,
Figura D) e permette di escludere un
mesotelioma, un linfoma e un melanoma. L’analisi di ibridazione in situ in
fluorescenza (FISH) mostra una traslocazione coinvolgente il gene EWS,
mentre le analisi di patologia molecolare con RT-PCR evidenziano la presenza del gene di fusione EWS-WT1 nelle
cellule tumorali.
A
B
C
D
Indica la diagnosi corretta:
a
b
c
d
e
Tumore desmoplastico a piccole cellule rotonde
Sarcoma di Ewing
Rabdomiosarcoma
Neuroblastoma
Carcinoma indifferenziato
77 OTTOBRE 2012
TRIBUNA MEDICA TICINESE
373
SEZIONE SCIENTIFICA - Patologia in pillole
Diagnosi
Tumore desmoplastico a piccole
cellule rotonde intra-addominale.
Commento
Il tumore desmoplastico a piccole cellule rotonde (TDPCR) è una neoplasia
rara (meno di 200 casi descritti), altamente aggressiva dell’adolescente e
del giovane adulto, prevalentemente
di sesso maschile, a partenza peritoneale (e possibilmente di origine mesoteliale). Esso appartiene alla famiglia
dei sarcomi infantili a piccole cellule
rotonde, unitamente al PNET/sarcoma
di Ewing, al rabdomiosarcoma e al sarcoma sinoviale ( vedi Tabella 1 per diagnosi differenziale dettagliata). La diagnosi corretta è essenziale in quanto,
malgrado l’aspetto morfologico simile,
le neoplasie maligne elencate in tabella 1 necessitano spesso di trattamenti
differenziati e sono caratterizzate da
prognosi diversa.
Il tumore si manifesta sottoforma di
multipli noduli del peritoneo viscerale
e parietale che confluiscono in voluminose masse (di diametro fino a 20
cm) con frequente coinvolgimento
dell’omento. Clinicamente si osservano distensione addominale ed even-
•
•
•
•
•
•
•
•
•
•
•
•
tualmente ascite; possono inoltre
venir rilevati alti livelli sierici di Ca125.
Il “gold standard” diagnostico è rappresentato dalla biopsia laparoscopica
o percutanea ecoguidata, che oltre la
valutazione di aspetti morfologici ed
immunofenotipici, permette di condurre esami di citogenetica interfasica
(FISH) e di patologia molecolare. Il
reperto istopatologico è quello di un
tumore a piccole cellule “blu”, ossia
cellule di piccole dimensioni con scarso citoplasma e quindi presenza di un
nucleo che occupa quasi tutto il volume cellulare. Il profilo immunoistochimico mostra differenziazione divergente, con markers sia di tipo epiteliale (cheratine) che di tipo neurale
(enolasi neuronspecifica) e muscolare
(desmina). È frequente inoltre l’espressione dell’antigene WT1 (Wilms
tumor), espresso tra l’altro nel mesotelioma. La diagnosi istopatologica va
tuttavia confermata mediante FISH
e/o citogenetica convenzionale alla
ricerca della tipica e diagnostica traslocazione t(11;22) (p13;q12) che
determina fusione del gene EWS
(Ewing sarcoma) con il gene WT1. In
questo contesto è bene ricordare che
un esame FISH determina la presenza
di traslocazione del gene EWS ma
Rabdomiosarcoma alveolare
Tumore desmoplastico a piccole cellule rotonde
Rabdomiosarcoma embrionale
Sarcoma di Ewing extraschelettrico/tuomore neuro-ectodermico
periferico (PNET)
Liposarcoma a cellule rotonde
Condrosarcoma mixoide extrascheletrico cellulato
Condrosarcoma mesenchimale
Osteosarcoma a piccole cellule
Emagiopericitoma maligno
Sarcoma sinoviale
Tumore glomico
Tumore tenosinoviale a cellule giganti
Tab. 1: Diagnosi differenziale di tumori a cellule rotonde delle parti molli
374
TRIBUNA MEDICA TICINESE
77 OTTOBRE 2012
non permette di definire il secondo
gene coinvolto. Quest’ultima informazione è tuttavia importante in
quanto esistono numerose neoplasie
coinvolgenti EWS che possono
“fusionare” con differenti partner
geneici (Tabella 2). Per questo motivo è importante, in assenza di esami
di citogenetica convenzionale su
materiale fresco, procedere ad esami
di patologia molecolare condotti su
mRNA estratto da tessuto fissato e
incluso in paraffina (RT-PCR).
La terapia è multimodale. Trattandosi
di una neoplasia poco chemiosensibile, l’elemento cardine della terapia è
la chirurgia radicale citoriduttiva (con
rimozione perlomeno del 90% della
neoplasia), preceduta da chemioterapia neoadiuvante alfine di ridurre il
carico tumorale. Poiché nella maggioranza dei casi il tumore è disseminato
e costituito da centinaia di noduli
peritoneali, un’exeresi radicale è purtroppo virtualmente impossibile, per
cui è stata introdotta di recente la
chemioterapia intraperitoneale ipertermica per-operatoria con Cisplatino
(attualmente in fase di studio clinico).
La chemioterapia adiuvante post-operatoria è simile a quella somministrata
per il sarcoma di Ewing e si basa su
agenti alchilanti (Ciclofosfamide,
Vincristina, Ifosfamide, Doxorubicina,
Etoposide). La radioterapia addomino-pelvica in caso di malattia residua
è un opzione terapeutica, ma secondo i dati riportati finora, essa è gravata da una notevole tossicità gastrointestinale e ematologica, senza un
beneficio provato.
Il TDPCR rimane a lungo asintomatico
ritardando la diagnosi, per cui la maggioranza dei pazienti presenta metastasi al momento della diagnosi (principalmente epatiche, polmonari e linfonodali). La prognosi è infausta con
una sopravvivenza globale a 5 anni
inferiore al 20%.
Tuttavia la chemioterapia intraperito-
SEZIONE SCIENTIFICA - Patologia in pillole
Neoplasia
Traslocazione
“Fusion gen”
Istiocitoma fibroso
angiomatoide
t(12;22)(q13;q12)
t(2;22)(q33;q12)
EWS-ATF1
EWS-CREB1
Sarcoma a cellule
chiare
t(12;22)(q13;q12)
t(2;22)(q33;q12)
EWS-ATF1
EWS-CREB1
Tumore desmoplastico
a piccole cellule rotonde
t(11;22)(p13;q12)
EWS-WT1
Sarcoma
di Ewing/PNET
t(11;22)(q24;q12)
t(21;22)(q22;q12)
t(7;22)(q22;q12)
t(17;22)(q21;q12)
t(2;22)(q36;q12)
altre…
EWS-FLI1
EWS-ERG
EWS-ETV1
EWS-EIAF
EWS-FEV
altre…
Conmdrosarcoma mixoide
extraschelettrico
t(9;22)(q22;q12)
EWS-NR4A3
Lipoasarcoma a cellule
rotonde
t(12;22)(q13;q12)
EWS-CHOP
Bibliografia
The diagnosis and management of desmoplastic
small round cell tumor: a review. A. HayesJordan. Curr Opin Oncol 2011; 23: 385-389.
Management of desmoplastic small round cell
tumors in children and young adults. A. HayesJordan. J Pediatr Hematol Oncol 2012; 34: S73S75.
Desmoplastic small round cell tumor: current
management and recent findings. A. Dufresne.
Sarcoma 2012; Article ID 714986.
Desmoplastic small round cell tumors with EWSWT1 fusion transcript in children and young
adults. P. Philippe-Chomette. Pediatr Blood
Cancer 2012; 58: 891-897.
Tab. 2: Neoplasie con traslocazione coinvolgente il gene EWS sul cromosoma 22
neale ipertermica per-operatoria sembra dare risultati incoraggianti: risultati preliminari pubblicati da HayesJordan nel 2010 mostrano una
sopravvivenza mediana a 3 anni del
71% contro 62% in caso di solo trattamento chirurgico e contro 26% per
pazienti sottoposti unicamente a chemioterapia.
stiche e terapeutiche, la conferma
della diagnosi istopatologia con tecniche ancillari ed in particolare di patologia molecolare è da ritenersi obbligatoria. Considerata l’inefficacia delle
terapie attualmente disponibili, sono
in fase di studio vari farmaci mirati per
i recettori Her-2/neu, PDGFR, c-kit.
In conclusione, il tumore desmoplastico a piccole cellule rotonde è una
neoplasia altamente aggressiva, poco
sensibile alla terapia e per la quale l’unico trattamento efficace rimane la
chirurgia radicale in stadio iniziale.
Una diagnosi precoce permette di
migliorare la prognosi. Questa neoplasia va sospettata in caso di ascite e
distensione addominale presso un
giovane uomo, nel qual caso è indicato un dosaggio del Ca 125. Alla luce
delle importanti implicazioni progno-
S. Leoni
Istituto cantonale di patologia, Locano
77 OTTOBRE 2012
TRIBUNA MEDICA TICINESE
375












