Appunti di Stechiometria per Chimica
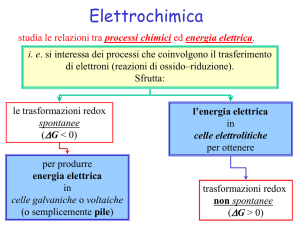
Elettrochimica
Celle Elettrochimiche
Le reazioni d’ossidoriduzione possono essere sfruttate per formare
delle celle galvaniche o pile che trasformano l’energia chimica
della reazione spontanea in energia elettrica.
Una pila è costruita mediante la separazione fisica della reazione
chimica nelle corrispondenti due semi-reazioni di ossidazione e di
riduzione (semipile) in modo tale che la reazione può avvenire
complessivamente solo attraverso il passaggio degli elettroni
attraverso un circuito elettrico. Le due semipile sono inoltre
collegate tra loro da un ponte salino che garantisce la chiusura del
circuito.
Cu
Ag+ + e-
Cu2+ + 2eAg
Per convenzione la semipila dove avviene l’ossidazione è
chiamata anodo mentre la semipila dove avviene la riduzione è
chiamata catodo.
La pila può essere schematizzata nel seguente modo:
Elet/(Red1),Ox1//Ox2, (Red2)/Elet
A sinistra è posta la semireazione relativa all’anodo e a destra la
semireazione relativa al catodo separate da una doppia barra che
rappresenta il ponte salino.
La specie Red tra parentesi si omette nel caso in cui gli elettrodi
conduttori siano formati direttamente dalla specie riducente della
coppia redox, mentre è esplicitato l’elettrodo inerte (normalmente
Pt) nel caso in cui nella coppia redox non sia presente un
conduttore.
Cu/Cu2+//Ag+/Ag
Pt/Cl-,Cl2//MnO4-,H+,Mn2+/Pt
Pt/N2O4,OH-,NO3-//CrO42-,OH-,Cr3+/Pt
Potenziale Elettrochimico
Gli elettroni che sono generati all’anodo sono spinti verso il
catodo da una forza che è chiamata forza elettromotrice o fem.
Questa forza è causata alla differenza d’energia potenziale
elettrica degli elettroni ai due elettrodi.
La differenza di potenziale prodotta da una cella elettrochimica si
chiama voltaggio di cella e si misura in Volt (joule/coulomb) con
un voltmetro.
Poiché il potenziale di una semicella dipende dalla temperatura e
anche dalle concentrazioni dei reagenti e dei prodotti sono state
definite delle condizioni standard con cui misurare i potenziali
elettrochimici delle semireazioni.
Le condizioni standard sono: 25°C con concentrazioni in
soluzione acquosa 1 M e se gas 1 atm.
I potenziali standard di riduzione (E°) sono potenziali relativi
all’elettrodo d’idrogeno a cui viene assegnato il potenziale di
riferimento 0 V.
2H+ + 2e-
H2
E° = 0 V
Le varie semipile possono essere misurate in riferimento a questo
elettrodo
Si costruisce così una scala dei potenziali standard di riduzione
che misurano la tendenza dei reagenti in condizioni standard a
ridursi nei prodotti in condizioni standard.
Più alto è il valore di E° maggiore è la tendenza della specie a
ridursi e quindi la scala dei potenziali standard di riduzione è
proporzionale al potere ossidante delle coppie elettrochimiche.
Così la coppia Cu/Cu2+ che ha un E°=0.340 V ha una maggiore
capacità di ridursi (e quindi ad ossidare) rispetto alla coppia
Zn/Zn2+ che ha un E°=-0.763 V.
Il rame è un metallo nobile (E°>0 V) mentre lo zinco è un metallo
non nobile (E°<0 V).
Quindi se formiamo una pila in condizioni standard con queste
due coppie possiamo aspettarci che la coppia Zn/Zn2+ si comporti
da anodo mentre la coppia Cu/Cu2+ si comporti da catodo .
Lo schema della pila sarà
Zn/Zn2+//Cu2+/Cu
e la differenza di potenziale ΔE°=E°Cu2+/Cu - E°Zn2+/Zn =1.103 V
I potenziali standard di riduzione misurano la tendenza dei
composti ad acquistare elettroni. Ad esempio l’andamento dei
potenziali standard di riduzione degli alogeni Cl-/Cl21.36V > Br-
/Br2
1.07
V
>
I-/I2
0.54
V
riflette
l’andamento
dell’elettronegatività di questi elementi Cl 3.16 > Br 2.96 > I 2.66.
Il confronto dei valori dei potenziali standard di riduzione può
permettere di prevedere le reazioni chimiche. Ad esempio dai
valori sopra riportati si può prevedere che in condizioni standard
(o in condizioni prossime alle condizioni standard) il cloro
molecolare può ossidare gli ioni bromuro Br- e ioduro Irispettivamente a bromo e iodio molecolare (FILMATO).
Cl2 + 2BrCl2 + 2I-
2Cl- + Br2
2Cl- + I2
Queste reazioni sono sfruttate nell’analisi qualitativa per
determinare la presenza di ioni bromuro o ioduro nei campioni.
Equazione di Nerst e condizioni non standard
Per ottenere il potenziale di una semicella in condizioni non
standard si utilizza l’equazione di Nerst: E=E°-(RT/F) ln(Q1/n)
Dove E° è il potenziale standard, R la costante universale dei gas,
T la temperatura in K, F il faraday che equivale a 96500 Coulomb
(la carica di una mole di elettroni), ln(Q1/n) è il logaritmo naturale
del Q quoziente di reazione, che è la costante d’equilibrio della
semireazione di riduzione bilanciata, normalizzato per il numero
d’elettroni che compaiono nella semireazione.
Raggruppando i termini costanti, prendendo come riferimento la
temperatura standard di 25 °C e passando dal logaritmo in base
naturale al logaritmo in base 10, l’equazione si trasforma
nell’espressione semplificata: E=E°-(0.0592/n) log(Q)
Esempio:
Pt/Fe2+(0.10M),Fe3+(0,20M)//Ag+(1.0M)/Ag
Fe3+ e-
Fe2+
E°Fe3+/Fe2+=0.771 V
Ag+ e-
Ag
E°Ag+/Ag =0.800 V
E=E°-0.0592/n log(Q)
EFe3+/Fe2+=E°Fe3+/Fe2+-0.0592/1 log([Fe2+]/[Fe3+])
EFe3+/Fe2+=0.771-0,059log(0.10/0.20)=+0.789 V
EAg+/Ag=E°Ag+/Ag-0.0592/1 log(1/[Ag+])
EAg+/Ag=0.800-0,059log(1/1)=+0.800 V
Il potenziale della pila è dato dalla differenza dei potenziali di
riduzione.
Il potenziale più positivo è corrispondente alla reazione di
riduzione (catodo) e quello più negativo all’ossidazione (anodo).
ΔE=0.800-0.789=0.011 V
Pile a concentrazione.
Il potenziale di riduzione è funzione delle concentrazioni di tutte
le specie presenti in soluzione che compaiono nella semireazione
di riduzione.
E’ possibile costruire una pila costituita da una unica semireazione
nella quale nei due comparti le specie sono presenti a diverse
concentrazioni (Pila a concentrazione).
La fem di questo tipo di pile non dipende dal potenziale standard
di riduzione ma solo dai rapporti delle concentrazioni.
La misura della fem di questo tipo di pile può essere sfruttata per
determinare le costanti di solubilità dei sali.
Esempio:
Ag+ e-
Ag
EAg+/Ag=E°Ag+/Ag-0.0592log(1/[Ag+])
Ag+ + I-
AgI
Kps=[Ag+][I-]
ΔE=0.417 V = 0.0592log(0.100/√Kps)
Kps=(0.100x10-0.417/0.0592)2=8.17x10-17
Potenziali di riduzione e costanti di equilibrio
Alla chiusura del circuito elettrico, la pila eroga della corrente
elettrica ed inizia a scaricarsi.
Al catodo avviene la reazione di riduzione con conseguente
diminuzione delle concentrazioni dei reagenti ed aumento dei
prodotti della semireazione di riduzione. Conseguentemente, il
valore
del
potenziale
di
riduzione
inizia
a
diminuire.
Contemporaneamente,
all’anodo
avviene
la
reazione
di
ossidazione con conseguente aumento delle concentrazioni delle
specie che compaiono tra i prodotti della semireazione di
ossidazione
(reagenti
quando
scritta
come
riduzione)
e
diminuzione dei reagenti (prodotti della riduzione). Il valore del
potenziale di riduzione dell’anodo inizia ad aumentare. Quando la
pila si scarica completamente ΔE=0, questo significa, in altri
termini, l’equivalenza dei potenziali di riduzione delle due
semipile. Siamo in presenza dell’equilibrio chimico per la
reazione di ossidoriduzione. E’ quindi possibile ottenere la
costante di equilibrio di una data reazione redox conoscendo i
potenziali di riduzione delle due semireazioni imponendo che
all’equilibrio ΔE=0.
E°a-(RT/naF) ln(Qa) =Ec°-(RT/ncF) ln(Qc)
dove i pedici a e c identificano le due semireazioni scritte come
reazioni di riduzione
Se n è il numero complessivo di elettroni messi in gioco nella
reazione redox bilanciata (minimo comune multiplo di na ed nc) la
costante di equilibrio può essere scritta come rapporto dei
quozienti delle due semiriduzioni elevate per il coefficienti
moltiplicativi delle due semireazioni (n/na e n/nc) necessari per il
bilanciamento della reazione:
Keq = Qan/na /Qcn/nc
l’equazione si riduce a:
ln(Keq) = nF(E°a-E°c)/RT
a 25 °C e passando al logaritmo in base 10
Keq = 10nΔE°/0.059
Esempio:
MnO4- + 5Fe2+ + 8H+
MnO4- + 8H+ +5eFe2+
Mn2+ +5Fe3+ + 4H2O
Mn2+ + 4H2O
Fe3+ + e-
E° = 1.51 V
E° = 0.77 V
Keq = 105*0.74/0.059 = 5.2x1062
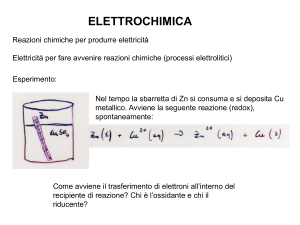
Cella Elettrolitica
I trattamenti galvanici sono ampiamente sfruttati per la doratura,
argentatura, zincatura, nichelatura, cromatura, ramatura, ecc. dei
metalli meno nobili. In questi trattamenti è utilizzata una cella
elettrolitica in cui il metallo da ricoprire fa da elettrodo ed è
immerso nella soluzione contenenti gli ioni del metallo ricoprente.
Applicando un’opportuna corrente elettrica continua si può ridurre
gli ioni della specie in soluzione che va a ricoprire l’elettrodo del
metallo da trattare (FILMATO).
Nella cella elettrolitica la direzione del flusso d’elettroni è opposta
rispetto a quella nella pila fotovoltaica. La reazione chimica che si
produce in questo modo è opposta rispetto alla reazione chimica
spontanea che avviene nella pila.
Ora l’elettrodo di zinco è il catodo e l’elettrodo di rame è l’anodo.
La batteria deve avere una tensione superiore a 1.103 V in modo
da forzare gli elettroni a fluire nella direzione opposta (non
spontanea).
La quantità di prodotto che si ottiene è relazionato alla quantità di
carica passata nel circuito:
quantità di carica
Coulomb= Ampere x secondo
1 Faraday = 96500 Coulomb = 1 mole di elettroni
Dall’equazione chimica si risale alla quantità di materia depositata
agli elettrodi.
Ad esempio, quanti grammi di zinco metallico si depositano
all’elettrodo facendo passare per 100 secondi una corrente di 10
A?
Zn2+ + 2e-
Zn
C=A*s=10*100=1000 C
F=1000/96500=0.01036 F
0.01036 moli di elettroni
0.01036/2=0.00518 moli di Zn
0.00518*65.39=0.339 g di Zn
I faraday (moli d’elettroni) utilizzati per la reazione di riduzione
sono gli stessi che si producono nella reazione d’ossidazione.
Ad esempio nella reazione d’elettrolisi dell’acqua le moli
d’idrogeno sviluppate nella reazione di riduzione:
2H3O+ + 2e-
H2 + 2H2O
sono il doppio delle moli ossigeno sviluppate nella reazione di
ossidazione:
4OH-
O2 + 2H2O + 4e-
Infatti, per bilanciare gli elettroni coinvolti nelle due semireazioni,
è necessario moltiplicare la prima reazione per 2 (FILMATO).