point break
Le relazioni tra peptidi natriuretici e antagonista
della neprilisina: ovvero quando la semplificazione
clinica affronta la complessità dei sistemi biologici
Giuseppe Di Tano1, Aldo Clerico2
U.O. Cardiologia, Ospedale di Cremona, ASST, Cremona
Scuola Superiore Sant’Anna e Fondazione CNR-Regione Toscana G. Monasterio, Pisa
1
2
A large body of evidence supports the use of natriuretic peptides (brain natriuretic peptide [BNP] and
N-terminal proBNP [NT-proBNP]) for the evaluation and management of patients with heart failure over
time. Elevated values reflect an enhanced counterregulatory response to hemodynamic stress and are indicative of heart failure severity, thus predicting prognosis. The clinical relevance and result interpretation
of natriuretic peptides for monitoring therapy are still debated, and our understanding of their complex
nature is still far from being complete. The new data about the clinical efficacy of LCZ696, a combination
neprilysin inhibitor and angiotensin receptor blocker recently approved for the treatment of symptomatic
chronic heart failure, showed a different susceptibility of BNP and NT-proBNP during therapy. The aim of
this article is to discuss the controversial issues concerning the clinical use of cardiac natriuretic peptide
measurement, the complex relationship with neprilysin pathways, and the practical implications of LCZ696
therapy for natriuretic peptide testing in clinical practice.
Key words. Brain natriuretic peptide; Heart failure; Neprilysin inhibitors; N-terminal pro-brain natriuretic
peptide.
G Ital Cardiol
“L’unico modo di risolvere i problemi è di conoscerli,
di sapere che ci sono.
Il semplicismo li cancella e così li aggrava”.
Giovanni Sartori
LO SCENARIO
L’andamento dei valori dei peptidi natriuretici (PN) (peptide
natriuretico di tipo B [BNP] e frammento N-terminale del
proBNP [NT-proBNP]), finora considerati “clinicamente” similari nel follow-up dello scompenso cardiaco (SC), oltre ad
essere un accurato indice prognostico, si è rivelato, in pazienti
selezionati, anche una potenziale guida all’ottimizzazione terapeutica1-5.
Il razionale dell’utilizzo dei PN nella monitorizzazione dello
SC deriva dall’osservazione che pazienti che presentavano, in
seguito ai trattamenti raccomandati, una riduzione significativa dei livelli circolanti di PN, avevano una prognosi migliore
rispetto ai pazienti in cui i PN non si riducevano o addirittura
aumentavano1,6-8. In realtà l’utilità dei PN come guida terapeutica, nonostante l’indubbio “appeal”, rimane tuttora incerta7.
Infatti, sebbene alcuni trial randomizzati abbiano mostrato
come la terapia guidata dai biomarcatori si associ ad un utilizzo
© 2016 Il Pensiero Scientifico Editore
Ricevuto 04.07.16; nuova stesura 04.08.2016; accettato 01.09.2016.
Gli autori dichiarano nessun conflitto di interessi.
Per la corrispondenza:
Dr. Giuseppe Di Tano U.O. Cardiologia, Ospedale di Cremona,
ASST di Cremona, Largo Priori 1, 26100 Cremona
e-mail: [email protected]
più appropriato, specie nei dosaggi degli inibitori dell’enzima
di conversione dell’angiotensina e dei betabloccanti, i vantaggi in termini di outcome non sono stati consistenti in tutte le
popolazioni studiate7,8, tanto che i PN come guida all’ottimizzazione della terapia sono stati inseriti nelle linee guida dell’American College of Cardiology/American Heart Association
(ACC/AHA) in una classe di raccomandazione IIa con livello di
evidenza B4.
Da considerare infine come i livelli plasmatici di PN, a
parità di apparente severità di sintomi e di compromissione
cardiaca, presentano un’ampia variabilità intra- ed interindividuale, possono essere influenzati dall’età, dall’indice di massa
corporea, dalla funzione renale, dalla presenza di fibrillazione
atriale o anemia, oltre che dai sistemi di dosaggio utilizzati9-11.
In tempi in cui la rapidità e la semplificazione sono considerati un valore aggiunto, la possibilità di riassumere una
serie di elementi complessi in un singolo numero ha suscitato
un prevedibile interesse nel mondo cardiologico, già abituato
ad utilizzare “numeri” (vedi ad esempio la frazione di eiezione) su cui basare importanti scelte operative. Nel caso dei
PN, la traslazione in un singolo valore di una serie di meccanismi fisiopatologici, riflesso di un “disarray” cardiovascolare
ed indice di severità della cardiopatia di base e di risposta a
specifiche terapie, rappresenta un indubbio e apprezzato ausilio, semplice ed economicamente sostenibile, per la gestione
clinica del paziente con SC, che continua ad essere, specie
in contesti extraospedalieri, indubbiamente complessa e non
omogenea.
Dopo decenni di sostanziale staticità nel settore della farmacoterapia dello SC cronico, nel settembre 2014 sono stati
G ITAL CARDIOL |
1
G Di Tano, A Clerico
resi noti i risultati del più ampio trial randomizzato (8442 pazienti) sullo SC cronico – il PARADIGM-HF – che ha testato
comparativamente l’enalapril vs un’associazione farmacologica denominata LCZ69612,13, che inaugura una nuova classe di
farmaci, denominata “inibitori del recettore dell’angiotensina
e della neprilisina” (ARNI) in quanto costituiti da due sostanze
farmacologicamente attive, un competitore specifico del recettore dell’angiotensina II (il valsartan) e un inibitore dell’enzima neprilisina (AHU377, il sacubitril), in rapporto molecolare 1:112,14. Lo studio è stato interrotto prematuramente, dopo
un follow-up mediano di 27 mesi, per il riscontro di un netto
beneficio del trattamento con LCZ696: l’outcome primario si
era verificato in 914 pazienti (21.8%) del gruppo LCZ696 e in
1117 pazienti (26.5%) del gruppo enalapril (hazard ratio nel
gruppo LCZ696 0.80; intervallo di confidenza [IC] 95% 0.730.87; p<0.001). Rispetto all’enalapril, LCZ696 ha determinato
anche una riduzione del 21% del rischio di ospedalizzazione per SC (p<0.001) oltre ad un miglioramento dei sintomi
e delle limitazioni fisiche dello SC (p=0.001)12. Dopo questi
risultati e la rapida approvazione con elevata priorità da parte
della Food and Drug Administration e della European Medicines Agency nel giugno 2015, gli ARNI sono stati inseriti nelle
nuove linee guida europee e nell’aggiornamento delle linee
guida dell’ACC/AHA, con un elevato grado di raccomandazione (IB)5,15. Dal 4 aprile 2016 il farmaco è in commercio in
Italia, attualmente in classe C in attesa della valutazione delle
modalità di rimborsabilità, ed è prevista la sua diffusione in
110 paesi, con una produzione di circa 35 milioni di confezioni entro il 2020 per 25 milioni di potenziali pazienti.
LCZ696 modifica l’approccio concettuale alla terapia farmacologica dello SC orientandola, oltre che nella riduzione
dell’iperattività neurormonale (adrenergica e angiotensinica),
verso il potenziamento dell’attività di vie neurormonali antagoniste mediante una limitazione della loro inibizione fisiologica15-19. Il meccanismo chiave è l’inibizione della neprilisina,
enzima proteolitico che degrada numerosi peptidi circolanti,
come la bradichinina, l’adrenomedullina, l’endotelina e l’angiotensina, ma soprattutto il peptide natriuretico atriale (ANP)
e il BNP, che svolgono un’azione cardioprotettiva contrastando i meccanismi patologici che causano il rimodellamento
cardiaco14,16,17. La sua inibizione prolunga l’emivita di queste
sostanze, specie ANP e BNP che, persistendo in circolo, esercitano il loro effetto tramite il legame con i recettori dei PN
aumentando la produzione di cGMP, stimolando la diuresi e la
natriuresi e riducendo lo stress miocardico14,16,17. Inoltre ANP e
BNP inibiscono la secrezione di renina e aldosterone, e l’antagonismo con il recettore AT-1 infine riduce la vasocostrizione,
la ritenzione di sodio e di acqua e contrasta l’ipertrofia miocardica14,16.
I risultati del PARADIGM-HF, anche se ottenuti in una popolazione con criteri di arruolamento non del tutto generalizzabili ai pazienti con SC cronico del mondo reale12, hanno
destato ulteriore interesse in quanto per la prima volta si è
evidenziato, durante una terapia specifica e significativamente efficace per lo SC, un comportamento diametralmente
opposto tra i livelli di BNP (aumento) e NT-proBNP (riduzione). Tale andamento può essere spiegato dal fatto che solo
l’ormone attivo BNP, ma non il peptide inattivo NT-proBNP, è
degradato dalla neprilisina: pertanto in seguito all’inibizione
dell’attività di quest’ultima, i livelli di BNP tendono ad aumentare a causa di una diminuzione della sua degradazione18. Alla
luce di questi risultati, alcuni autori18,19 hanno suggerito l’uso
2
G ITAL CARDIOL 2016
dell’NT-proBNP come biomarcatore di scelta per il monitoraggio dei pazienti in trattamento con LCZ696.
La sensazione anche in questo caso è di un’apparente
tendenza alla semplificazione, rispetto alla complessità di un
sistema quale quello dei PN (il cosiddetto “puzzle dei PN”),
molto più articolato di quanto inizialmente ipotizzato20.
Scopo delle considerazioni che seguiranno è quello di evidenziare la complessità dei sistemi regolatori del sistema dei
PN, in relazione ai sistemi di dosaggio e alle nuove implicazioni farmacologiche, e fornire così ai clinici alcuni elementi fisiopatologici utili ad interpretare le variazioni dei livelli circolanti
dei PN nei pazienti con SC, sfuggendo per quanto possibile a
generiche e fuorvianti semplificazioni.
I PROTAGONISTI
I peptidi natriuretici: recenti acquisizioni
I PN cardiaci ANP e BNP sono ormoni proteici secreti dai miocardiociti10,11,21 mentre il peptide natriuretico di tipo C (CNP),
appartenente alla stessa famiglia, è secreto principalmente
dall’endotelio vascolare. Presentano una potente e rapida azione natriuretica e vasodilatante oltre ad un’azione antiproliferativa sia sul tessuto miocardico che vasale10,11,21. La loro struttura
molecolare è caratterizzata dalla presenza di un anello peptidico con un ponte di cisteina, fondamentale per l’attività biologica, in quanto è la parte della catena peptidica che si lega ai
recettori specifici10. La rottura di questo anello da parte degli
enzimi proteolitici plasmatici comporta la perdita dell’attività
biologica del peptide10. I recettori specifici dei PN sono presenti
in tutte le cellule e tessuti dell’organismo (compreso il sistema
nervoso centrale) e al momento sono state identificate tre classi
di recettori: A, B e C. I recettori A (che legano preferenzialmente ANP e BNP) e B (che legano preferenzialmente il CNP)
mediano tutte le funzioni biologiche conosciute degli ormoni
natriuretici, mentre i recettori di tipo C sembrano svolgere soprattutto una funzione di clearance e quindi permettere una
più rapida eliminazione degli ormoni circolanti10.
Nell’uomo il BNP è sintetizzato a partire da un peptide
precursore di 108 aminoacidi, il proBNP. Prima della secrezione in circolo, il proBNP può essere tagliato da proteasi specifiche con la produzione di un peptide NH2-terminale di 76
aminoacidi, NT-proBNP, e un peptide più corto di 32 aminoacidi COOH-terminale, che è l’ormone peptidico biologicamente
attivo BNP (Figura 1). Si è osservato che in circolo si possono
evidenziare non solo il precursore intatto proBNP, il peptide
inattivo NT-proBNP e l’ormone attivo BNP, ma anche numerosi peptidi da loro derivati per azione della degradazione
da parte degli enzimi plasmatici10,11. Il proBNP e l’NT-proBNP
sono presenti nel plasma di pazienti con SC, sia in forma non
glicosilata che glicosilata, mentre il BNP non è glicosilato ed
è rapidamente degradato in circolo da diverse peptidasi, tra
cui la neprilisina17,18. Le principali caratteristiche biochimiche
e fisiologiche dei PN sono riassunte in Tabella 1.
Alcuni recenti studi hanno documentato come il BNP possa essere prodotto anche in circolo dal precursore proBNP tramite l’azione catalitica di alcune proteasi plasmatiche, come la
corina10,11. Da un punto di vista fisiologico, il precursore proBNP dovrebbe essere considerato un pro-ormone circolante.
Vi sarebbero quindi due pool distinti di proBNP da cui può
essere prodotto l’ormone attivo BNP: il pool citoplasmatico
dei miocardiociti e il pool plasmatico del proBNP, che è stato
Peptidi natriuretici e antagonisti della neprilisina
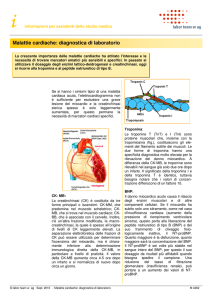
proBNP
Miocardiocita
1-108
(pool cellulare)
Corina / Furina
Membrana cellulare
Plasma
NT-proBNP1-76
BNP
1-32
Corina
plasmatica
proBNP1-108
Enzimi
proteolitici
Peptidi a catena
più corta
NP-R
(pool plasmatico)
Membrana cellulare
Cellula tissutale
Figura 1. Pool citoplasmatico e plasmatico del pro-peptide natriuretico di tipo
B (proBNP). Esistono due pool distinti di proBNP da cui può essere prodotto
l’ormone BNP: il pool citoplasmatico dei miocardiociti e quello plasmatico del
proBNP, che è costituito dal peptide secreto dai miocardiociti, ma che risiede per
un certo tempo (si pensa almeno alcune ore) in circolo.
NP-R, recettore specifico dei peptidi natriuretici.
Tabella 1. Principali caratteristiche biochimiche e fisiologiche dei peptidi BNP, NT-proBNP e proBNP.
Massa molecolare
N. aminoacidi
BNP
NT-proBNP
proBNP
3462 Da
8457 Da
11 900 Daa
a
32
76
108
Ormone attivo
Inattivo
Pro-ormone
Emivita (min)
15-20
>60
>60
Glicosilazione
Non glicosilato
Glicosilato
Glicosilato
Funzione biologica
BNP, peptide natriuretico di tipo B; NT-proBNP, frammento N-terminale del proBNP.
a
la massa molecolare dei peptidi NT-proBNP e proBNP dipende dal
grado di glicosilazione dei peptidi, nella Tabella è riportata la massa
molecolare dei peptidi non glicosilati.
secreto dai miocardiociti, ma che risiede per un certo tempo
(si pensa almeno 1h) in circolo11. Inoltre, si potrebbe ipotizzare che la trasformazione enzimatica che avviene in circolo del
proBNP a BNP sia sottoposta a regolazione, e che questo meccanismo possa essere alterato nei pazienti con SC11,21. Questa ipotesi, se confermata, potrebbe aprire nuove prospettive
terapeutiche, suggerendo un nuovo bersaglio farmacologico
utile per contrastare la resistenza all’azione dei PN, che rappresenta uno dei meccanismi fisiopatologici più importanti
dello SC21.
I sistemi di dosaggio: considerazioni cliniche
Dalla fine degli anni ’90 i metodi per il dosaggio del BNP e
dell’NT-proBNP sono metodi immunometrici non competitivi
a tipo sandwich, che utilizzano due fasi leganti specifiche (i
primi metodi utilizzavano anticorpi policlonali, quelli più recenti anticorpi monoclonali) allo scopo di incrementare sia la
sensibilità che la specificità analitica, superando i limiti dei pri-
mi sistemi tipo RIA (radioimmunologico) o EIA (immunoenzimatico)22. Recentemente sono comparsi metodi per la misura
anche del proBNP non ancora commercializzati in Italia11.
Con tali metodiche, i valori dei PN nei pazienti con SC
risultano più elevati, fino 100 volte, rispetto ai soggetti normali, con una buona correlazione con le fasi della malattia e
la classe funzionale NYHA. Tuttavia, dal punto di vista dell’interpretazione clinica è importante considerare che i metodi di
dosaggio del BNP e NT-proBNP subiscono in varia misura interferenze dovute alla presenza del proBNP11,22. Considerando che il proBNP può raggiungere una concentrazione predominante nei pazienti con SC severo11,19, questa cross-reazione
comporta alcuni limiti riguardo l’interpretazione fisiopatologica e clinica dei risultati ottenuti con i metodi automatizzati
di dosaggio attualmente utilizzati specie per il BNP11,19,20, che
ne condizionano l’accuratezza reale dei livelli circolanti. In
più il proBNP, che contiene nella sua catena peptidica l’anello cisteinico, è in grado di legarsi al recettore specifico degli
ormoni natriuretici cardiaci, ma non lo stimola con la stessa
efficienza dei peptidi attivi ANP e BNP10,11, per cui, essendo
la sua emivita plasmatica più lunga e i suoi livelli plasmatici superiori rispetto a quelli degli ormoni attivi (Tabella 1), di
fatto crea una resistenza all’azione dei PN circolanti, competendo con essi per i siti recettoriali. In pratica il “numero finale” del BNP ottenuto con i metodi immunometrici, specie
in pazienti con SC severo, sovrastima la reale concentrazione
dell’ormone attivo circolante10,11,20. Alcuni studi, che hanno
utilizzato la cromatografia liquida ad alta pressione abbinata alla spettrometria di massa, hanno dimostrato che i livelli dell’ormone attivo BNP nei pazienti con SC sono ridotti e
non aumentati come invece indicherebbero i dosaggi con i
metodi immunometrici11,19,20. Si osserva quindi nella pratica
clinica il paradosso che nei pazienti con SC si misurano elevati
livelli di BNP, ma in verità solo pochi di questi peptidi sono
veramente attivi, con una resistenza periferica alla loro azione
G ITAL CARDIOL 2016
3
G Di Tano, A Clerico
dovuta almeno in parte al fatto che la maggior parte di essi
non sono attivi. Inoltre l’interpretazione clinica dei livelli circolanti di BNP risulta influenzata dal fatto che i comuni metodi
immunometrici utilizzano una coppia di anticorpi policlonali
o monoclonali, specifici per due separati epitopi della catena
peptidica dell’ormone, dotati di una differente suscettibilità
al clivaggio della neprilisina. Ciò comporta che vi siano delle
differenze sistematiche, anche fino a 2 volte, tra le misure
effettuate con metodiche diverse. In accordo con queste considerazioni, il clinico dovrebbe conoscere i sistemi utilizzati nel
proprio Laboratorio, sapendo che l’uso di metodiche diverse
possono rivelarsi fuorvianti nella monitorizzazione dei valori di
BNP nel tempo. Per contro, i metodi di dosaggio del peptide
inattivo NT-proBNP presentano minore variabilità poiché i materiali per la loro messa in commercio sono forniti da una sola
azienda e quindi i valori del peptide ottenuti dai laboratori
risultano meglio armonizzati tra loro.
LCZ696: effetti sul sistema dei peptidi natriuretici
Nel PARADIGM-HF i valori urinari del cGMP (un indice dell’attività dei PN) e quelli plasmatici del BNP (misurati con il metodo ADVIA Centaur, Siemens Healthcare Diagnostics) risultavano più elevati (in media di 50 ng/l rispetto ai valori basali medi
di 255 ng/l) durante il trattamento con LCZ696 che con enalapril12. Dopo 8 mesi, comunque, i valori di BNP nei pazienti
trattati con LCZ erano più bassi che a 4 settimane, probabilmente a causa di una ridotta produzione di BNP da parte dei
cardiomiociti, piuttosto che da una riduzione dell’azione farmacologica della neprilisina10,17,18. Al contrario, i livelli circolanti del peptide inattivo NT-proBNP e della troponina cardiaca
T (entrambi misurati con il metodo ECLIA, Roche Diagnostics),
che riflettono rispettivamente una riduzione dello stress e del
danno cardiaco10,19, erano più bassi durante il trattamento
con LCZ696 che con enalapril12.
Nel PARAMOUNT23, che confrontava LCZ696 con il solo
valsartan in pazienti con SC con frazione di eiezione conservata, i livelli di NT-proBNP si riducevano da un valore medio
di 763 ng/l (IC 95% 646-901) a 496 ng/l (IC 95% 401-613)
nei 115 pazienti trattati con LCZ696 per 36 settimane (cioè
una riduzione del 37% rispetto ai valori basali), mentre, al
contrario, da 822 ng/l (IC 95% 688-983) a 607 ng/l (IC 95%
484-760) nei 116 pazienti trattati con valsartan. La differenza
tra la riduzione dei livelli del biomarcatore è risultata significativa solamente nelle prime settimane di trattamento (a 12
settimane p=0.005), mentre a 36 settimane la differenza tra
i livelli di NT-proBNP nei due gruppi di pazienti non era più
significativa (p=0.20).
Analizzando congiuntamente i risultati dei due trial, la riduzione dei livelli circolanti di NT-proBNP (e della troponina
T) potrebbe essere spiegata con una diminuzione dello stress
cardiaco dovuta all’effetto del valsartan che blocca il recettore
dell’angiotensina II. Come noto6,9,10, una riduzione dell’attività
di un importate sistema ad azione controregolatrice rispetto
al sistema dei PN, come il sistema renina-angiotensina-aldosterone, causa a sua volta una diminuzione della produzione
dei PN e quindi dei livelli circolanti del peptide NT-proBNP, significativa rispetto ai valori basali già nella prima settimana di
trattamento. Infatti, il sistema dei PN è strettamente collegato
con meccanismi di feedback negativo alla rete degli effettori
del sistema neuro-immuno-ormonale che regola le principali
funzioni del nostro organismo10: la diminuzione della produzione dei recettori dei PN individua i pazienti che sono respon-
4
G ITAL CARDIOL 2016
sivi al trattamento farmacologico e costituisce il razionale per
l’utilizzo dei livelli circolanti dei PN per monitorare il trattamento nei pazienti con SC6,9,10.
D’altra parte, l’azione del sacubitril, contenuto nell’LCZ696,
può causare un innalzamento dei livelli circolanti degli ormoni
natriuretici (ANP, BNP e CNP), poiché inibisce la degradazione di questi peptidi da parte dell’enzima neprilisina a livello
periferico14,16,17. Non sono ancora ben noti gli effetti in vivo
nell’uomo del sacubitril sulla degradazione del BNP, soprattutto a causa delle difficoltà di determinare in modo accurato i
livelli circolanti del peptide attivo BNP e dei suoi metaboliti in
vivo nell’uomo11,19. Inoltre vi sono delle differenze nella catena peptidica dei BNP tra le specie, che, a loro volta, determinano differenze nell’attività degli enzimi proteolitici plasmatici
sul BNP umano rispetto agli altri mammiferi24. Tuttavia, studi
in vitro e in modelli animali hanno dimostrato che la neprilisina esplica un’azione proteolitica più potente sull’ANP e sul
CNP rispetto al BNP25,26. Questa preponderante azione della
neprilisina potrebbe spiegare il perché l’emivita biologica di
ANP e CNP sia molto più breve (pochi minuti) rispetto a quella
del BNP (più del doppio rispetto agli altri due peptidi attivi)25.
È stato dimostrato che diverse sostanze con attività inibitoria
sulla neprilisina sono in grado di aumentare i livelli circolanti
di ANP se somministrati acutamente per via endovenosa in
pazienti con trapianto cardiaco o ipertensione arteriosa26,27,
oppure per 2 settimane per via orale in pazienti con ipertensione arteriosa28. Parallelamente, aumentano anche i livelli
urinari di cGMP26, suggerendo che, almeno in parte, gli effetti
benefici nei pazienti con SC sono dovuti a un potenziamento
dell’attività di tutto sistema dei PN.
Infine, recentemente si è osservato come lo stesso BNP
circolante, a livelli elevati (>916 pg/ml), possa condizionare,
inibendola, l’attività della neprilisina29. Da una prospettiva
prettamente clinica, si potrebbe ipotizzare che LCZ696 può
avere differenti effetti in pazienti con bassi o alti livelli di BNP
ematico in seguito alla differente attività della neprilisina. Ciò
potrebbe richiedere la conoscenza dei valori di BNP basali preliminari nella gestione della terapia con LCZ69617.
INDICAZIONI OPERATIVE
Sebbene i livelli circolanti di BNP aumentino durante il trattamento iniziale con LCZ696, è molto probabile che essi subiscano interferenze dalla presenza in circolo del proBNP e di
altri peptidi inattivi a quest’ultimo collegati, per cui il dosaggio del BNP con metodi immunometrici di routine potrebbe
non fornire una valida stima della vera attività natriuretica del
sistema dei PN. Una stima più accurata dei livelli circolanti sia
del BNP che dell’ANP potrebbe essere eseguita mediante l’impiego di metodi più sensibili, basati sulla cromatografia e la
spettrometria di massa, ma tali tecniche sono attualmente costose, richiedono tempi lunghi per il dosaggio e necessitano
di personale e strumentazioni dedicate, risultando improponibili nella routine clinica.
Un uso ragionato dei PN potrebbe essere il seguente:
• l’NT-proBNP è al momento da considerare il marcatore
più utile nel monitorizzare l’efficacia e l’andamento a breve termine della nuova terapia, alla luce dei risultati del
PARADIGM-HF12 che hanno dimostrato come la diminuzione dei livelli circolanti del peptide sia correlata con il
miglioramento delle condizioni cliniche del paziente, della
Peptidi natriuretici e antagonisti della neprilisina
mortalità e della riospedalizzazione. Restano intatte le sue
capacità prognostiche a medio e lungo termine, anche se,
in quanto peptide inattivo, non è in grado di fornire una
stima della reale attività natriuretica circolante;
• il BNP rimane un forte predittore prognostico, specie a
distanza, quando i valori ematici sono meno condizionati
dagli effetti inibenti del farmaco sulla sua degradazione.
Un suo incremento durante le prime settimane di terapia
con LCZ696 può non riflettere un peggioramento clinico,
ma traduce piuttosto l’attività farmacologica del nuovo
trattamento.
CONCLUSIONI
Le interconnessioni delle azioni di LCZ696 sul sistema dei
PN ha accentuato l’incertezza sul ruolo dei PN nella monitorizzazione della terapia, indebolendo ulteriormente l’ipotesi semplicistica che un “numero”, fornito da un test di
laboratorio anche sofisticato, possa automaticamente tradurre complessi e sofisticati modelli fisiopatologici e clinici.
L’adozione della nuova terapia e le future conoscenze sui
modelli molecolari coinvolti richiederanno al clinico un adeguato up-grading culturale e una maggiore familiarità con il
Laboratorio, in quanto è prevedibile che i biomarcatori rivestiranno un ruolo sempre più rilevante nella gestione clinica
e terapeutica del paziente con SC.
BIBLIOGRAFIA
1. Emdin E, Clerico A, Clemenza F, et al.
Consensus document. Recommendations
for the clinical use of cardiac natriuretic
peptides. Ital Heart J 2005;6:430-46.
2. McMurray JJ, Adamopoulos S, Anker
SD, et al. ESC guidelines for the diagnosis
and treatment of acute and chronic heart
failure 2012: The Task Force for the Diagnosis and Treatment of Acute and Chronic
Heart Failure 2012 of the European Society
of Cardiology. Developed in collaboration
with the Heart Failure Association (HFA) of
the ESC. Eur J Heart Fail 2012;14:803-69.
3. Thygesen K, Mair J, Mueller C, et al.;
Study Group on Biomarkers in Cardiology of the ESC Working Group on Acute
Cardiac Care. Recommendations for the
use of natriuretic peptides in acute cardiac
care: a position statement from the Study
Group on Biomarkers in Cardiology of the
ESC Working Group on Acute Cardiac
Care. Eur Heart J 2012;33:2001-6.
4. Yancy CW, Jessup M, Bozkurt B,
et al. 2013 ACCF/AHA guideline for the
management of heart failure: a report of
the American College of Cardiology Foundation/American Heart Association Task
Force on Practice Guidelines. J Am Coll
Cardiol 2013;62:e147-239.
5. Ponikowski P, Voors AA, Anker SD,
et al. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic
heart failure: The Task Force for the diagnosis and treatment of acute and chronic
RIASSUNTO
L’uso dei peptidi natriuretici nella gestione dello scompenso cardiaco è ormai ampiamente codificato. L’andamento dei valori di
peptide natriuretico di tipo B (BNP) e del frammento N-terminale del proBNP (NT-proBNP), considerati clinicamente similari nel
follow-up dei pazienti con scompenso cardiaco cronico, oltre ad
essere un accurato indice prognostico ed un precoce segno di
instabilizzazione clinica, è una potenziale guida all’ottimizzazione
terapeutica. Recentemente si è dimostrato come il sistema dei
peptidi natriuretici sia molto più complesso ed articolato di quanto inizialmente ipotizzato, oltre che condizionato dai metodi di
dosaggio utilizzati. D’altra parte i recenti positivi risultati sull’efficacia di un nuovo farmaco con duplice effetto, antagonista
dell’angiotensina II e inibitore dell’enzima neprilisina, l’LCZ696,
hanno evidenziato per la prima volta, oltre alle interconnessioni esistenti tra il sistema dei peptidi natriuretici e quello della
neprilisina, un diverso comportamento dei due peptidi durante
la terapia con LCZ696. Scopo del presente articolo è quello di
sottolineare la complessità dei sistemi regolatori del sistema dei
peptidi natriuretici, in relazione ai sistemi di dosaggio e alle nuove
implicazioni farmacologiche, fornendo ai clinici alcuni elementi fisiopatologici utili ad interpretare adeguatamente le variazioni dei
livelli circolanti dei peptidi natriuretici nei pazienti con scompenso cardiaco cronico, in particolare durante la terapia con questa
nuova classe di farmaci.
Parole chiave. Antagonisti della neprilisina; Frammento N-terminale del pro-peptide natriuretico di tipo B; Peptide natriuretico di
tipo B; Scompenso cardiaco.
heart failure of the European Society of
Cardiology (ESC) developed with the special contribution of the Heart Failure Association (HFA) of the ESC. Eur J Heart Fail
2016;18:891-975.
6. Clerico A, Fontana, M, Ripoli A,
Emdin M. Clinical relevance of BNP measurement in the follow-up of patients
with chronic heart failure. Adv Clin Chem
2009;48:163-79.
7. Desai AS. Are serial BNP measurements useful in heart failure management? Serial natriuretic peptide measurements are not useful in heart failure
management: the art of medicine remains
long. Circulation 2013;127:509-16.
8. Troughton R, Felker MG, Januzzi JL
Jr. Natriuretic peptide-guided heart failure
management. Eur Heart J 2014;35:16-24.
9. Bhardwaj A, Januzzi JL Jr. Natriuretic
peptide-guided management of acutely
destabilized heart failure: rationale and
treatment algorithm. Crit Pathw Cardiol
2009;8:146-50.
10. Clerico A, Giannoni A, Vittorini S,
Passino C. Thirty years of the heart as an
endocrine organ: physiological role and
clinical utility of cardiac natriuretic hormones. Am J Physiol Heart Circ Physiol
2011;301:H12-20.
11. Clerico A, Passino C, Franzini M, Emdin M. Cardiac biomarker testing in the
clinical laboratory: where do we stand?
General overview of the methodology
with special emphasis on natriuretic peptides. Clin Chim Acta 2015;443:17-24.
12. Packer M, McMurray JJ, Desai AS,
et al.; PARADIGM-HF Investigators and
Coordinators. Angiotensin receptor neprilysin inhibition compared with enalapril on
the risk of clinical progression in surviving
patients with heart failure. Circulation
2015;131:54-61.
13. McMurray JJ, Packer M, Desai AS, et
al.; PARADIGM-HF Investigators and Committees. Angiotensin-neprilysin inhibition
versus enalapril in heart failure. N Engl J
Med 2014;371:993-1004.
14. McCormack PL. Sacubitril/valsartan: a review in chronic heart failure
with reduced ejection fraction. Drugs
2016;76:387-96.
15. Yancy CW, Mariell Jessup M, et al.
2016 ACC/AHA/HFSA focused update on
new pharmacological therapy for heart
failure: an update of the 2013 ACCF/AHA
guideline for the management of heart
failure: a report of the American College
of Cardiology/American Heart Association
Task Force on Clinical Practice Guidelines
and the Heart Failure Society of America. J
Am Coll Cardiol 2016;68:1476-88.
16. Singh JS, Lang CC. Angiotensin receptor-neprilysin inhibitors: clinical potential in heart failure and beyond. Vasc
Health Risk Manag 2015;11:283-95.
17. Bayés-Genis A. Neprilysin in heart
failure: from oblivion to center stage.
JACC Heart Fail 2015;3:637-40.
G ITAL CARDIOL 2016
5
G Di Tano, A Clerico
18. Januzzi JL Jr. B-type natriuretic peptide testing in the era of neprilysin inhibition: are the winds of change blowing?
Clin Chem 2016;62:663-5.
19. Jaffe AS, Apple FS, Mebazaa A, Vodovar N. Unraveling N-terminal pro-B-type
natriuretic peptide: another piece to a very
complex puzzle in heart failure patients.
Clin Chem 2015;61:1016-8.
20. Clerico A, Emdin M. Endocrine paradox in heart failure: resistance to biological
effects of cardiac natriuretic hormones.
Clin Chem 2004;50:2465-7.
21. Del Ry S, Cabiati M, Clerico A. Recent advances on natriuretic peptide system: new promising therapeutic targets
for the treatment of heart failure. Pharmacol Res 2013;76:190-8.
22. Clerico A, Emdin M. Diagnostic
accuracy and prognostic relevance of
the measurement of the cardiac natriuretic peptides: a review. Clin Chem
2004;50:33-50.
6
G ITAL CARDIOL 2016
23. Solomon SD, Zile M, Pieske B, et
al.; Prospective comparison of ARNI with
ARB on Management Of heart failUre
with preserved ejectioN fracTion (PARAMOUNT) Investigators. The angiotensin
receptor neprilysin inhibitor LCZ696 in
heart failure with preserved ejection fraction: a phase 2 double-blind randomised
controlled trial. Lancet 2012;380:138795.
24. Pankow K, Schwiebs A, Becker M,
Siems WE, Krause G, Walther T. Structural substrate conditions required for
neutral endopeptidase-mediated natriuretic peptide degradation. J Mol Biol
2009;393:496-503.
25. Potter LR. Natriuretic peptide metabolism, clearance and degradation. FEBS J
2011;278:1808-17.
26. Piquard F, Richard R, Charloux A,
et al. Hormonal, renal, hemodynamic responses to acute neutral endopeptidase
inhibition in heart transplant patients. J
Appl Physiol 2002;93:569-75.
27. Seed A, Kuc RE, Maguire JJ, et al.
The dual endothelin converting enzyme/
neutral endopeptidase inhibitor SLV-306
(daglutril), inhibits systemic conversion
of big endothelin-1 in humans. Life Sci
2012;91:743-8.
28. Johnson AG, Pearce GL, Danoff TM.
A randomized, double-blind, placebo-controlled, parallel-group study to assess the
efficacy and safety of dual ACE/NEP inhibitor GW660511X in mild-to-moderate
hypertensive patients. J Hum Hypertens
2006;20:496-503.
29. Vodovar N, Séronde MF, Laribi S,
et al.; GREAT Network. Elevated plasma
B-type natriuretic peptide concentrations directly inhibit circulating neprilysin
activity in heart failure. JACC Heart Fail
2015;3:629-36.