La conduttimetria
Il moto molecolare nei liquidi
• Il movimento degli ioni nei liquidi può contribuire a fornire
informazioni anche sul movimento delle specie prive di
carica.
Tempi di rilassamento
(NMR, ESR)
Mobilità delle molecole
Scattering anelastico
di neutroni
Viscosità
Misure di viscosità
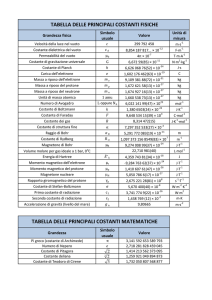
Tipi di elettroliti
Λm =
κ
c
Unità di misura = S m2 mol–1 (S cm2 mol–1)
Conduttività molare
• La
conduttività varia con la concentrazione in modo
complesso, anche perché il numero di ioni in soluzione può
non essere proporzionale alla concentrazione dell’elettrolita.
• Elettrolita forte: la conduttività varia poco con la
concentrazione
• Elettrolita debole: la conduttività diminuisce nettamente
all’aumentare della concentrazione.
Dipendenza di Λm dalla concentrazione
Elettrolita forte
La natura dell’elettrolita dipende anche dal
solvente (acqua nella figura)
Elettrolita debole
Gli elettroliti forti
• Sostanze completamente dissociate (acidi forti, solidi
ionici)
• Concentrazione degli ioni ∝ concentrazione elettrolita
Legge di Kohlrausch:
Λ m = Λ0m − Kc1 / 2
Conduttività molare limite
Funzione della stechiometria
Gli elettroliti forti
•
Λ0m può essere espressa come somma dei contributi
dovuti ai singoli ioni
Legge della migrazione indipendente degli ioni
(Kohlrausch, 1874)
Λ0m = ν + λ+ + ν − λ−
Principio di sovrapposizione!
Numero di ioni nell’unità formula dell’elettrolita
(es.: ν+ = ν– = 1 in HCl)
Qual è l’approssimazione?
A diluizione infinita l’interazione coulombiana deve essere
trascurabile!
Problema
Determinare la conduttività molare limite in acqua a 298 K
di H2SO4 sapendo che
λ (H+) = 34,96 mS m2 mol–1
λ (SO42–) = 16,00 mS m2 mol–1
Gli elettroliti deboli
• Sostanze che in soluzione non si ionizzano completamente
(es. acidi e basi deboli, CH3COOH, NH3)
• A bassa concentrazione, l’equilibrio si sposta verso i
prodotti
a H O + + a A−
Ka = 3
HA(aq) + H2O (l) ↔ H3O+ (aq) + A–(aq)
a HA
• La conduttività dipende dal grado di ionizzazione
dell’elettrolita, α. Nel caso di acidi si considera il grado di
deprotonazione, definito in modo tale che all’equilibrio alla
concentrazione c sia
[H3O+] = αc
[A–] = αc
[HA] = (1–α)c
Gli elettroliti deboli
• La costante di acidità, Ka, sarà data circa da
α c
Ka =
1−α
2
1/ 2
⎡
⎤
⎞
Ka ⎛
4
c
⎢⎜1 +
⎟⎟ − 1⎥
α=
⎜
2c ⎢⎝
Ka ⎠
⎥
⎣
⎦
• A diluizione infinita l’acido sarà totalmente deprotonato,
mentre alla concentrazione c si avrà:
Λ m = αΛ0m
Gli elettroliti deboli
• Se è nota Ka è possibile prevedere la dipendenza della
conduttività molare dalla concentrazione
1
α
=1+
αc
Ka
Λ mc
1
1
= 0 +
Λ m Λ m K Λ0
a
m
( )
2
Legge della diluizione di Ostwald
Problema
• La conduttività molare a 298K di CH3COOH(aq) 0.01 M
vale 1.65 mS m2 mol–1. Sapendo che Λm0 = 39.05 mS m2
mol–1, quanto vale il pKa?
pKa = 4.72
La mobilità degli ioni
• Dati due elettrodi a distanza l tra i quali è applicata una
differenza di potenziale ΔV, gli ioni sperimenteranno un
campo elettrico
ΔV
E≅
l
• Uno ione di carica ze sperimenterà una forza di intensità
zEΔV
F = zeE =
l
• Il moto accelerato dello ione sarà contrastato da una forza
di attrito
Fattr = fs = 6πηas
Legge di Stokes
velocità
• L’effetto delle due forze farà si che lo ione raggiunga una
velocità limite, s, (velocità di drift)
zeE
s=
= uE
f
ze
ze
u=
=
f
6πηa
Mobilità (m2 s–1 V–1)
Stimiamo l’ordine di grandezza di u per uno ione in
soluzione (es. Cs+):
a = 170 pm, z = 1, e = 1.6x10–19 C,
η = 1 cP = 10–3 kg m-1 s–1
u ≈ 5x10−8 m2 s–1 V–1
Mobilità e conduttività
• Tra la mobilità di uno ione e la sua conduttività molare,
λ, esiste la relazione:
λ = zuF
F = N Ae = 96485.3C / mol
Costante di Faraday
• Più in generale si ha che:
n
κ = ∑ zqu
i =1
Carica positiva o negativa
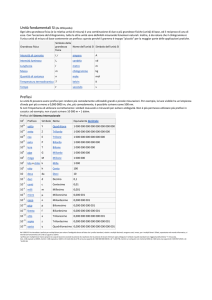
Dimostrazione della relazione λ = zuF
Elettrolita totalmente
dissociato a concentrazione c
Concentrazione molare: ν±c
Densità di popolazione: ν±cNa
Numero degli ioni di ciascun tipo
che passano attraverso la finestra A
nel tempo Δt: sΔtAνcNa
sΔtAνcN a
=
= sνcN a
AΔt
Flusso ionico:
J ioni
Flusso di carica (ze):
J carica = sνczeN a = sνczF
Poiché s=uE, si ha:
J carica = uνczFE
L’intensità di corrente, I, vale:
I = JA = uνczFEA
uνczFAΔφ
Sapendo che E= Δφ/l si ha:
I=
l
κA
Δφ
Ricordando la 1° legge di Ohm: I =
= GΔφ =
Δφ
R
l
Da cui:
κ = uνczF
κ
λ = = uzF
νc
I numeri di trasporto
• Il numero di trasporto ionico è la frazione della intensità
di corrente trasportata dagli ioni di una data specie
I±
t± =
I
t+ + t− = 1
• Il numero di trasporto limite, t±0, è definito rispetto al
limite di concentrazione nulla dell’elettrolita.
• Poiché la corrente dovuta a ogni ione è correlata con la
mobilità dello ione stesso, si ha:
t ±0
z ± v± u ±
=
z + v+ u + + z − v− u −
• Poiché z+v+=z–v– per qualsiasi elettrolita, si ha:
t ±0
u±
=
u+ + u−
• Sapendo poi che le conduttività ioniche sono correlate
alle mobilità dei singoli ioni, si ha
t ±0
v ± λ±
v ± λ±
=
= 0
v + λ+ + v − λ−
Λm
0 0
Λ mt ±
= v ± λ±
La misura dei numeri di trasporto
• Metodo della superficie migrante (moving
boundary method)
current
z + clAF
t+ =
IΔt
Journal of American Chemical Society
• Metodo di Hittorf
• Si suddivide la cella elettrolitica in tre comparti e si fa
passare una carica IΔt.
• Al catodo si scarica una quantità di carica IΔt/z+F,
mentre nel comparto catodico affluisce una quantità
t+Δt/z+F.
IΔt
IΔt
variazione netta = (t + − 1)
= −t −
z+ F
z+ F
• Misurando la variazione di composizione si ricava il
numero di trasporto dell’anione. Nello stesso modo si
opera all’anodo per il numero di trasporto cationico.
• Metodo ac/dc
• Metodo del gradiente impulsato NMR
• Metodo dei radiotraccianti
Misure di numeri di trasporto allo stato solido
(elettroliti vetrosi, ceramici e polimerici)
Conduttività e interazioni tra ioni
• Qual è l’origine della dipendenza da c1/2?
• Ruolo giocato dall’atmosfera ionica (“nebbia di carica”)
– Effetti di rilassamento (∝ frequenza campo elettrico)
– Effetto elettroforetico
Teoria di Debye-Huckel-Onsager
K = A + BΛ0m
1/ 2
z eF ⎛ 2 ⎞
A=
⎜
⎟
3πη ⎝ εRT ⎠
2
2
Viscosità
1/ 2
qz eF ⎛ 2 ⎞
B=
⎜
⎟
24πεRT ⎝ εRT ⎠
3
2
Costante dielettrica
La diffusione (trattazione semplificata)
• Prima legge di Fick. Il flusso delle particelle è
proporzionale al gradiente della loro concentrazione:
dc
J = −D
dx
Coeff. di diffusione (m2s–1)
• Il flusso è correlato con la velocità di deriva, s, attraverso
la relazione:
J = sc
• Da cui:
dc
sc = − D
dx
(Caso generale)
• (Caso particolare) uno ione in soluzione ha velocità di
deriva s=uE, quando sperimenta una forza f=ezE
dovuta al campo elettrico E. In questo caso si ha:
zFD
u=
RT
Relazione di Einstein
uRT
D=
zF
L’equazione di Nernst-Einstein
• L’equazione di Einstein collega la conduttività molare e i
coefficienti di diffusione degli ioni.
z 2 DF 2
λ = zuF =
RT
• Ricordando la legge di Kohlrausch della migrazione
indipendente degli ioni, si ha
(
Λ0m = ν + z +2 D+ + ν − z −2 D−
)
F2
RT
Relazione di Nernst-Einstein
L’equazione di Stokes-Einstein
• Le equazioni seguenti correlano la mobilità dello ione
con l’attrito e il coefficiente di diffusione
ez
u=
f
zFD
u=
RT
• Ricordando che k=eR/F si ottiene la relazione di
Stokes- Einstein
kT
D=
f
D=
kT
6πηa
La regola di Walden
Λ mη = costante
• Problema: utilizzare la mobilità per calcolare coefficiente
di diffusione, conduttività molare limite e raggio
idrodinamico (es.: dello ione solfato)
La velocità di diffusione
D = 5x10–10 m2 s–1
2
x (t )
1/ 2
= (2 Dt )1/ 2
Pendenza corretta
Spostamento quadratico medio
x2
xi2
=∑
i =1 n
n
Il processo diffusivo è lento o veloce?
PMFG-NMR: il coefficiente di autodiffusione
Pulsed Magnetic Field Gradient
(PMFG)
o Pulsed Gradient Spin Echo (PGSE)
Stimulated Pulse Field Gradient (SPFG)
Il coeff. di autodiffusione, D, si ottiene dall’altezza
dell’eco al variare di Δ
⎡
1 ⎞⎤
2⎛
M = M0 exp⎢− D(γGδ ) ⎜ Δ − δ ⎟⎥
⎝ 3 ⎠⎦
⎣
Esempio: Membrane gel a base di PVdF-HFP
0.5 M
30-70 wt%
40-60 wt%
polimerosoluzione
polimerosoluzione
50-50 wt% polimerosoluzione
1M
Conduttività e numero di trasporto
Equazione di Nernst-Einstein
⎛ Ne2 ⎞
⎟(Dcation + Danion)
σ NMR = ⎜
⎜ kT ⎟
⎝
⎠
Problema: le conducibilità calcolate da DNMR sono generalmente maggiori di quelle misurate.
Questo è dovuto alla presenza di coppie anione-catione (bassa dissociazione, correlazioni shortlived).
Numero di trasporto
cationico
t+ =
Infatti
DLi
DLi + DF
(apparente!)
Dexp = xDione + (1−x)Dcoppia
Membrane porose a base di PVdF
Elettrolita: soluzione 1 M di LiN(CF3SO2)2 in EC/DEC 2:3
v:v
Dipendenza della conduttività dalla
temperatura
0
• Arrhenius
-1
⎛ Ea ⎞
σ (T ) = σ 0 exp⎜ −
⎟
⎝ kT ⎠
(Vetri e polimeri sotto la Tg)
ln σT (S cm K)
-2
x = 0.0
x = 0.1
x = 0.2
x = 0.3
x = 0.4
x = 0.5
-4
-6
-8
-10
-12
3
4
5
1000/T (K-1)
• Vogel-Tammann-Fulcher (VTF)
⎛
B ⎞
⎟⎟
σ (T ) = σ 0 exp⎜⎜ −
⎝ T − T0 ⎠
(Vetri e polimeri sopra la Tg)
6
Transport equations
x = 0.0
x = 0.1
x = 0.2
x = 0.3
x = 0.4
x = 0.5
0
• Arrhenius
-1
ln σT (S cm K)
⎛ E ⎞
σ (T ) = σ 0 exp⎜ − a ⎟
⎝ kT ⎠
-2
-4
-6
-8
(Glasses and polymers below Tg; local hopping)
-10
-12
3
4
5
1000/T (K-1)
• Vogel-Tammann-Fulcher (VTF)
⎛
B ⎞
⎟⎟
σ (T ) = σ 0 exp⎜⎜ −
⎝ T − T0 ⎠
(glasses and polymers above Tg; free volume,
chain-assisted motion)
6
Un esempio: elettrolita polimerico con
liquido ionico
N
+
(CF3SO2)2N-
OMe
+ Li(CF3SO2)2
N-etil(metileter)-N-metil pirrolidinio bis-trifluorometansulfonimide
*
H
C CF2
CF2
CF2
CF3
n
*
Polivinilidene fluoruro-co-esafluoropropilene
(PVdF-HFP)
Proprietà del sistema liquido ionico –
sale di litio
Tg
X = mol kg-1
(1-X) PYRA_OMe - X LiTFSI
10-2
Heat Flow (a.u.)
PYRA12O1
σ (S cm-1)
10-3
10-4
1.0 W g-1
Endo
X=0
X=0.15
X=0.7
10-5
2.8
m=0.41 mol Kg-1
-100
-50
0
T (°C)
3.0
3.2
3.4
3.6
3
-1
10 /T (K )
Andamento VTF
3.8
4.0
4.2
50
100
Proprietà dell’elettrolita polimerico
0% SiO2
5% Hi-SiL
10%Hi-SiL
15%Hi-Sil
σ(S cm-1)
10-3
10-4
10-5
Microimmagine di
microscopia elettronica a
scansione (SEM)
(a)
10-6
3.0
3.2
3.4
3.6
3.8
4.0
1000/T(K-1)
Conduttività al variare del contenuto di
silice inorganica (filler)