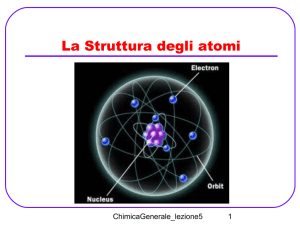
La Mole
Le dimensioni e il peso di un atomo sono
infinitamente piccoli e quindi qualunque peso di
un elemento o molecola ne contiene un numero
enorme.
Si rende necessario una unità di misura
conveniente per descrivere un tale numero di
atomi o molecole.
L’unita SI per il numero di oggetti è la Mole
ChimicaGenerale_lezione2
1
Mole e Numero di Avocadro
La Mole è definita come la quantità di sostanza
contenente tante parti (atomi, molecole o altre
particelle) quanti sono gli atomi contenuti in 0.012 Kg
esatti di carbonio 12 puro.
Questo numero ha un valore di 6.0221415 x 1023 ed è
chiamato numero di Avogadro.
La massa di una mole di atomi di un elemento puro
espressa in grammi è numericamente uguale al peso
atomico di quell’elemento espresso in unità di massa
atomiche.
ChimicaGenerale_lezione2
2
Peso Formula e Peso Molecolare
Il peso formula (PF), espresso in unità di massa
atomiche, di una sostanza è dato da alla somma
dei pesi atomici degli elementi presenti ognuno
moltiplicato per il numero di volte in cui l’elemento
appare nella formula.
ChimicaGenerale_lezione2
3
Peso Molecolare
ll termine “peso formula“ è usato sia per
le sostanze ioniche che quelle molecolari.
Quando si hanno specie che esistono in
forma di molecole distinte si usa il
termine peso molecolare.
ChimicaGenerale_lezione2
4
Esempi numerici
Calcolare il peso formula del Na2 CO3:
PANa 23.0 uma
PAC 12.0 uma
PAO 16.0 uma
PF = 23.0x2 + 12.0 + 16.0x3 = 106 uma
ChimicaGenerale_lezione2
5
Conversioni
Moli x massa molare= grammi
grammi/massa molare= moli
dove per massa molare si intende
PF o PM espresso in g/mol
ChimicaGenerale_lezione2
6
ChimicaGenerale_lezione2
7
Esempi
0.35 mol di alluminio a quanti grammi
corrispondono?
0.35 mol x 27.0 g/mol = 9.5 g
95.35 g di ferro a quante moli corrispondono?
95.35 g / 55.85 g/mol= 1,707 mol
ChimicaGenerale_lezione2
8
Esempio
Ho 16.5g di acido ossalico, H2C2O4
A quante moli corrisponde il campione?
Quante molecole di acido sono presenti?
Quanti atomi C?
Qual'è la massa di 1 molecola di acido ossalico?
ChimicaGenerale_lezione2
9
Risposte
2mol H per mol H2C2O4 (2 x 1.008 g/mol) = 2.016 g H per mol H2C2O4
2mol C per mol H2C2O4 (2 x 12.01 g/mol) = 24.02 g C per mol H2C2O4
4mol O per mol H2C2O4 (4 x 16.00 g/mol) = 64.00 g O per mol H2C2O4
PM= (2.016+24.02+64.00) = 90.04 g/mol
Moli= g/PM=16.5 g / 90.0 g/mol = 0.183 mol di H2C2O4
N°molecole = moli /n°avocadro = 0.183 mol / (6.022x1023 molecole/mol) =
1.10 x1023 molecole
N°atomi C= N°molecole x 2= (1.10 x1023 molecole)x (2 atomi C/molecola)=
2.20 x1023 atomi C
Massa di una molecola= PM/n°avocadro= (90.04 g/mol)/(6.0221 x 1023
molecole/mol) = 1.495 x10-22 g/molecola
ChimicaGenerale_lezione2
10
REAZIONI CHIMICHE
Una reazione chimica
è una trasformazione della materia
che avviene senza variazioni misurabili di
massa, in cui uno o più reagenti iniziali
modificano la loro struttura e composizione
originaria per generare i prodotti.
ChimicaGenerale_lezione3
11
Esempi di processi in cui
intervengono reazioni chimiche
corrosione del ferro a ruggine (che è composta da
ossidi di ferro);
combustione del metano o altri combustibili (il
metano con l'ossigeno si trasforma in anidride
carbonica e vapore acqueo);
digestione (gli alimenti sono decomposti dai succhi
gastrici in sostanze chimiche assimilabili
dall'organismo)
ChimicaGenerale_lezione3
12
Premesse
Le reazioni chimiche non provocano un cambiamento di
natura della materia, perché:
non influenzano i suoi costituenti fondamentali (gli atomi)
ma solo la maniera in cui sono aggregati in molecole;
non influenzano nemmeno l'aggregazione di molecole
simili→ quindi le trasformazioni puramente fisiche, come i
cambiamenti di stato, l'usura e l'erosione, la frattura, ecc.
non sono reazioni chimiche.
Allo stesso modo, non fanno parte delle reazioni chimiche le
trasformazioni dei nuclei atomici, cioè le reazioni nucleari, che vengono
studiate dalla chimica nucleare.
ChimicaGenerale_lezione3
13
Le Reazioni chimiche
riguardano esclusivamente
le variazioni dei legami tra gli atomi
(legame covalente, legame ionico,
legame metallico).
ChimicaGenerale_lezione3
14
Reazioni e Calore
Una reazione può sviluppare calore, in
tal caso è detta esotermica, o
assorbire calore, ed essere quindi
endotermica.
ChimicaGenerale_lezione3
15
Reazioni
Esotermiche o Endotermiche
Una reazione esotermica è una reazione
che comporta un trasferimento di calore dal
sistema all'ambiente.
Una reazione endotermica è una reazione
che comporta un trasferimento di calore
dall'ambiente al sistema. Necessita dunque di
energia esterna per procedere.
ChimicaGenerale_lezione3
16
Reagenti e prodotti
I composti chimici presenti all'inizio della reazione sono
detti reagenti, quelli che si ottengono alla fine della
reazione sono invece i prodotti di reazione.
Una reazione non può avere luogo, o viene rallentata
fino a fermarsi o addirittura a regredire se non è
soddisfatta una serie di condizioni, come presenza dei
reagenti in misura adeguata e condizioni di
temperatura, pressione e luce, adatte alla specifica
reazione.
ChimicaGenerale_lezione3
17
Equazione Chimica
I fenomeni che hanno luogo durante una
reazione chimica vengono rappresentati
mediante una equazione chimica.
Un'equazione chimica è scritta in maniera
simile ad un'equazione matematica, ed in
essa compaiono due membri
ChimicaGenerale_lezione3
18
Reagenti e prodotti
al primo membro (cioè a sinistra della freccia o altro
simbolo di reazione) compaiono i reagenti,
al secondo membro (cioè a destra della freccia o altro
simbolo di reazione) stanno i prodotti.
si specifica per ogni composto lo stato fisico (s), (l) o (g)
tra parentesi
ChimicaGenerale_lezione3
19
Bilanciamento delle masse
Dal postulato fondamentale di Lavoisier,
nulla si crea, nulla si distrugge, tutto si trasforma,
ne deriva necessariamente che la somma delle masse
dei reagenti è uguale alla somma delle masse dei
prodotti di reazione.
Siccome la materia è costituita da atomi,
il numero degli atomi a destra e a sinistra
dell'equazione deve restare invariato.
ChimicaGenerale_lezione3
20
Stechiometria
Per avere ugual numero di atomi a destra e a
sinistra dell'equazione chimica si fa uso dei
“coefficienti stechiometrici”
La relazione tra quantità di prodotti e
reagenti in una reazione chimica è
chiamata “stechiometria”
ChimicaGenerale_lezione3
21
ChimicaGenerale_lezione3
22
Esempio: combustione del
propano
C3H8(g) +O2(g) → CO2(g) + H2O(l)
eq. non bilanciata
Stadio1.
Bilanciare gli atomi di C (scelgo di partire dall'elemento presente in un
solo prodotto quando possibile)
3 atomi di C tra i reagenti→servono 3 atomi di C tra i prodotti quindi → 3CO2
Stadio2.
Bilanciare gli atomi di H
Tra reagenti ho 8 atomi di H, quindi ne servono 8 tra i prodotti, ma l'acqua ne ha 2 → 4 H2O
Stadio3.
Bilanciare gli atomi di O
Nei reagenti ho 2 atomi di O, ma nei prodotti sono vincolato ad avere 4H2O e 3CO2, ovvero
4+6=10 atomi di O → nei reagenti avrò 5O2
Stadio4.
Verifica del bilanciamento di atomi di ciascun elemento
C3H8(g) + 5O2(g) → 3CO2(g) + 4H2O(l)
ChimicaGenerale_lezione3
eq. bilanciata
23
Equilibrio chimico
Le reazioni chimiche possono essere
reversibili o irreversibili.
Nella maggior parte dei casi le reazioni
chimiche sono trasformazioni reversibili
e si ha un equilibrio dinamico tra
formazione dei prodotti e riconversione
in reagenti
Questo sistema in equilibrio dinamico
viene indicato usando una doppia freccia
ChimicaGenerale_lezione3
24
Reversibilità
Per alcune reazioni il guadagno di energia
avuto formando i prodotti è minimo, e
perciò è possibile anche la reazione inversa
Es.: 2H2O ⇌ H3O++OHIn questi casi il sistema evolve in generale verso un equilibrio
dinamico, ossia il numero di molecole che reagiscono in un senso è
compensato dal numero di molecole che reagiscono nell'altro.
ChimicaGenerale_lezione3
25
Formazione di ammoniaca in
fase gassosa
ChimicaGenerale_lezione3
26
Stalattiti e stalagmiti
Sono costituite da CaCO3
Se l'acqua che scorre attraverso il calcare contiene CO 2
disciolta si avrà la dissoluzione del minerale e formazione della
soluzione acquosa di Ca(HCO3)2
CaCO3 (s)+ CO2(aq) + H2O (l) → Ca(HCO3)2 (aq)
Se nella grotta arriva acqua ricca di minerale accade l'inverso:
si sviluppa CO2(g) e si deposita CaCO3 (s)
Ca(HCO3)2 (aq)
→
CaCO3(s) + CO2(g) + H2O(l)
ChimicaGenerale_lezione3
27
ChimicaGenerale_lezione3
28
ChimicaGenerale_lezione3
29
Bilanciamento delle cariche
Oltre al bilanciamento delle masse, nelle
equazioni chimiche deve essere
soddisfatto il bilanciamento delle cariche.
Le reazioni chimiche infatti possono
avvenire anche tra specie chimiche
cariche elettricamente, gli ioni.
ChimicaGenerale_lezione3
30
Esempio. Autoionizzazione
dell'acqua
2H2O ⇌ H3O++OHConsiderando i coefficienti stechiometrici, il bilancio
delle cariche in questo caso può essere scritto come:
2×(0) = (+1) + (-1)
ovvero:
0=0
Per cui si ha l'uguaglianza della somma delle cariche
che competono ai reagenti rispetto alla somma delle
cariche che competono ai prodotti, come deve essere.
ChimicaGenerale_lezione3
31
Reazioni e stati della materia
Un altro parametro importante è la fase in
cui si trovano i reagenti.
Da questo punto di vista le reazioni
maggiormente favorite sono quelle in
fase gassosa o liquida, dove i reagenti
sono mescolati tra loro e possono
facilmente venire a contatto
(reazioni in fase omogenea)
ChimicaGenerale_lezione3
32
Reazioni e stati della materia
In tutti gli altri casi, cioè per reazioni tra:
un solido e un gas;
un solido e un liquido;
un solido e un solido;
un liquido e un gas;
due liquidi immiscibili;
(reazioni in fase eterogenea), la reazione può aver
luogo esclusivamente nei punti di contatto tra le due
fasi, quindi sarà più veloce se i reagenti vengono
dispersi l'uno nell'altro
ChimicaGenerale_lezione3
33
Reazioni in soluzione
Soluzione: miscela omogenea di 2 o
più sostanze
il solvente è il mezzo in cui è sciolta
l'altra sostanza il soluto
ChimicaGenerale_lezione3
34
Alcune tipi di reazioni comuni
Reazioni di precipitazione
Reazioni acido-base
Reazioni che sviluppano gas
Reazioni di ossidoriduzione
ChimicaGenerale_lezione3
35
L'acqua
La molecola d'acqua
presenta un
estremità
parzialmente carica
negativamente
(atomo O) e un'altra
carica positivamente
(atomi H)
δ
−
δ
δ
+
ChimicaGenerale_lezione3
36
+
Il solvente acqua
La polarità dell'acqua le consente di
interagire si con cationi che con
anioni, perciò è un ottimo solvente
per i composti ionici
Gli ioni circondati da molecole di
acqua sono liberi di muoversi in
soluzione
ChimicaGenerale_lezione3
37
Elettroliti e non elettroliti
Tutti i composti ionici solubili in acqua sono
elettroliti ovvero sono capaci di condurre
corrente elettrica
La maggior parte di composti molecolari
che si sciolgono in acqua sono non
elettroliti
ChimicaGenerale_lezione3
38
Solubilità
Composti ionici solubili in acqua:
sali di Na+, K+, NH4+
Sali di nitrati clorati, perclorati, acetati
Alogenuri(eccezioni con Ag+, Hg2+2, Pb2+)
solfati(Ca2+, Sr2+, Ba2+, Pb2+, Ag+)
Composti ionici insolubili in acqua:
Carbonati, fosfati,ossalati, cromati, solfuri (cationi di metalli
alcalini, sali di NH4+)
Ossidi e idrossidi di metalli (idrossidi di metalli alcalini)
ChimicaGenerale_lezione3
39
Precipitazione
Una reazione di precipitazione produce un
composto insolubile in acqua chiamato precipitato
I reagenti sono di solito composti ionici solubili in
acqua , una volta sciolti si dissociano in ioni ,
cationi e anioni
La precipitazione avviene se il catione di un
composto e l'anione di un altro si incontrano e
formano un composto insolubile (reazione di
scambio)
ChimicaGenerale_lezione3
40
AgNO3(aq) + KCl(aq) → AgCl(s) + KNO3(aq)
ChimicaGenerale_lezione3
41
Reazioni Ioniche
complete e nette
Equazione ionica completa
Ag+(aq) +NO-3(aq) + K+(aq) + Cl-(aq) → AgCl(s)
+ K+(aq) + NO-3(aq)
Equazione ionica netta
Ag+(aq) + Cl-(aq) → AgCl(s)
ChimicaGenerale_lezione3
42
Reazioni acido-base
Reazioni che coinvolgono
un acido e una base
La definizione di questi due concetti, acido e
base, è diversa a seconda della teoria
utilizzata per definire e modellizzare questo
tipo di reazione.
ChimicaGenerale_lezione3
43
Teoria di Arrhenius
Acido: sostanza che sciolta in acqua ne
aumenta la concentrazione di ioni idrogeno H+
Base: sostanza che sciolta in acqua ne
aumenta la concentrazione di OH
acido+ base → sale +acqua
HCl + NaOH → NaCl+ H2O
ChimicaGenerale_lezione3
44
Reazioni acido base in acqua
Acido+base → sale +acqua
es.
HCl+NaOH → NaCl+H2O
Ossido di non metallo +acqua → acido
es. CO2+H2O → H2CO3
Ossidi di metalli + acqua → idrossido
es. CaO+H2O → Ca(OH)2
ChimicaGenerale_lezione3
45
ChimicaGenerale_lezione3
46
Reazioni che sviluppano gas
ChimicaGenerale_lezione3
47
Reazioni che sviluppano gas
ESEMPIO: reazione tra bicarbonato di sodio e acido
acetico, con produzione di acetato di sodio
CH3COOH + NaHCO3 ⇄ CH3COONa + H2O + CO2
ESEMPIO: campione di acido
cloridrico (HCl) che rilascia
vapori che reagiscono con
vapori di ammoniaca (NH3),
producendo un fumo bianco di
cloruro d'ammonio (NH4)Cl
ChimicaGenerale_lezione3
48
CaCO3+CH3COOH
ChimicaGenerale_lezione3
49
Reazioni redox
Una reazione viene detta di ossidoriduzione (o redox) se durante il suo
svolgimento alcune specie chimiche
modificano il proprio numero di
ossidazione
ChimicaGenerale_lezione3
50
Redox
Il termine redox è composto da due distinti processi,
una riduzione (reduction) e una ossidazione (oxidation).
Ossidazione: descrive la perdita di elettroni da una
molecola, atomo o ione e quindi aumenta il suo
numero di ossidazione.
Riduzione: descrive l'acquisizione di elettroni da una
molecola, atomo o ione e quindi diminuisce il suo
numero di ossidazione.
ChimicaGenerale_lezione3
51
Trasferimento di elettroni
Riduzione
Ossidante + e- → prodotto
(la specie guadagna elettroni, il suo numero
di ossidazione diminuisce)
Ossidazione
Riducente → prodotto + e(la specie perde elettroni, il suo numero di
ossidazione aumenta)
ChimicaGenerale_lezione3
52
Pile
Se i reagenti vengono
mantenuti opportunamente
separati e posti in contatto
solo tramite materiali
conduttori, allora è possibile
intercettare il flusso di
elettroni e sfruttarlo per
produrre una corrente
elettrica continua il cui
potenziale dipende dalla
reazione tra i reagenti stessi.
ChimicaGenerale_lezione3
53
Redox spontanee e forzate
Una reazione di ossidoriduzione può
avvenire spontaneamente o essere
forzata in senso inverso tramite
l'applicazione di una corrente elettrica
continua di opportuno potenziale. Questo
fenomeno è ampiamente sfruttato nelle
pile ricaricabili e nelle batterie per
autotrazione - che fungono da
accumulatori di energia elettrica sotto
forma di energia chimica - nonché
nell'elettrolisi delle sostanze.
ChimicaGenerale_lezione3
54
Redox in processi biochimici
Le reazioni di
ossidoriduzione sono
estremamente diffuse, sia
nella produzione di composti
chimici che nell'analisi
chimica, nonché alla base di
moltissimi processi
biochimici essenziali alla
vita: un esempio è la
respirazione.
ChimicaGenerale_lezione3
55
La redox tra
etanolo e
dicromato è alla
base del test
usata nell'analisi
dell'alito
ChimicaGenerale_lezione3
56
ChimicaGenerale_lezione3
57
Numeri di ossidazione
Conoscere i numeri di ossidazione degli elementi dei
composti coinvolti in una reazione consente di distinguere
le reazioni di ossido-riduzione (redox) dalle normali reazioni
di scambio: nelle prime i numeri di ossidazione degli
elementi cambiano, nelle seconde no.
Il numero o stato di ossidazione di un
elemento chimico in un composto è definito
come il numero di elettroni ceduti o acquisiti
virtualmente durante la formazione di un
altro composto.
ChimicaGenerale_lezione3
58
Quando due atomi vengono uniti da un legame,
gli elettroni si considerano virtualmente
acquisiti da quello a maggiore elettronegatività.
La somma algebrica dei numeri di ossidazione
è 0 per una molecola neutra o coincide con la
carica complessiva totale nel caso di uno ione.
ChimicaGenerale_lezione3
59
Bilanciamento con metodo
ionico-elettronico
scrivere i numeri di ossidazione delle specie chimiche per individuare chi si
ossida e chi si riduce;
dissociare le sostanze elettroliti e prenderle in considerazione così come
realmente si trovano in soluzione;
bilanciare la valenza dell'elemento mediante l'aggiunta di elettroni;
bilanciare la carica dello ione mediante l'aggiunta di ioni H+ (se si è in ambiente
acido) oppure di OH- (se si è in ambiente basico);
bilanciare la massa degli idrogeni con l'aggiunta di H2O;
moltiplicare le reazioni di ossidazione per il numero di elettroni della riduzione e
viceversa;
sommare le due semireazioni facendo il minimo comune multiplo degli elettroni in
modo che possano essere semplificati dal calcolo;
se necessario, effettuare il bilanciamento degli ossigeni.
ChimicaGenerale_lezione3
60