Endocrinologia 3 novembre 2006 h8:00-11:00
Prof. Pontecorvi
Oggi vediamo la patologia ipofisarie e parliamo dell’ iperprolattinemia. Vi ricordo che la
prolattina (PRL) è un polipeptide di 198 aa, con un’ emivita di circa mezzora ed è
sintetizzato dalle cellule acidofile eosinofile che costituiscono probabilmente la popolazione
più abbondante a livello dell’ ipofisi anteriore. Viene prodotta da un precursore, di grosso
peso molecolare (circa il doppio), che è la pre-PRL che viene scissa enzimaticamente e si
stacca il peptide di 198 aa. Il gene della PRL è situato sul cromosoma 6. Anche la PRL è
sotto il controllo del Pit-1.
Poiché la PRL è una grossa proteina, non potrà superare la membrana plasmatica e il
recettore della PRL si troverà situato sulle cellule bersaglio a livello della membrana
plasmatica. Le cellule bersaglio della PRL sono le cellule della mammella che producono il
latte sull’ epitelio mammario anche se la PRL ha tante altre funzioni, ad esempio la
regolazione della ?????????. La principale funzione nell’ uomo, quella che noi conosciamo,
è lo stimolo della suzione ed è uno stimolo che fisiologicamente avviene dopo l’
espletamento della gravidanza. Durante la gravidanza, insieme a tanti altri ormoni
(estrogeni, progesterone, insulina, l’ ormone lattogeno placentare –che è una proteina
prodotta dalla placenta e che quindi normalmente non esiste se non nella gravidanza-),la
PRL concorre alla preparazione della ghiandola mammaria, cioè comportano uno sviluppo
notevole della struttura della gh mammaria. Durante il puerperio, a seguito della caduta
degli estrogeni e soprattutto grazie allo stimolo nervoso suscitato dalla suzione del
capezzolo da parte del neonato, la PRL viene fortemente stimolata e induce la sintesi delle
proteine del latte, soprattutto della lattoalbumina, che vengono poi rimpiazzate (?) dalle
gh mammarie degli acini della struttura della mammella e attraverso i dotti fuoriescono. L’
altro ormone che coopera con la PRL nel causare la fuoriuscita del latte è l’ ossitocina,
secreto dall’ ipofisi posteriore, che fa contrarre le piccole fibre muscolari lisce che sono
intorno ai dotti mammari più grandi e consente quindi al latte di progredire fino alla
fuoriuscita dai dotti maggiori.
Come dicevamo la PRL può avere altri effetti: alcuni gli attribuiscono effetti
comportamentali, altri effetti regolativi sulla funzione del sistema immunitario. Ci sono
molti studi su animali che dimostrerebbero come la PRL sia un ormone della longevità. Per
quanto riguarda la regolazione, il fattore principale coinvolto è la dopamina prodotta a
livello ipotalamico (la PRL è l’unico ormone prodotto dall’ ipofisi anteriore ad essere
regolato negativamente dall ‘ ipotalamo). Anche la PRL ha un suo ritmo circadiano ed è
regolata dal fattore trascrizionale Pit-1 come anche è per il GH. Alcuni ormoni, come il TRH
hanno funzione di stimolo anche sulla PRL anche se è il principale fattore di stimolo del
tireotropo. La regolazione maggiore è di tipo inibitorio. Un altro fattore capace di stimolare
la PRL sono gli estrogeni stessi.
Quando parliamo di iperprolattinemie dobbiamo distinguerle dai prolattinomi veri e propri.
Nelle iperPRLemie vi è un aumento dei livelli plasmatici circolanti della PRL ma è molto
frequente. Il PRLoma invece è un po’ più raro e non tutte le iperPRLemie sono causate da
adenomi ipofisari secernenti la PRL. Vedete che si può riscontrare in circa un terzo delle
donne con disordini del ciclo mestruale. I PRLomi prevalgono nella popolazione generale in
circa 100 casi ogni milione di abitanti e sono molto più frequentemente microadenomi che
macroadenomi (questo soprattutto nelle donne dove i microadenomi tendono a prevalere
circa 20 volte di più che nel maschio, mentre i macroadenomi superiori a 1 cm prevalgono
in misura uguale sia nelle donne che nei maschi). L’ età media della diagnosi è più bassa
nel caso di microadenomi ed è spesso, questa iperPRLemia, causa di infertilità mentre
invece i macroadenomi si riscontrano una o due decadi dopo (se ci pensate, il
macroadenoma non è altro che un microadenoma che non è stato diagnosticato durante
la crescita). Sono i tumori ipofisari benigni più frequenti. Sono rarissimi i casi di carcinomi.
Gli unici carcinomi dell’ ipofisi sono i PRLomi e i tumori secernenti ACTH. Dicevamo le
iperPRLemie sono molto frequenti,i PRLomi molto rari quindi se noi riscontriamo in una
donna livelli elevati di PRL non dobbiamo subito pensare che abbia un tumore dell’
ipofisi. Quali sono le cause di iperPRLemia? Sono cause fisiologiche e soprattutto cause
farmacologiche. Bisogna fare prima una buona anamnesi. Quali sono le cause fisiologiche?
Il sonno (la PRL aumenta durante la notte), lo stress.. tipicamente la PRL si fa dosare in
tre distinti prelievi, distanti 15-20 min l’uno dall’altro, quindi a 0, 20 e 40 min e si fa poi
una media dei tre prelievi (il primo prelievo avrà una PRL più alta..basta la semplice
puntura della vena a far aumentare la PRL), rapporti sessuali, in gravidanza per preparare
la mammella alla lattazione, suzione del capezzolo da parte del neonato, nei neonati
durante il periodo neonatale (non è infrequente riscontrare la perdita di liquido dal seno
dei neonati, cosa che fa preoccupare moltissimo le mamme ma che in realtà è una cosa
fisiologica). Ancora più importanti sono le cause farmacologiche: farmaci antidopaminergici, bloccando la dopamina, rimuovono l’ inibizione dell’ ipotalamo sull’ ipofisi e
fanno aumentare la PRL. La maggior parte di questi sono farmaci che vengono usati in
psichiatria e altri che vengono usati per indurre la motilità del sistema gastro-enterico. Poi
ci sono gli oppioidi, gli inibitori dei recettori H2 dell’ istamina che sono tutti farmaci antiulcera gastrica e anche gli estrogeni (in genere ad alte dosi –soprattutto questo accadeva
con le vecchie formulazioni di anticoncezionali orali con una concentraz di estrogeni tra i
30 e i 50 microgrammi..oggi la maggior parte degli estroprogestinici hanno un contenuto
intorno a 20 microgrammi-).
Poi ci sono la serie di iperPRLemie secondarie. Sono causate da lesione ipotalamiche o
lesioni del peduncolo ipofisario, possono essere per esempio tumori del cervello che si
estendono a quel livello, traumi che determinano una sindrome da disconnessione dell’
ipotalamo dall’ ipofisi. Poi ci sono i veri e propri tumori ipofisari, tumori che possono
secernere direttamente la PRL. Ci possono essere degli adenomi misti, che secernono sia il
GH che la PRL e che non si sa se nascano da cells miste ab inizio o se, nel corso delle
differenziazione, la cell acquisisce la capacità di secernere anche un secondo ormone; poi
macroadenomi che si espandono verso l’alto comprimendo il peduncolo ipotalamoipofisario e poi, ne parleremo in seguito brevemente, la sindrome della sella vuota che non
è altro che un’erniazione dello spazio subaracnoideo all’ interno dell’ ipofisi con
schiacciamento dell’ ipofisi e del peduncolo ipofisario e si chiama sella vuota perché alla
RMN non si vede il tessuto opaco.
Poi ci possono essere altre cause. La più importante di tutte è l’ipotiroidismo che crea una
diminuzione degli ormoni tiroidei prodotti dalla tiroide e determina per feddback negativo
un aumento del TSH e del TRH e quest aumento del TRH stimola la PRL; la sindrome
dell’ ovaio policistico; lesioni toraciche (per attivazioni di nervi afferenti, gli stessi che
vengono stimolati dalla suzione del capezzolo); insufficienza renale; cirrosi epatica e molto
raramente come sindrome paraneoplastica, se qualche tumore di origine neuroendocrina si
mette a secernere dei fattori capaci di stimolare la PRL.
Infine le iperPRLemie idiopatiche (di cui non si conosce la causa). E’ sicuramente la
causa più frequente ed è una diagnosi di esclusione, cioè una volta che noi abbiamo fatto
l’ anamnesi farmacologia, escluso che non ci siano problemi di stress, che non ci sia
ipotiroidismo né che assuma la pillola e così via..escluso con la RMN la presenza di
adenoma ipofisario, se la PRL rimane alta la chiamiamo idiopatica.
Che cosa fa quest aumento della PRL: da problemi?
Sovente non da nessun problema. Allora se non c’è il PRLoma, se non ci sono altre cause,
cioè se è una forma idiopatica che non da problemi, non importa..la seguiamo ma non la
trattiamo sicuramente. In molti casi però la PRL può dare disturbi. Per esempio nella
donna può dare disturbi a due livelli: a livello ipotalamico e a livello ovario. A livello
ipotalamico disturba la ritmicità di secrezione del GnRH e quindi dell’ LH e dell’ FSH, cioè
disturba quel sistema che abbiamo visto essere fondamentale per la giusta maturazione
dei follicoli e l’ avvento dell’ ovulazione; riduce la pulsatilità dell’ LH e poi del GnRH;
abolisce il feedback positivo estrogenico sull’ LH che si ha nella fase di mezzo ciclo,
quando si ha il picco di LH e quindi,diciamo, disturba a livello centrale i meccanismi
gonadotropicini che regolano l’ ovulazione. Ma ha anche un effetto periferico, prettamente
ovarico: inibisce la secrezione degli estrogeni e del progesterone, quindi può essere causa
di ipogonadismo diretto o indiretto attraverso l’alterazione delle gonadotropine; blocca la
maturazione del follicolo ovario e ne conseguono cicli anovulatori e quindi disturbi
mestruali e soprattutto sterilità. Quindi è sicuramente una causa importante di infertilità
nella donna.
Nell’uomo esercita un effetto soprattutto anti-androgenico: determina una riduzione della
secrezione di testosterone sia diretta sia indiretta (mediata dalla riduzione dell’ LH) e
inibisce
anche
la
conversione
periferica
del
testosterone
in
5αDHT
(5alfadiidrotestosterone), che è l’ormone attivo (mentre il testosterone è il precursore).
Ne consegue quindi che, a causa di questi disturbi fisiopatologici, il QUADRO CLINICO
delle iperPRLemie nella donna sarà caratterizzato da:
1)alterazioni del ciclo mestruale
- oligomenorrea (cicli allungati nel ritmo. Un ciclo normale è considerato di 28 +/7gg…)
- amenorrea (assenza di cicli per almeno 6 mesi)
- polimenorrea (rara) [cicli che durano meno di 21 gg]
- accorciamento della fase luteinica
- infertilità
2) galattorrea, cioè la fuoriuscita di liquido biancastro (latte) dal capezzolo e questo può
avvenire tra il 30 e 80% dei casi. Ci può essere galattorrea senza avere disturbi mestruali,
ci possono essere disturbi mestruali senza galattorrea, più frequentemente ci sono tutti e
due, tant’è che si parla della Sindrome amenorrea-galattorrea che è la tipica sindrome
causata da aumenti importanti della PRL.
3) ipoestrogenismo
- osteopeniaosteoporosi
Nell’ uomo ci saranno disturbi soprattutto della sfera sessuale:
- perdita della libido
- disfunzione erettile
- riduzione del volume dell’eiaculato
- oligospermia (raramente)
- in genere non ci sono problemi di infertilità
Entrambi i sessi:
- sintomi da macroadenoma (se presente)
LABORATORIO
Qual’ è la concentrazione plasmatica della PRL?
- donna: <20ng/ml
- uomo: <15ng/ml
Valori superiori a 200 ng/ml sicuramente vi dicono che c’è un tumore ipofisario PRL
secernente. Per i valori tra 20 e 200 ng/ml ci possiamo trovare di fronte o a un PRLoma in
genere di piccole dimensioni o a una iperPRLemia secondaria o funzionale e dobbiamo fare
tutta la diagnosi differenziale. Un tempo si facevano prove dinamiche con ??? ma sono
assolutamente da scartare quindi non le fate.
Abbiamo oggi dei metodi diagnostici molto più sensibili, soprattutto la RMN che consente
di vedere tumori anche al di sotto di un mm e quindi non c’è bisogno di fare questi test.
TERAPIA
Nell’ iperPRLemia idiopatica se la PRL non causa disturbi mestruali, se non causa disturbi
della fertilità e se vi da livelli estrogenici normali, non c’è nulla da fare perché non è
importante. Se ci sono uno di questi disturbi associato ovviamente bisogna iniziare una
terapia. La stessa cosa dicasi per i PRLomi. La prima terapia per il PRLoma non è
chirurgica ma è medica. Oggi abbiamo dei farmaci che consentono cono solo di ridurre la
secrezione di PRL ma anche di ridurre il volume del tumore e a volte lo curano.
Paradossalmente la terapia medica è molto più efficace nei macroadenomi che nei
microadenomi. I macroadenomi a volte scompaiono (anche tumori di 2-3 cm) mentre i
microadenomi permangono. La terapia fa uso soprattutto di farmaci dopamino-agonisti. Il
primo che si usava per tanto tempo è la bromocriptina (che è un farmaco che deve essere
somministrato però tutti i giorni più volte al giorno) e oggi invece si usa molto di più la
cabergolina che è un farmaco che ha una lunga emivita tant è che può essere
somministrato 2 volte a settimana ed ha minori effetti collaterali rispetto alla bromocriptina
(ipotensione ortostatica). La chirurgia oggi per i PRLomi è molto rara. La chirurgia per via
transfenoidale viene riservata solo ai casi resistenti ai dopamino-agonisti, oppure può
essere riservata ai casi in cui il PRLoma non regredisce, permane per tanto tempo e alla
lunga si può decidere di intervenire chirurgicamente soprattutto se la posizione del
PRLoma è facile dal punto di vista chirurgico. Per le altre neoplasie ipotalamo-ipofisarie
che causavano iperPRLemie secondarie ovviamente la chirurgia oppure la terapia radiante.
MALATTIE IPOTALAMO-IPOFISARIE NON NEOPLASTICHE
Malformazioni
- anencefalia
- idrocefalo
- sella vuota primitiva
- altre
Sindromi genetiche
- S. Di Kallman (gonadrotropine basse e anosmia)
- S. Lawrence-Moon-Bield
- S. Prader-Willi
Lesioni vascolari
- aneurismi
-
apoplessia ipofisaria
S. Sheehan
Processi infiammatori e granulomatosi
- encefaliti
- ipofisite (linfocitaria)
- sarcoidosi
- istiocitosi x
Disordini metabolici
- emocromatosi, emosiderosi
- amiloidosi
- insuff epatica
- insuff renale
- malnutrizione e/o anoressia nervosa
Gli ipopituitarismi si possono distinguere in:
a) forme idiopatiche
- deficit uni-/politropinico ipofisario e/o ipotalamico. Se manca il GH avremo nel
bambino un nanismo ipofisario, se mancano le gonadotropine avremo un
ipogonadismo centrale, molto rari sono ipotirodismi centrali e possiamo avere un
iposurrenalismo centrale con basso ACTH. Poco si sa sulla sindrome da ipoPRLemia.
- Eccesso di tropine ipofisarie: iperPRLemia idiopatica; inappropriata secrezione di TSH
non neoplastica; pubertà precoce ipotalamica
b) Forme iatrogene
- post chirurgiche (soprattutto se si interviene a carico di grossi adenomi dell’ipofisi)
- terapie radianti ovviamente possono determinare sofferenza delle cellule ipofisarie
- farmaci ormoni tiroidei e steroidei (sono terapie volute)
farmaci citostatici
- iperPRLemie farmaco-indotte
c) Forme psicogene
- anoressia nervosa
- nanismo psicosociale (ritardo di crescita da difetto di secrezione del GH in bambini
che si trovano in condizioni di abbandono dal punto di vista familiare
- amenorrea psicogena
- gravi malattie psichiatriche
d) Traumi cranici. E’ una cosa nuova, venuta fuori da pochi anni. Si è visto che,
conseguentemente a traumi cranici sia nel bambino sia nell’adulto, si possono
sviluppare deficit tropinici ipofisari. Il meccanismo con cui questo si verifica non si
sa e c’è uno studio italiano che sta esaminando molti di questi casi. L’ asse più
frequentemente colpito è quello del GH e …(??)
CLASSIFICAZIONE
1) PANIPOPITUITARISMO
-
compromissione delle secrezione di tutte le tropine ipofisarie. In realtà si
intenderebbe la mancanza degli ormoni sia dell’ipofisi anteriore sia dell’ipofisi
posteriore quindi anche dell’ossitocina e dell’ ADH.
2) IPOPITUITARISMO PARZIALE
- compromissione di una o più tropine e non di tutte (quindi unitropinico o
multitropinico)
EZIOLOGIA (“9 I”)
Cause:
- iatrogeniche
- idiopatiche
- immunologiche,legate soprattutto a forme autoimmuni anche a livello dell’ipofisi
(ipofisiti autoimmuni) e nei siti immunoprivilegiati. Spesso si ritrovano associate a
forme autoimmuni di altre ghiandole endocrine come per es la tiroidite di Hashimoto.
- Infartuali, da apoplessia
- Infettive, encefaliti,sarcoidosi…
- Infiltrative legate alla presenza di tumori in loco
- Invasive sempre legate a forme tumorali anche intraipofisarie
- Isolate, spesso genetiche
- Lesioni traumatiche (“ injury”)
Piccola digressione sulla Sindrome della sella vuota
Qui vedete una sella normale con la tipica iperintensità alla RMN della neuroipofisi e qui
invece vedete (è tutto nero) c’è la sella turcica riempita dalla invaginazione della aracnoide
sovrastante che penetra all’interno e sostituisce l’ipofisi che diventa una mezza luna
schiacciata al di sotto. Nella maggior parte dei casi questa sella vuota funziona
tranquillamente, non da problemi. E’ solo un puro reperto radiologico occasionale, molto
più frequente nei soggetti obesi. In alcuni casi però può dare ipopituitarismo perché lo
schiacciamento dell’ipofisi e quindi la sofferenza del tessuto ipofisario evidentemente è
diventato importante.
Cominciamo a parlare della tiroide quindi cambiamo completamente argomento:
LA TIROIDE
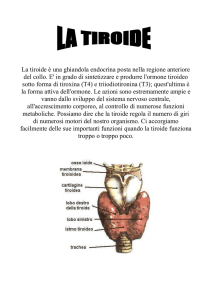
Ghiandola situata alla base del collo quindi non più del SNC, ad di sotto del pomo d’
Adamo, a dx e sin della linea mediana ci sono i due lobi uniti da un istmo. E’ irrorata da
dei rami diretti delle carotidi quindi la pressione del sangue all’ interno della tiroide è molto
elevata. Ci sono le arterie tiroidee superiori e le art tiroidee inferiori che vanno più verso la
parte posteriore e che irrorano anche le 4 paratiroidi (4 ghiandoline situate in genere
posteriormente, 2 al polo apicale, 2 al polo basale a dx e a sn).
Vedete il lobo che va verso dx e quello che va verso sn. Questa protuberanza centrale è il
lobo piramidale che è un residuo embriologico derivato dal fatto che l’abbozzo della tiroide
si forma alla base della lingua e nasce dall’ endoderma. Successivamente queste cellule
scendono verso il basso e migrano fino a raggiungere la posizione definitiva. Durante
questa migrazione possono lasciare cellule lungo il percorso e si possono formare quindi
questi residui. In alcune forme di difetti congeniti della tiroide, questa si può trovare,
anziché in sede, arrestata con la sua posizione più in alto. Una delle forme più tipiche è
proprio a livello della base della lingua.
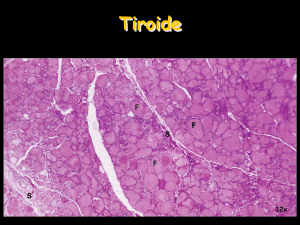
La struttura istologica consiste nei follicoli tiroidei e sono praticamente (immaginate) delle
micropalline circondate da un unico strato di cellule epiteliali che sono le cellule
follicolari tiroidee. All’ interno di queste micropalline c’è un fluido denso, molto simile
alla resina dei pini, che è un materiale proteinaceo chiamato colloide. La colloide non è
altro che al 90 % tireoglobulina, una proteina che è fatta esclusivamente dalle cellule
tiroidee. E’ la proteina su cui si formano gli ormoni tiroidei.
Frequentemente in sezioni istologiche potete trovare delle lacune biancastre: è colloide
che è stata riassorbita per pinocitosi ed è quindi un punto in cui la colloide non c’è.
Oltre alle cellule follicolari, nella tiroide c’è un altro tipo di cellule che si chiamano cellule
C o parafollicolari (da “clear” perché hanno un citoplasma chiaro) che sono delle cellule
di origine neuroendocrina cioè derivano dalle creste neurali e migrano in diverse parti dell’
organismo. Secernono la calcitonina che è un ormone ad attività ipocalcemizzante
coinvolto insieme al paratormone e alla vit D nel metabolismo del calcio e del fosforo.
Come avviene la sintesi e la secrezione degli ormoni tiroidei:
La cellula tiroidea fa due cose completamente diverse ai suoi due poli. C’è un polo
vascolare, cioè la parte rivolta verso l’ esterno del follicolo, quindi verso lo spazio
extracellulare e verso i capillari e ci sarà un versante follicolare che è la parte rivolta invece
verso la cavità. La prima cosa che la tiroide fa è quella di captare e concentrare al suo
interno lo iodio, che come vedremo entra a far parte della struttura degli ormoni tiroidei e
conferisce proprio agli ormoni l’ azione ormonale vera e propria. La captazione avviene
esclusivamente al polo vascolare della cellula, cioè alla porzione rivolta verso l’ esterno ed
è svolta da uno specifico trasportatore: il NIS (Na, I Simporter). Trasporta una molecola di
iodio per due molecole di sodio; è situato a livello della membrana plasmatica del tireocita
e la attraversa completamente. Tramite questo simporter la tiroide è capace di
concentrare al suo interno lo iodio 30-40 volte di più che nel plasma (quindi è un trasporto
contro-gradiente ma siccome viene fatto utilizzando il trasporto di cariche positive non
richiede un diretto apporto di energia).
Il fabbisogno giornaliero di iodio è pari a circa 150 μg/die. Questa è la quantità che
ognuno di noi dovrebbe assorbire ogni giorno e che una volta assorbita circola nel nostro
sangue e quando questo sangue arriva a livello della tiroide, questa lo trasporta e lo
concentra all’ interno fino a 30-40 volte di più.
Il simporter è una molecola molto complessa che attraversa 13 volte la membrana e questi
“capelli” che vedete sono residui carboidratici, quindi è una glicoproteina di membrana.
Questo NIS è regolato per esempio dal TSH che aumenta il num di molecole di NIS
sintetizzate e quindi aumenta la capacità della cellula tiroidea di captare lo iodio.
Una volta che lo iodio è stato captato e concentrato all’ interno, deve essere organificato
quindi da sostanza inorganica, metalloide come lo iodio è, diviene sostanza organica
perché viene attaccato a delle strutture che hanno degli atomi di carbonio e in particolare
viene ad essere attaccato sulla superficie della tireoglobulina a livello dell’ anello fenolico
delle tiroxine. In questo modo si formeranno delle tirosine che possono avere due atomi di
iodio sull’anello fenolico e si chiamerà DI-IODIO-TIROSINA (DIT) oppure se se ne attacca
uno solo si chiamerà MONO-IODIO-TIROSINA (MIT).
In realtà questa organificazione dello iodio si è visto che avviene a livello del versante
follicolare, cioè dalla parte colloidea. Si ritiene che durante il “viaggio” dello iodio ,questo
possa essere trasportato da diverse proteine: una di queste si chiama pendrina. L’
organificazione avviene attraverso una prima fase in cui lo iodio viene assorbito come
ioduro, viene attivato addirittura, si ritiene, a una forma di iodio catione che è molto
capace poi di interagire con le strutture fenoliche della tirosina e questa attivazione e
organificazione viene svolta da un enzima che si chiama TIREOPEROSSIDASI (TPO) che è
unico della tiroide.
La fase successiva, sempre catalizzata dalla TPO, è quella di coupling, cioè di fusione di
queste iodotirosine: succede che nell’ ambito della struttura terziaria della tireoglobulina
due molecole di tirosina vengono ad avvicinarsi, ad essere contigue. Una sarà la tirosina
donatrice (dell’anello fenolico), l’altra sarà la tirosina accettrice e vedete che l’anello
fenolico si stacca dalla tirosina donatrice e si attacca alla tirosina accettrice venendosi a
formare quindi questa nuova molecola che non è altro che derivato dalla fusione di due
tiroxine: questa struttura si chiamerà tetra-iodo-tironina o T4 detta anche tiroxina e
questa nasce quando a fondersi sono due molecole di DIT. Mentre se una delle due è un
MIT (quindi avverrà un MIT + DIT) di formerà la T3 o tri-iodo-tironina. La T3 è
l’ormone attivo perché è quello capace di interagire con il recettore. Ha un’affinità per il
recettore 10 volte superiore a quella della T4 quindi un’attività biologica 10 volte superiore
a quella della T4.
Ne risulta quindi una tireoglobulina che avrà sulla sua superficie molecole di DIT, molecole
di MIT e qualche molecole di T3 e di T4. Ora questo dipende molto dall’apporto di iodio.
Più c’è iodio, più si formano DIT più si formano T4. Meno c’è iodio, più MIT ci sono, più T3
si forma rispetto a T4. Ecco perché nelle aree a carenza iodica la secrezione tiroidea di T3
è più alta rispetto alle tiroidi di un soggetto che vive in aree di appropriato apporto di iodio
e che produce invece molta più T4 che T3. In genere il rapporto fra T4 e T3 ,a livello di
secrezione, è di 5:1 quindi diciamo che la tiroide produce circa 20% di T3 e il resto T4.
La tireoglobulina iodinata viene riversata nella cavità colloidea. Quello che poi succede è
che viene riassorbita per pinocitosi, si ha un’invaginazione della membrana che succhia
questa colloide, si forma l’ endosoma il quale poi si fonde con i lisosomi e gli enzimi
lisosomiali non fanno altro che degradare la tireoglobulina a singoli aminoacidi e qualcuno
di questi singoli aminoacidi saranno MIT, DIT, T3 e T4. I singoli aminoacidi,T3 eT4 che
ormai sono ormoni, vengono riversati dal versante vascolare in circolo che li porterà a
distanza a bagnare le cellule bersaglio.
C’è una molecola simile alla T3 ma che è biologicamente inattiva: è la rT3 (reverse T3) in
cui manca nell’anello interno (mentre nellaT3 manca nell’anello esterno) quindi in questo
caso la tirosina donatrice era una DIT e la accettrice una MIT, ma ,pur essendo simile, il
solo fatto di spostare lo iodio la rende totalmente inattiva.
Mancano solo gli ultimi 15 minuti di lezione perché mi era finita la cassetta..li sto
recuperando e poi vi manderò l’integrazione..
Intanto godetevi questa parte=)
Francesca Priolo