CASO MONGA N° 16
A) REUMATISMO ARTICOLARE ACUTO (febbre reumatica)
E’ una malattia infiammatoria acuta, immunomediata, multiorgano che segue di alcune settimane un episodio
di faringite da streptococco di gruppo A (con antigeni strutturalmente simili ad antigeni umani). Durante la
fase attiva, la cardite reumatica acuta può progredire in una cardiopatia reumatica cronica. Le più importanti
conseguenze del RAA sono le deformazioni croniche valvolari, principalmente caratterizzate da una
valvulopatia fibrosa deformante (in particolare la stenosi mitralica), che comportano una disfunzione
permanente e a distanza di decenni problemi cardiaci severi e talvolta fatali. Il RAA non consegue ad
un’infezione streptococcica in altre sedi, come la cute. L’incidenza e il tasso di mortalità del RAA hanno
subito una progressiva riduzione negli ultimi 30 anni, grazie al miglioramento delle condizioni
socioeconomiche, alla maggiore precocità della diagnosi e del trattamento delle faringiti e ad una riduzione
della virulenza degli streptococchi del gruppo A.
Lesioni cardiache in corso di RAA
Le lesioni possono interessare tutte le parti del cuore (pancardite) generalmente si distinguono le lesioni del
pericardio, del miocardio e dell’ endocardio.
Pericardite reumatica: si verifica durante la fase acuta della malattia e rappresenta un’ importante causa di
versamento pericardio; si presenta come una pericardite siero-fibrinosa.
Miocardite reumatica: è importante nalla fase acuta e può causare la morte per gravi aritmie i insufficienza
cardiaca acuta quando le lesioni interessano il tessuto di conduzione. Il quadro istologico è caratteristico per
la presenza dei noduli di Aschoff (detriti granulari o ialini al centro con grandi cellule di tipo macrofagico
sovente dotate di più nuclei con edema e infiltrazione linfocitaria tra le fibre muscolari ed infiammazione
perivascolare).
Endocardite reumatica: le lesioni macroscopiche si osservano di solito nelle sedi dell’ endocardio
maggiormente soggette a pressione e traumi quindi nel lato sinistro del cuore nei punti di chiusura delle
valvole e in ogni sede in cui il flusso è più intenso. La lesione di base è rappresentata da piccole verruche del
diametro di pochi millimetri le quali si formano per edema del connettivo della valvola su cui la pressione
provoca piccole ulcerazioni seguite da deposito di fibrina e piastrine (soprattutto area di McCallum sulla
parete posteriore dell’ atrio sinistro.
Nella maggior parte dei casi la fase acuta si attenua ed è seguita da guarigione con vari gradi di retrazione.
Tuttavia in un significativo numero di casi non si osserva una vera fase acuta e in un piccolo numero di casi è
presente per lunghi periodi un basso grado di infiammazione cronica.
Presentazione acuta florida:miocardite con vari gradi di insufficienza cardiaca, di solito guarigione per
risoluzione, ma possibile morte oppure pericardite con o senza versamento con guarigione talvolta con
aderenze.
Presentazione acuta ricorrente, a basso grado per lunghi periodi, latente o molto blanda: endocardite
(interessate soprattutto mitrale e aortica), guarigione con retrazione e vizi valvolari.
Nella fase acuta possono essere riscontrate lesioni infiammatorie focali in diversi tessuti. Le più
caratteristiche sono le lesioni cardiache, che vengono chiamate corpi di Aschoff, formate da focolai di
collageno eosinofilo rigonfio circondato do linfociti (soprattutto T), occasionali plasmacellule e macrofagi
gonfi dette cellule di Anitschkow (patognomoniche del RAA). Queste cellule hanno un abbondante
citoplasma e un nucleo centrale, tondo od ovoidale, nel quale la cromatina è disposta centralmente in un
nastro sottile e ondulato (da qui la denominazione “cellule bruco”). Alcuni macrofagi più grandi diventano
multinucleati, formando così le cellule giganti di Aschoff. Durante la fase acuta, l’infiammazione diffusa e i
corpi di Aschoff si possono repertare sia a livello del pericardio che nel miocardio che nell’endocardio
giustificando la denominazione di pancardite. Nel pericardio l’infiammazione si accompagna a un essudato
pericardio fibrinoso o sierofibrinoso descritto come pericardite a “pane e burro”, che generalmente si risolve
senza sequele. A livello miocardio, i corpi di Aschoff si trovano nel tessuto connettivo interstiziale spesso in
sede perivascolare. Il contemporaneo interessamento delle endocardio e delle valvole sinistre da parte delle
lesioni infiammatorie, tipicamente comporta la formazione di foci confluenti di necrosi fibrinoide all’ interno
delle cuspidi o lungo le corde tendinee, ricoperte da piccole vegetazioni friabili (1-2mm) dette verruche
localizzate lungo le linee di chiusura. Queste formazioni sono dovute alla deposizione di fibrina a livello di
erosioni correlate alla flogosi e alla degenerazione del collagene e possono disturbare la funzione cardiaca.
Le lesioni subendocardiche continuamente sollecitate dal reflusso possono dare luogo a ispessimenti
irregolari denominati placche di MacCallum, generalmente localizzate all’ atrio sinistro. La cardite reumatica
cronica è caratterizzata dall’ organizzazione del processo infiammatorio acuto con conseguente fibrosi. In
particolare i lembi valvolari diventano ispessiti e retratti, deformandosi permanentemente. Le alterazioni
fondamentali della valvola mitrale (o tricuspide) sono l’ispessimento dei lembi, la fusione delle commissure
e l’accorciamento, l’ispessimento e la fusione delle corde tendinee. E’ presente una diffusa fibrosi e spesso
una neovascolarizzazione che altera l’ originale assetto stratificato e avascolare dei lembi valvolari. I corpi di
Aschoff vanno incontro a sostituzione fibrosa per cui raramente vengono rilevati nei campioni chirurgici o
autoptici di pazienti con cardite reumatica cronica. Questa è la più frequente causa di stenosi mitralica
(99%). Nel 65-70% dei casi c’è l’interessamento della sola valvola mitralica, mentre nel 25% sia di quella
mitralica che di quella aortica. Forme meno gravi e più rare si riscontrano a livello della tricuspide e della
polmonare. Il tessuto fibroso e le calcificazioni che si formano tra le commissure valvolari danno luogo alle
tipiche stenosi a “bocca di pesce” o ad “asola”. Se la stenosi mitralica è severa l’atrio sinistro
progressivamente si dilata e possono formarsi trombi murali sia nell’auricola che lungo la parete. La
congestione polmonare persistente causa modifiche nel parenchima e nella vascolarizzazione del polmone
portando nel tempo ad un’ipertrofia ventricolare destra. Il ventricolo sinistro è generalmente normale nella
stenosi mitralica pura singola.
Si tratta di una reazione da ipersensibilità (di tipo III) indotta dagli streptococchi di gruppo A. Gli ab diretti
contro la proteina M di alcuni streptococchi cross-reagiscono con gli ag glicoproteici del cuore, delle
articolazioni e degli altri tessuti. L’inizio dei sintomi a distanza di 2-3 settimane dall’infezione e l’assenza
degli streptococcchi dalle lesioni supporta che il RAA sia il risultato di una risposta immunitaria contro i
batteri responsabili. Esiste una predisposizione genetica infatti non tutti i pz infettati sviluppano il RAA. È
caratterizzata da: poliartrite migrante delle grandi articolazioni, cardite, noduli sottocutanei, eritema
marginato della cute e corea di Sydenham (o corea minor detta anche ballo di San Vito: un disordine
neurologico caratterizzato da movimenti involontari rapidi e non finalizzati). La diagnosi si basa sui criteri di
Jones: storia di una precedente infezione da streptococchi di gruppo A associata ad almeno due delle
manifestazioni maggiori o una maggiore e due minori tra febbre, artralgia o livelli elevati di proteine di fase
acuta. La febbre reumatica acuta tipicamente si presenta da 10gg a 6 settimane dopo una faringite acuta da
streptococco di gruppo A nel 3% dei casi. Si manifesta in genere nei bambini di età compresa tra 5 e 15 anni,
ma il 20% circa degli esordi si verifica in età adulta o avanzata. Sebbene i tamponi faringei siano negativi per
lo streptococco all’inizio della malattia gli ab diretti contro uno o più enzimi batterici quali la streptolisina o
e la DNAsi B, possono essere dosabili nel siero della maggior parte dei pz. L’artrite è più comune negli
adulti: una grande articolazione dopo l’altra diventa dolorante e gonfia per alcuni gg, per poi guarire
spontaneamente senza limitazioni funzionali residue. Il processo di base consiste in una infiammazione acuta
non specifica caratterizzata da un essudato ricco di fibrina. Sedi locali di infiammazione: membrane sierose
(pericarditi e talvolta pleuriti), articolazioni e tessuti muscolo-fasciali adiacenti (artriti spesso con
versamenti, dolori e debolezza muscolare), cute (rash cutaneo con eritema marginato, piccoli noduli
sottocutanei palpabili in corrispondenza delle prominenze ossee soggette a pressione costituiti da aggregati di
una lesione fondamentale istologicamente caratteristica, il nodulo reumatico con nucleo centrale di detriti
necrotici, delimitato da macrofagi di forma fusata arrangiati a palizzata. Nel tessuto circostante vi è un’
infiammazione cronica aspecifica), SNC (corea).
Successive complicazioni possibili a carico del cuore
Il quadro clinico correlato alla cardite acuta comprende sfregamenti pericardici, rumori cardiaci deboli,
tachicardia e altre aritmie. La miocardite può essere responsabile di una dilatazione cardiaca che può
evolvere in un’ insufficienza mitralica o anche in uno scompenso cardiaco. La prognosi del primo attacco è
buona, solo l’1% muore. Dopo il primo attacco la vulnerabilità alla riattivazione della malattia è aumentata e
si verificano infezioni faringee ricorrenti. I rischi sono: l’ embolizzazione a partenza dei trombi murali
soprattutto quelli atriali e le endocarditi infettive che attecchiscono sulle valvole deformate. La cardite
reumatica cronica di solito non dà manifestazioni per anni. Oltre ai vari soffi cardiaci alla dilatazione allo
scompenso i pz possono andare incontro ad aritmie (in particolare FA nel contesto di una stenosi mitralica) a
complicanze tromboemboliche e ad endocarditi infettive. In alcuni casi si instaura un circolo vizioso in cui la
valvulopatia produce delle alterazioni emodinamiche che generano ulteriore fibrosi deformante. La prognosi
è nettamente migliorata dalla chirurgia madiante commissurotomia o sostituzione valvolare.
B) STENOSI MITRALICA E COMMISSUROTOMIA
Altre cause di stenosi mitralica
La stenosi mitralica è il più comune effetto della malattia reumatica. È il risultato di diverse componenti dei
processi di guarigione e di cicatrizzazione i quali possono verificarsi separatamente o più facilmente insieme
in varie combinazioni.
Semplice aderenza dei lembi valvolari: si forma un diaframma (situazione trattabile con semplice
separazione chirurgica o commissurotomia, ma si possono verificare recidive).
Stenosi serrata: aderenza e distorsione, ispessimento accorciamento calcificazione dei lembi valvolari e delle
corde tendinee risultanti in una stenosi marcata per cui è indispensabile la sostituzione chirurgica.
La stenosi pura porta a dilatazione o ipertrofia dell’ atrio sx. nella malattia reumatica non è infrequente.
Nei vizi mitralici l’aumentata pressione sanguigna che si esercita nell’ atrio sx viene trasmessa alla vene
polmonari determinando a sua volta un aumento di pressione nel circolo polmonare e quindi effetti sul cuore
dx.
Fase compensata: dilatazione dell’ atrio sx, congestione polmonare, ipertrofia del ventricolo dx.
Scompenso cardiaco congestizio: dilatazione, insufficienza funzionale della tricuspide, congestione venosa
sistemica, ipertrofia ventricolare dx, dilatazione ventricolo dx, dilatazione atrio dx.
Complicazioni dei vizi mitralici cronici: FA, trombosi delle orecchiette, embolizzazione sistemica.
Endocardite infettiva.
Nel 99% dei casi la stenosi mitralica è da cicatrizzazione postinfiammatoria (cardiopatia reumatica). Anche
la calcificazione dell’annulus mitralico può determinare stenosi per la riduzione dell’ apertura dei lembi
valvolari. Si formano dei depositi degenerativi calcifici evidenti microscopicamente come noduli di 2-5mm
di spessore irregolari duri talvolta ulcerati dietro ai lembi valvolari. Le forme congenite di stenosi mitralica
presentano un ampio spettro anatomico legato a ipoplasia o displasia dell’apparato valvolare le forme
estreme possono giungere a quadri di ostruzione completa con atresia mitralica. Un difetto del setto
interatriale di tipo ostium secundum può associarsi a patologia stenotica della valvola mitrale. Tale quadro
viene definito s. di Lutembacher. La s. da carcinoide (più frequentemente interessa la tricuspide) e le
connettiviti sistemiche come la sclerodermia sono cause più rare, così come i trombi atriali o le masse di
natura neoplastica (il mixoma atriale sx che causa soprattutto se peduncolato ostruzione intermittente causata
dal protrudere sincrono con l’attività cardiaca all’interno dell’orifizio valvolare, i fibrosarcomi, gli
endoteliomi e i linfangiomi)
99% malattia reumatica
Congenita
Endocardite infettiva attiva
Processi cicatriziali postinfiammatori
Neoplasie
Calcificazione massiva dell’annulus mitralico (più frequente negli anziani noduli irregolari molto duri sulla
faccia posteriore dei foglietti valvolari possono dare reflusso o stenosi per riduzione apertura lembi
valvolari)
Lupus eritematoso sistemico
Carcinoide
Terapia con metisergide (fc alfa litico scopo profilattico emicrania)
Sindrome di Hunter-Hurler (mucopolisaccaridosi deficit di alcuni enzimi lisosomiali, organomegalia, dolore
blocco articolare, anormalità osse bassa statura macroglossia perdita capelli valvulopatie)
Malattia di Fabry (patologia lisosomiale legata cr X mutazioni gene per alfagalattosidasi accumulo in
particolare di lipidi a livello dell’ endotelio vascolare del cuore; angiocheratomi, ipoidrosi, opacità corneali,
microangiopatia renale cerebrale e cardiaca.)
Malattia di Whipple
Artrite reumatoide
Mixoma atriale sx
Trombo massivo a palla dell’atrio sx
Cor triatriatum (è presente una membrana congenita in atri sinistro)
Valvola mitrale a paracadute
Trisomia 18
Ipertrofia del setto……….
C) GASTRALGIA, BIOPSIA, GASTRITE
Esame istologico delle biopsie gastriche:
esame di materiale ottenuto tramite sonda endoscopica. La fissazione varia a seconda dei tessuti e degli scopi
prefissi. Si ha: inclusione in paraffina (serve a ottenere sezioni di circa 5 micron), allestimento delle sezioni
con colorazioni standard e speciali, diagnosi e refertazione, archiviazione. Il risultato può essere una diagnosi
definitiva o provvisoria che necessita di conferma.
Le colorazioni utilizzate sono l’ematossilina-eosina. Il colorante basico ematossilina colora le strutture acide
di blu violaceo. I nuclei e il reticolo endoplasmatico rugoso hanno un’ alta affinità per il loro contenuto di
DNA e RNA. L’eosina è un colorante acido che colora strutture basiche in rosso o rosa. La maggior parte
delle proteine citoplasmatiche sono basiche perciò il citoplasma si colora in rosa o in rosso rosato. In
generale i nuclei sono blu e il citoplasma rosso o rosa.
Il metodo PAS/EE viene utilizzato per mostrare le cellule secernenti muco che è PAS-positivo perché
contiene polisaccaridi e si colora in magenta. Si tratta di una tecnica di colorazione istochimica perché marca
specificamente componemti delle cellule e dei tessuti.
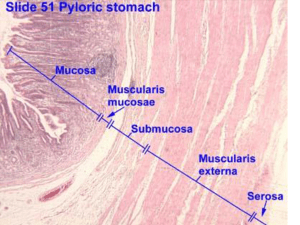
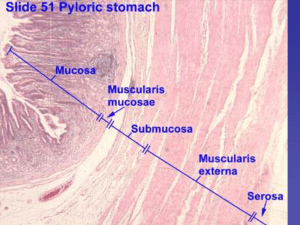
Mucosa gastrica antrale e fundica: la parete gastrica è costituita da una mucosa, una sottomucosa, una tonaca
muscolare propria e una sierosa. La mucosa è costellata da milioni di foveole in cui sboccano le ghiandole.
La normale mucosa ha due compartimenti: il foveolare in superficie e il ghiandolare più in profondità. Il
foveolare è relativamente uniforme in tutto lo stomaco. Il compartimento ghiandolare presenta differenze in
spessore e in costituzione ghiandolare. Il foveolare è costituito da cellule epiteliali di superficie (le cellule
foveolari). Sono cellule alte cilindriche e muco-secernenti, hanno nuclei basali e fitti e minuti granuli chiari
contenenti mucina stipati nella regione sopranucleare. Nelle foveole vi sono le cellule mucose del colletto
con un contenuto più basso di granuli di mucina. Danno origine all’ epitelio di superficie e alle cellule delle
ghiandole. Le mitosi sono molto frequenti e il ricambio epiteliale permette la sostituzione dell’ intera
superficie mucosa dello stomaco ogni 2-6gg. Nel cardias sono presenti cellule mucose, nel fondo cellule
parietali secernenti acido cloridrico e fattore intrinseco e cellule principali secernenti pepsina, così come nel
corpo mentre nell’ antro sono presenti cellule mucose e cellule G secernenti gastrina. Le ghiandole cardiali
contengono solo cellule muco-secernenti, quelle ossintiche (significa che producono acido) dette anche
gastriche o fundiche nel fondo e nel corpo contengono cellule parietali, principali e endocrine. Quelle antrali
o piloriche contengono cellule muco-secernenti e cellule endocrine.queste ultime ghiandole a differenza di
quelle tubulari semplici del fondo e del corpo sono ramificate e le fossette gastriche occupano metà dello
spessore della mucosa.
Gastrite cronica moderata attiva
La gastrite cronica è definita dalla presenza di alterazioni infiammatorie croniche della mucosa che
conducono ad atrofia della mucosa e a mataplasia intestinale di solito in assenza di erosioni. Le alterazioni
epiteliali possono assumere il carattere di una displasia e costituire la base per lo sviluppo di carcinomi. Nei
paesi occidentali la prevalenza dei quadri istologici indicativi di gastrite cronica in età avanzata è superiore al
50%.
Le principali associazioni eziologiche sono:
Infezione cronica da H. pilori
Patologie autoimmuni in associazione ad anemia perniciosa (anemia magaloblastica causata da
gastrite atrofica e una mancata produzione di fattore intrinseco che porta a carenza di vit. B12)
Sostanze tossiche come alcool e fumo
Postumi di interventi chirurgici soprattutto antrectomia con gastroenterostomia con reflusso di
secrezioni biliari e duodenali
Patologie della motilità e meccaniche comprese occlusioni, bezoari (concrezioni endoluminari) e
atonia gastrica
Radiazioni
Malattie granulomatose come il Crohn
Altre cause come l’amiloidosi, la malattia graft-versus-host, uremia
L’associazione più frequente è quella con l’H.P (tipo 2 o B). La modalità di trasmissione non è ancora stata
ben chiarita, sebbene la diffusione ambientale, la via oro-orale e oro-fecale siano la più probabili. La maggior
parte dei soggetti infetti nonostante presentino la gastrite associata all’infezione sono asintomatici. Le
persone infette hanno un più alto rischio di ulcera peptica e di cancro gastrico. Le peculiarità che hanno
permesso al batterio di adattarsi alla mucosa gastrica letale per la maggior parte degli altri batteri sono: la
motilità per mezzo di flagelli, l’elaborazione di un’ureasi che produce ammoniaca e anidride carbonica a
partire dall’urea endogena tamponando così l’ acidità gastrica nelle vicinanze del batterio, l’espressione di
adesine batteriche come la BabA che si lega agli ag di gruppo sanguigno B e aumenta il legame alle cellule
che presentano l’ag di gruppo sanguigno 0, l’espressione di tossine batteriche come i prodotti del gene
associato a citotossina A (CagA) e del gene della citotossina vacuolante A (VacA). Il batteri causa gastrite
sia stimolando la produzione di citochine pro-infiammatorie sia danneggiano direttamente le cellule
epiteliali. La gastrite può essere a predominanza antrale con elevata produzione di acido e alto rischio di
ulcera duodenale oppure una pangastrite seguita atrofia multifocale con secrezione acida bassa e maggior
rischio di adenok. L’IL-1beta è una potente citochina pro-infiammatoria e un efficace inibitore dell’ acidità
gastrica. I pz che producono più IL tendono a sviluppare una pangastrite. Tra i test diagnostici non invasivi
per l’H.P. troviamo un test sierologico anticorpale, l’identificazione del batterio nelle feci e un test
respiratorio all’urea (breath test). Questo si basa sulla formazione di ammoniaca da parte dell’ureasi
batterica. I test invasivi si basano sull’ identificazione del batterio nelle biopsie gastriche.
I metodi di rilevamento su tessuto gastrico comprendono la visualizzazione del batterio nelle sezioni
istologiche, l’esame colturale, il test rapido all’ureasi e la ricerca del DNA batterico con reazione a catena
polimerasica (PCR). Il batterio è facilmente evidenziato con le colorazioni argentiche, sebbene i m.o.
possano essere individuati con la colorazione di Giemsa e con una banale EE. Anche nelle colonizzazioni più
marcate il batterio è assente nelle aree di metaplasia intestinale.
La terapia si avvale di antibiotici e inibitori di pompa protonica.
Tra i sintomi si può avere nausea vomito e disturbi epigastrici.
La gastrite autoimmune (tipo 1 o A) rappresenta meno del 10% delle gastrite croniche. È dovuta alla
presenza di autoanticorpi diretti contro dei componenti delle cellule parietali delle ghiandole inclusi anticorpi
contro l’enzima H,K-ATPasi, il recettore per la gastrina e il fattore intrinseco. Esiste una familiarità con
trasmissione autosomica-dominante. La distruzione delle ghiandole e l’atrofia della mucosa portano alla
perdita di produzione acida. Nei casi più gravi viene persa anche la produzione di fattore intrinseco con
conseguente anemia perniciosa. Questa forma di gastrite può essere associta alla tiroidite di Hashimoto, il
morbo di Addison e il DM tipo 1. I pz con questa gastrite hanno un più elevato rischio di k gastrici e
carcinoidi, e caratterizzata da lesioni diffuse della mucosa del corpo-fondo con interessamento antrale
minore o assente perche sono le cellule parietali il bersaglio degli autoAB. Nella fase1 (gastrite cronica
superficiale) la mucosa conserva il suo spessore ma le cellule specializzate sono ridotte e vengono
progressivamente sostituite da cellule muco-secernenti. Nella tonaca propria interfoveilare si osserva
un’infiltrazione da parte di linfociti, plasmacellule e sporadici granulociti eosinofili. Nella fase 2 (gastrite
atrofica) il processo infiammatorio raggiunge la sottomucosa; le pliche si appiattiscono dando alla mucosa un
aspetto piatto e liscio;la mucosa si assottiglia e mostra un progressivo diradamento delle ghiandole con
aumento relativo del connettivo e rinforzo della trama fibrosa; l’infiltrazione linfo-plasmacellulare può
essere marcata e può organizzarsi in follicoli. Le ghiandole residue mostrano ulteriore perdita di cellule
specializzate, mentre si osserva spesso metaplasma intestinale con intercalazione nell’epitelio di cellule
caliciformi mucipare. Nella fase 3 (atrofia gastrica) le alterazioni infiammatorie sono meno marcate con
minor numero di linfociti e plasmacellule. La perdita di cellule specializzate è totale.
Le gastriti causate da fattori ambientali come quella da H.P. tendono ad interessare la mucosa antrale da sola
o con quella del corpo-fondo (pangastrite). La mucosa è arrossata con una trama più grossolana. L’ infiltrato
infiammatorio può causare un ispessimento delle pliche mucosali che simula lesioni infiltranti. In caso di
atrofia di lunga durata la mucosa può assottigliarsi e appiattirsi. Si osserva un infiltrato infiammatorio con
linfociti e plasmacellule nella lamina propria.
L’infiammazione attiva comporta la presenza di neutrofili nello spessore dell’epitelio superficiale e
ghiandolare. L’infiammazione attiva può essere intensa o assente. Spesso si osservano aggregati linfoidi
intramucosi con centro germinativo. La popolazione di cellule specializzate è danneggiata in maniera
minima. A lungo andare soprattutto negli anziani vi può essere un certo grado di atrofia ma questa non è mai
completa.
Alterazioni rigenerative: una caratteristica costante è la proliferazione epiteliale in risposta al danno subito.
Le mitosi nel colletto delle ghiandole gastriche risultano così aumentate. Le cellule epiteliali della superficie
mucosa e in minor misura delle ghiandole hanno nuclei ingranditi e ipercromici e un maggior rapporto
nucleo-citoplasmatico. Nelle cellule superficiali i vacuoli di muco diminuiscono o mancano del tutto.
Metaplasia intestinale: la mucosa antrale, del corpo e fundica può essere parzialmente sostituita da cellule
metaplastiche di tipo intestinale cilindriche assorbente o caliciformi sia nell’ epitelio di superficie sia in
ghiandole rudimentali. Occasionalmente possono apparire digitazione simili a villi. Sebbene predominino
caratteri dell’ epitelio dell’intestino tenue talora possono osservarsi aspetti da epitelio colico. Nella
metaplasia intestinale completa (di tipo ileale) si osserva un orletto a spazzola evidente e compaiono cellule
caliciformi mucipare e cellule di Paneth, nella metaplasia intestinale incompleta (più simile all’epitelio del
colon) l’orletto a spazzola è discontinuo. Lo studio della secrezione delle mucine con Alcian blu più ferro
colloidale ha permesso di distinguere tre tipi di metaplasia intestinale: tipo 1 con produzione di mucine
neutre, tipo 2 con produzione di sialomucine e sporadicamente solfomucine limitate alle cellule caliciformi,
tipo 3 con produzione prevalente di solfomucine sia dalle cellule caliciformi che dalle cellule colonnari. Le
solfomucine sembrano potenzialmente cancerogene per la mucosa gastrica, per cui il tipo 3 è stato associato
a un altissimo aumentato rischio di k gastrico.
Atrofia: spesso le ghiandole sopravvissute vanno incontro a dilatazione cistica. Una caratteristica particolare
della gastrite cronica trattata con inibitori della secrezione acida è l’iperplasia delle cellule g della mucosa
antrale per l’ipocloridria. L’iperplasia delle cellule G causa aumento della gastrinemia che causa l’ iperplasia
delle cellule enterocromaffino-simili del corpo spesso base di carcinoidi.
Displasia: con il perdurare di una gastrite cronica l’epitelio sviluppa alterazioni citologiche inclusi variazioni
delle dimensioni della forma e dell’ orientamento delle cellule costitutive e ingrandimento e atipica dei loro
nuclei. La metaplasia intestinale può precedere la displasia. La displasia può essere così grave da costituire
un K in situ. È una precancerosi gastrica soprattutto se associata ad anemia perniciosa e a H.P.
Sistema di Sidney (1991, modificato nel 1996) per le gastriti:
Acuta
Cronica: da H.P., autoimmune, non atrofica, atrofica.
Speciale: linfocitaria, granulomatosa…
Grading delle seguenti variabili: H.P., infiammazione cronica, neutrofili (attività), atrofia, metaplasia
intestinale.
D) FA, RISTENOSI MITRALICA, VENTRICOLO SX A PARETI ASSOTTIGLIATE
Esame istologico della valvola mitralica
Dimensioni dell’orifizio mitralico 8mm: si tratta di una stenosi serrata (v.n. 4-6 cm2)
I margini liberi della valvola mitralica sono ancorati alla parete ventricolare da molte delicate corde tendinee
attaccate ai muscoli papillari che sono contigui alle sottostanti pareti ventricolari. I muscoli papillari sono
posizionati sotto le commissure e ricevono corde tendinee da due lembi adiacenti. La sua continenza dipende
delle azioni dell’annulus (il margine esterno dell’orifizio valvolare dove si attaccano i lembi), dei lembi,
delle corde, dei muscoli papillari e della parete ventricolare associata. Le valvole sono rivestite da endotelio,
hanno una struttura in strati che consiste principalmente di un nucleo denso di collagene (fibrosa) vicino alla
superficie di efflusso e in continuità con le strutture valvolari di supporto, un nucleo centrale di tessuto
connettivo lasso (spongiosa) e uno strato ricco in elastina (ventricularis) al di sotto della superficie di
afflusso. Il collagene della fibrosa è responsabile dell’ integrità meccanica della valvola e la spongiosa
funziona come ammortizzatore dei traumi. La valvola presenta cellule interstiziali che producono e riparano
la matrice extracellulare in particolare collagene della valvola. I lembi e le cuspidi hanno scarsi vasi limitati
alla porzione prossimale poicè sono talmente sottili da poter essere nutriti per diffusione dal sangue cardiaco.
Le colorazioni utilizzate sono l’EE e il VanGieson per il tessuto elastico. Sono presenti depositi calcifici
senili ed esiti di cicatrizzazione postinfiammatoria da cardiopatia reumatica.
E)
SOSTITUZIONE
VALVOLARE
CON
PROTESI
METALLICA,
IPOCINESIA
VENTRICOLARE DIFFUSA E INSUFFICIENZA RENALE da bassa portata con probabile MOF.
ESAME ESTERNO GENERALE E FENOMENI POST-MORTALI
Macchie ipostatiche di II grado: in assenza di circolo il sangue segue la forza di gravità e si deposita nelle
parti più declivi del corpoformando le cosiddette macchie ipostatiche. Si crea un contrasto per cui le parti più
elevate del corpo presentano un colorito pallido e cereo quelle più declivi escluse quelle su cui il cadavere
poggia appaiono umide succulente e di color rosso-vinoso. La mobilità delle macchie ipostatiche permette di
stabilire la cronologia del decesso. Si distinguono macchie ipostatiche di I grado che sono mobili, sono
dovute alla raccolta di sangue ancora fluido infatti scompaiono alla digitopressione (diascopia) e vanno poste
in DD dall’ecchimosi che non scompare ed è travasata e macchie ipostatiche di II grado che compaiono dopo
8-10 ore sono fisse e indelebili dovute alla lisi delle emazie con diffusione e fissazione dell’ emoglobina nei
tessuti e non scompaiono con la compressione. La sede delle macchie ipostatiche permette di stabilire la
posizione del cadavere: saranno dorsali se la posizione del cadavere è supina, ventrali se la posizione del
cadavere è prona, laterali e inferiori se è posizionato su un fianco, nella metà inferiore del corpo se il
cadavere è morto impiccato. Si avranno ipostasi paradosse se il cadavere è stato spostato. Possono essere
utili per risalire alla compressione indicata da zone pallide esercitata da vestiti, cinture, lacci o oggetti posti
sul terreno. Il colore delle ipostasi può permettere di stabilire la causa di morte. Il colore è normalmente
rosso vinoso, è cianotico nelle morti per asfissia, rosso vivo nell’ avvelenamento da CO per formazione di
carbossiemoglobina, rosso-rosee in annegati assiderati o altre condizioni di bassa temperatura (il freddo
rallenta la riduzione dell’ossiemoglobina), verdastre e poi brunastra con l’andare della putrefazione per
degradazione dell’emoglobina nei suoi pigmenti.
Rigidità cadaverica: subito dopo la morte a causa dell’atonia muscolare il corpo assume un atteggiamento di
completo abbandono; poi i muscoli si irrigidiscono per fenomeni biochimici locali (apoptosi-rilascio di
calcio e acetilcolina) e le articolazioni si fissano in particolari posizioni (rigor mortis). Successivamente la
rigidità scompare per i fenomeni di autolisi muscolare. La rigidità interessa tutti i gruppi muscolari ma in
questi compare in momenti diversi secondo la legge di Nysten. Si distinguono 3 fasi: nella fase di insorgenza
la rigidità inizia nei muscoli del volto e si estende in senso cranio-caudale fino a coinvolgere tutto il corpo
dopo 12-24 ore, nella fase di stabilizzazione l’irrigidimento totale si mantiene stazionario fino a 48 ore dopo
la morte, nella fase di risoluzione la rigidità si risolve gradualmente secondo lo stesso ordine cranio-caudale
di comparsa. Cessa completamente dopo circa 72 ore. La rigidità inizia nei muscoli più piccoli per
continuare poi in quelli con volume maggiore. La rigidità può essere modificata da fattori intrinseci come
grado di sviluppo muscolare età causa della morte ed è più spiccata nelle morti improvvise e da fattori
estrinseci come temperatura ambientale (con il freddo si instaura più tardivamente ma dura più a lungo con il
caldo compare più precocemente ma è più breve) umidità ventilazione.
APPARATO CARDIOVASCOLARE
Pericardio ampiamente aperto anteriormente: esito dell’ intervento chirurgico.
Modesta pericardite fibrinosa: nelle pericarditi acute è frequente il riscontro di un’essudazione fibrinosa
accompagnata da un più o meno abbondante versamento (pericardite fibrinosa o siero-fibrinosa), la
superficie cardiaca è ricoperta da essudato fibrinoso con tendenza per gli strati ad aderire e successivamente
ad organizzarsi con sfregamento pericardio auscultabile. Può essere stata provocata da RAA (sierofibrinosa), uremia (fibrinosa, c’è stata IR), intervento chirurgico. Altra causa di pericardite fibrinosa è
l’infarto miocardico.
Peso di 460gr: valori normali 240-360gr, dato dall’ipertrofia.
La stenosi mitralica ha provocato una dilatazione dell’atrio sx, con conseguente congestione polmonare
causa di ipertrofia del ventricolo dx.
Assottigliamento della parete ventricolare sx e dilatazione delle cavità: la cardite reumatica e la stenosi
mitralica hanno postato alla dilatazione delle cavità cardiache. In alcuni casi si instaura un circolo vizioso in
cui la valvulopatia produce delle alterazioni emodinamiche che generano ulteriore fibrosi deformante.
L’assottigliamento della parete ventricolare sx è stato provocato dalla cardite con conseguente dilatazione.
Se abbiamo stenosi mitralica pura il ventricolo sinistro ha spessore normale eventualmente si può avere
deposito di tessuto fibroso dovuto a episodi ripetuti di cardite.
Se si associa insufficienza mitralica il progressivo aumento del flusso in ventricolo può portare a dilatazione
dello stesso.
Cause di trombosi dell’orecchietta:
l’atrio sx comunica attraverso una stretta apertura con l’appendice auricolare che ha forma di dito di guanto e
che può diventare sede di trombi se il flusso transatriale è rallentato. Ciò avviena a causa della stasi ematica
ad esempio provocata da una stenosi mitralica e soprattutto in presenza di FA. Può verificarsi come
complicanza di un infarto miocardico, nel caso di una cardiomiopatia dilatativa e insufficienza ventricolare
sx che provochino un rallentamento del flusso atriale.
Rischi della trombosi atriale:
sono rappresentati da embolie sistemiche ad encefalo, intestino, rene e arti inferiori.
Alterazioni anatomopatologiche extracardiache della trombosi atriale:
le conseguenze dell’embolia cerebrale possono variare da uno a più piccoli infarti nelle aree silenti del
cervello, all’infarto cerebrale localizzato, all’infarto della capsula interna e delle strutture connesse o
all’infarto di gran parte di un emisfero cerebrale. Talora si manifestano emboli periferici con interessamento
degli arti superiori o inferiori: sono colpite la biforcazione iliaca (embolia a sella), le arterie iliache o
femorali monolaterali con dolore intenso arto freddo e marezzato. Raramente sono colpite le arterie della
retina l’arteria renale con infarto renale o l’arteria mesenterica con infarto intestinale. L’ interessamento
embolico del sistema coronario può causare infarto miocardico o angina. Assai meno frequentemente il pz
perde conoscenza o può morire improvvisamente in conseguenza di un trombo a palla ostruente il flusso
attraverso la mitrale. Sostanzialmente si tratta di lesioni ischemiche o emorragiche associate ad embolie.
Esempi:
INF. POLMONARE: in caso di insufficienza del circolo collaterale,gli emboli sono perlopiu’ di piccole
dimensioni e assai raramente causano occlusioni massive con morte cardiaca improvvisa(emorragico)
INF. INTESTINALE : in genere ischemia massiva,si instaura rapidamente e non permette la formazione di
un circolo collaterale vicariante,emorragico;(emorragico).
INF. RENALE: ischemico.
INF. EPATICO: poco comune se non in caso di trapianto ,ishemico con alone di steatosi.
INF. CEREBRALE: ischemico facilmente infarcibile per dissoluzione dell’ embolo con ripresa di flusso in
aree danneggiate dall’ ischemia.
Complicazioni locali successive ad un intervento di sostituzione valvolare: le complicanze tromboemboliche
(ostruzione trombotica della valvola o tromboembolizzazione a distanza) rappresentano il problema
principale nelle valvole meccaniche. I pz devono essere sottoposti a th anticoagulante a lungo termine che
può essere responsabile di complicanza emorragiche quali ictus o emorragie gastrointestinali. L’endocardite
infettiva è una complicanza infrequente ma potenzialmente grave. Si localizza a livello dell’interfaccia
protesi-tessuto cardiaco dando luogo ad ascessi ad anello che possono evolvere in una perforazione
paravalvolare con conseguente reflusso di sangue. Sulle cuspidi delle protesi si possono formare delle
vegetazioni. I principali microrganismi responsabili sono gli stafilococchi aureus ed epidermidis gli
streptococchi e i funghi. Il deterioramento strutturale raramente può essere responsabile dell’insuccesso della
valvola meccanica (comunque si può avere usura distacco del supporto valvolare rottura, rottura delle
cuspidi, calcificazione). Comunque è la principale causa di fallimento di una bioprotesi per via di
calcificazioni o rottura responsabili di rigurgito. Alterazioni non strutturali sono il tessuto di granulazione
sutura intrappolamento tissutale distacco paravalvoalre dimensioni inadeguate rumorosità. Altre
complicazioni comprendono l’emolisi indotta dall’ elevata ostruzione meccanica al flusso che riguarda tutti i
tipi di valvole meccaniche e l’inadeguata o esagerata cicatrizzazione che può causare rispettivamente una
rottura paravalvolare o un eccesso di tessuto fibroso.
Morte intraoperatoria 6%, solo per pz con stenosi serrata sopravvivenza a 10 anni del 70%.
APPARATO RESPIRATORIO
Aderenze pleuriche a sx: esito dell’intervento o del RAA.
Polmone da stasi cronica con grave edema e congestione acuta: condizione caratteristicamente associata allo
scompenso cardiaco cronico sinistro o combinato (tipica causa la stenosi mitralica). Consiste nell’innesco di
una fibrosi dei setti alveolari determinata dalla congestione cronica dei capillari. Polmoni di consistenza
aumentata (indurimento bruno) di colore rosso cupo rugginoso. Al taglio fuoriuscita di moderata quantità di
sangue. Istologicamente setti alveolari con trama fibrosa rinforzata congestione dei capillari alveoli
contenenti gran quantità di macrofagi carichi di pigmento emosiderinico. L’edema polmonare acuto, classico
dell’insufficienza cardiaca, spesso insorge di notte con dispnea cianosi rantoli bollosi abbondante escreato
schiumoso roseo. Quadro macroscopico: polmoni pesanti alla spremitura fuoriesce abbondante liquido roseo
schiumoso. Quadro istologico: struttura alveolare conservata (setti integri) con abbondante liquido
endoalveolare povero di cellule associata congestione. Edema cronico: organizzazione dell’edema, fibrosi
delle pareti alveolari.
APPARATO GASTROENTERICO
Ulcera peptica riepitelizzata:
l’ ulcera peptica si localizza soltanto nei siti in cui è presente succo gastrico acido. In ordine di frequenza le
sedi interessate sono: il duodeno, lo stomaco, l’esofago distale e raramente la mucosa gastrica eterotopica
come ad esempio nel diverticolo di Meckel. L’ulcera acuta può essere associata a gastrite acuta soprattutto in
situazioni di grave shock e può essere accumunato alla ulcere da stress. Raramente misurano più di 1 cm,
presentano aspetto a stampo e interessano mucosa e sottomucosa. Possono essere singole o multiple. La
mucosa è distrutta e si hanno cellule infiammatorie nella sottomucosa. La guarigione può essere rapida
tuttavia le ulcere possono estendersi in profondità e interessare la parte più interna della tonaca muscolare ed
erodere i vasi ematici provocando gravi emorragie. Raramente si può avere perforazione con scarsa
infiammazione e peritonite. L’ ulcera peptica subacuta presenta una maggior penetrazione nella tonaca
muscolare con più intensa reazione infiammatoria e lieve fibrosi. L’ulcera peptica cronica interessa la tonaca
muscolare che viene progressivamente distrutta, la storia clinica è di lunga durata e probabilmente anche se
non provato derivano da un precedente danno acuto. Sono tipicamente situate sulla piccola curva in sede
antrale anche se in assoluto la sede più frequente è la prima porzione del duodeno. Meno frequenti sono la
sede cardiale ed esofagea distale. Sono quasi sempre singole ma in un 5-10% dei casi due ulcere si possono
riscontrare l’una di fronte all’altra a livello del piloro o del duodeno. Le dimensioni classiche sono 2-3 cm
con un andamento più scosceso della parete prossimale con tipica struttura a terrazza e più dolce distalmente.
Si hanno periodi di quiescenza con tentativi di guarigione e produzione di connettivo fibroso. Si avrà
deposito di fibrina con detriti necrotici, tessuto di granulazione infiltrato da linfociti e plasmacellule, tessuto
fibroso denso che sostituisce la tonaca muscolare e vasi che mostrano endoarterite. Frequentemente il
processo ulcerativo si estende alla sierosa o la supera. Questo determina aderenze ad organi vicini ad
esempio il pancreas con conseguente penetrazione dell’ ulcera nell’ organo interessato. Lo stomaco
circostante frequentemente è interessato da gastrite cronica. Il fattore essenziale nella genesi dell’ulcera
peptica è la presenza dell’acido che agisce come continuo irritante determinando l’ulcera cronica. Per il
mantenimento dell’integrità della mucosa devono essere presenti muco protettivo, adeguata irrorazione
ematica, rapido turnover delle cellule epiteliali per mantenere integra la superficie. L’aspirina e altri fc
antinfiammatori, alcol, reflusso di sali biliari e la gastrite cronica provocano alterazioni del muco protettivo.
Il fumo lo stress e lo shock provocano una difettosa circolazione nei vasi antrali non anastomotici. Lo stress
attraverso il meccanismo surrenalico e la th corticosteroidea provocano una ridotta capacità rigenerativa.
Tutto ciò provoca una riduzione nella resistenza della mucosa che con l’azione dell’acido, della pepsina e
della lisolecitina porta all’ulcera peptica cronica. In aggiunta vi è un’importante componente genetica. Il
quadro generale del meccanismo con cui si produce l’ulcera gastro-duodenale ha subito una profonda
revisione dalla scoperta di un agente infettivo specifico: l’H.P.. Nella mucosa gastrica e duodenale si osserva
un elevato numero di questi batteri in una gran parte dei casi di gastrite cronica tipo2 e di duodenite. L’H.P.
elabora una potente ureasi e lipasi. Questo batterio provoca un’infezione della mucosa antrale con gastrite
cronica tipo 2. il batterio si localizza nel muco in superficie e dà un danno focale alle cellule epiteliali con
focale infiltrazione neutrofila. L’ infezione della mucosa duodenale è secondaria all’ infezione della mucosa
antrale e dipende dalla presenza di une metaplasia gastrica superficiale nella prima parte del duodeno
conseguente all’ ipercloridria e al rapido svuotamento dello stomaco. Assieme alla metaplasia si ha
produzione di muco di tipo gastrico il quale appare incoraggiare la colonizzazione da parte degli H.P. che
provoca danno cellulare con richiamo di neutrofili e duodenite. Questo danno di basso grado ma continuo
stabilisce le condizioni per la realizzazione di un ulteriore danno da parte di acidi ed enzimi della digestione.
Riassumendo l’ipermotilità e l’iperacidità gastrica provocona metaplasia gastrica del duodeno che per
l’infezione gastrica da H.P. si complica con duodenite e ulcera duodenale. Questa migliora e guarisce quando
si eradica l’H.P. e si riduce la secrezione acida.
Complicazioni dell’ulcera peptica: la guarigione è frequente soprattutto nelle ulcere acute e subacute ma
anche in quelle croniche. L’ulcera subacuta guarita mostra una lieve depressione e una piccola quantità di
tessuto fibroso che causa depressione per contrazione. L’ulcera cronica guarita mostra una depressione
profonda con contrazioni stellate, distruzione della mucosa, gran quantità di tessuto cicatriziale contrattile e
tonaca muscolare trascinata dal connettivo. Una cicatrice nel duodeno può provocare una grave stenosi, un’
ulcera cicatrizzata nella regione pilorica può risultare in una stenosi pilorica. In entrambi i casi lo stomaco si
dilata portando a vomiti prolungati con alcalosi e malnutrizione. La stenosi causata dalla guarigione di una
grossa ulcera della piccola curva può determinare una trazione della grande curva con lo stesso risultato della
stenosi pilorica. La stenosi della parte distale dell’ esofago determina difficoltà nel transito del materiale
alimentare e dilatazione a monte. La perforazione di un’ulcera acuta è rara. Presenta pareti a terrazza. È
probabilmente un’ulcera subacuta su cui si è sovrapposta un’esacerbazione acuta. Quando un’ulcera cronica
si perfora probabilmente il processo perforativo avviene diagonalmente attraverso una zona non guarita. La
perforazione causa peritonite acuta. Questa tende a essere circoscritta dalla formazione di aderenze e come
risultato si può determinare la formazione di un ascesso subfrenico tra fegato e diaframma. Tuttavia
l’infiammazione cronica che accompagna l’ulcera cronica causa frequentemente aderenze alle aree adiacenti
e ciò previene la perforazione. Come ogni processo ulcerativo attivo il sanguinamento è frequente. Nella
gran parte dei casi è minimo e può derivare da un gemizio del tessuto di granulazione che può apparire solo
dall’esame del sangue occulto fecale. Un’emorragia più marcata può causare colorazione scura delle feci e
vomito a posa di cafè. Occasionalmente da un’ulcera cronica si possono avere gravi emorragie. La maggior
parte dei vasi presenti alla base dell’ulcera vanno incontro a andoarterite e ciò limita le possibilità di un’
emorragia, tuttavia un ramo arterioso abbastanza grande alla base dell’ulcera può essere erosonin una fase
ulcerativa acuta e il tessuto fibroso circostante non essendo in grado di retrarsi causando così un
sanguinamento continuato. La trasformazione in carcinoma è più che altro teorica. In questi casi (circa l’1%
di tutte le ulcere) probabilmente si trattava fin dall’ inizio di un carcinoma ulcerato non diagnosticato per
errori nell’esecuzione dei prelievi bioptici.
FEGATO E VIE BILIARI
Fegato da 1400gr da stasi cronica:
v.n. 1400-1600gr. L’ ingorgo sanguigno del fegato avviene in tutte le circostanze in cui si verifica un’
insufficienza cardiaca retrograda detta appunto congestizia, il fegato che può temporaneamente
immagazzinare circa un quarto dell’intera massa circolatoria è il primo organo a risentire della difficoltà di
deflusso del cuore dx. Situazioni analoghe si creano in conseguenza di pericarditi croniche costrittive che
coinvolgano lo sbocco della vena cava inferiore nell’atrio dx. nella congestione passiva acuta il fegato è
aumentato di volume con intensa sfumatura rosso-cupa diffusa abbondante contenuto ematico che sgorga
spontaneamente dalla sezione. Microscopicamente si osserva dilatazione dei sinusoidi zeppi di elementi del
sangue, con il prolungarsi della stasi le sue conseguenze microscopiche si fanno più evidenti nelle aree
centrolobulari ove si associano fenomeni di ipertrofia epatocitaria da compressione e ipossia. Nella
congestione passiva cronica iniziale compare sulla superficie della sezione una variegatura dovuta all’
accentuarsi della stasi centrolobulare con punteggiatura rosso-cupa resa evidente del contrasto con steatosi
che interessa le aree periferiche dei lobuli, questo quadro è detto fegato a noce moscata. L’ipotrofia cellulare
e la dilatazione dei capillari con il protrarsi dei disturbi nutritizi si rendono sempre più manifesti lungo le vie
della stasi ovvero nelle zone 3 che descrivono anelli rosso cupi che circondano aree giallastre per steatosi
corrispondenti al parenchima periportale. Questo è il fenomeno dell’ inversione del lobulo. Negli stadi più
avanzati si ha fibrosi che fa seguito a fenomeni regressivi e necrosi causata dall’ insufficienza circolatoria. Si
parla di pseudocirrosi cardiaca. Il fegato mostra tendenza alla retrazione con granulosità superficiale dovuta a
fenomeni microcicatriziali aumento di consistenza capsula ispessita. Iperplasia epatocitaria nella zona 1 può
essere evidente anche macroscopicamente sulla superficie di sezione sotto forma di aree biancastre irregolari
più pronunciate nei giovani nei quali assumono particolari configurazioni dette a foglie di felce.
Microscopicamente la presenza di aree di rigenerazione nodulare dà luogo a quadri che per il loro disordine
strutturale sono assai simili a quelli della cirrosi. In caso di pericardite costrittiva è abbastanza comune un
ispessimento della glissoniana forse per l’ostacolo recato alla circolazione linfatica, il viscere appare come
avvolto da una glassatura ed è detto fegato a zucchero candito.
MILZA E ORGANI EMATOPOIETICI
Milza di 165gr da stasi cronica:
v.n. 150gr. La congestione venosa cronica può causare una forma di ingrossamento della milza nota come
splenomegalia congestizia. La congestione venosa può essere sistemica in origine, causata da malattie
intraepatiche che ritardano il drenaggio venoso portale o può nascere da malattie extraepatiche che
ostruiscono direttamente le vene portali o spleniche. Tutti questi disordini portano a ipertensione della vena
porta o splenica. La congestione venosa sistemica o centrale si manifesta negli scompensi cardiaci che
interessano il lato dx del cuore come può accadere nella malattia della valvola tricuspide o polmonare nel
cuore polmonare cronico o in seguito a insufficienza cardiaca del lato sx del cuore. La congestione venosa
sistemica passiva porta soltanto ad un modesto aumento di volume della milza che raramente supera i 500gr.
Le cause più comuni di splenomegalia congrstizia sono costituite dalle varie forme di cirrosi epatica. La
fibrosi epatica a canna di pipa della schistosomiasi causa una splenomegalia congestizia grave mentre anche
la diffusa cicatrizzazione fibrosa in casi di corrosi alcolica e di cirrosi emocromatosica causa un notevole
aumento di volume della milza.la splenomegalia congestizia può essere causata anche dall’ ostruzione della
vena porta extraepatica o della vena splenica. Questa può derivare da trombosi spontanea della vena porta
che è di solito associata a malattie ostruttive intraepatiche o da infiammazione della vena porta (piliflebite)
come conseguenza di infezioni intraperitoneali. La trombosi della vena splenica può essere conseguente a
compressione esercitata de neoplasie degli organi limitrofi come k stomaco o k pancreas. Una congestione di
lunga data produce un forte ingrossamento della milza (1000gr o più, fino 5000gr) l’ organo è più compatto.
La capsula è ispessita e fibrosa. Le superficie di taglio ha un aspetto denso e varia dal grigio-rosso al rosso
scuro a seconda della quantità di fibrosi. Spesso la polpa bianca è indistinguibile. Microscopicamente la
polpa rossa è congestionata nella prima fase della congestione cronica ma diventa più fibrosa e cellulata con
il tempo. L’ aumento di pressione venosa portale provoca la deposizione di collagene nella membrana basale
dei sinusoidi che appaiono dilatati a causa della rigidità delle loro pareti. Il risultante rallentamento del flusso
ematico dei cordoni ai sinusoidi prolunga l’ esposizione delle cellule del sangue ai macrofagi cordali con
conseguente eccessiva distruzione (iperslenismo). Sono spesso presenti nuclei di emorragia recente o
passata. L’ organizzazione di queste emorragie focali dà origine ai noduli di Gandy-Gamma; foci di fibrosi
contenenti sale di ferro e calcio depositati sul tessuto connettivo e sulle fibre elastiche.
Infarto sottocapsulare con esiti sclerotici:
le lesioni da infarto sono causate dall’ occlusione dell’arteria splenica principale o di uno dei suoi rami,
mentre nelle milze di normali dimensioni sono in genere dovute ad emboli che originano da trombi cardiaci.
La milza insiema a reni e cervello rappresenta una tra le più frequenti sedi al cui interno gli emboli si
stabiliscono. Gli infarti che ne risultano possono essere piccoli o grandi singoli o multipli e possono
interessare l’intera milza. Sono di solito non complicati ma possono diventare settici quando sono associati a
endocardite infettiva delle valvole mitrali e aortiche. Gli infarti sono comuni anche nelle milze fortemente
ingrandite forse perché l’ apporto ematico non può far fronte alle superiori richieste dall’organo. Gli infarti
livi sono tipicamente pallidi e a forma di cuneo con le loro basi decentrate dove la capsula sovrastante è
spesso ricoperta di fibrina. Nell’ infarto settico questo aspetto è modificato dallo sviluppo di necrosi
suppurativa. Nel corso della guarigione da infarto splenico si sviluppano spesso grandi cicatrici appiattite.
RENI ED APPARATO UROPOIETICO
Reni di 145gr senza alterazioni evidenti, IR:
v.n. 150gr, IR pre-renale da ipovolemia acuta, deficit della gittata cardiaca, shock.
APPARATO GENITALE
MONGA
Istologia utero
L’ utero è diviso in tre parti: la cervice (eso e endocervice=canale cervicale), istmo (o segmento uterino
inferiore in gravidanza) e corpo. La mucosa dell’ utero è l’ endometrio. Si distingue una parte profonda
basale, dedicata alla rigenerazione del tessuto e una parte superficiale a sua volta divisa in compatta e
spugnosa. La parte basale è sempre presente quella superficiale varia con il ciclo: 1° fase = proliferativi
(aumento degli estrogeni, dovuto alla secrezione da parte della granulosa e della teca con picco il 14° giorno
(ovulazione); lo strato basale dell’ endometrio rimasto esposto alla fine della precedente mestruazione
comincia a rigenerare. Lo spessore dell’ endometrio aumenta progressivamente le ghiandole aumentano in
tortuosità e lunghezza; sono tappezzate da cellule cilindriche che in questa fase presentano molte mitosi, i
nuclei sono ovalari), 2° fase = secretiva diminuzione degli estrogeni e aumento del progesterone (la teca
diventa corpo luteo che secerne progesterone). Le ghiandole diventano più voluminose perchè si raccoglie il
secreto al loro interno. Le cellule sonno occupate da vacuoli basali (con nucleo spostato verso l’alto) che poi
passano all’ apice e vengono secreti nel lume. Lo stroma si modifica, le cellule diventano più grandi per
accumulo di glicogeno nel citoplasma. Se in questa fase l’ uovo è stato fecondato arriva nell’ endometrio e
viene nutrito dallo stroma e dalle secrezioni ghiandolari finchè non si forma la placenta. Se non c’ è stata
fecondazione il corpo luteo regredisce, c’ è la caduta della concentrazione ormonale con ischemia delle
arteriose eliciformi con necrosi e sfaldamento dell’ endometrio = fase mestruale.
Portio vaginalis (esocervice) = epitelio squamoso non cornificante. Al centro si trova l’ orifizio esterno del
canale vaginale. La parte stremale è costituita da muscolatura liscia e connettivo. Portio sopra vaginalis
(endocervice) = epitelio cilindrico a secrezione mucipara che riveste anche le ghiandole. Unico strato con
cellule di riserva alla base. Le ghiandole sono positive per i recettori estrogenaci come endometrio e
mammella. L’ epitelio cilindrico muciparo e pavimentoso variano con l’ età. Età fertile = ha strato basale che
prolifera, cellule intermedie (di grosse dimensioni) e uno strato superficiale (cellule appiattite). Menopausa =
l’ epitelio pavimentoso si assottiglia e le cellule sono molto più piccole con nucleo che sembra più grande e
che ha diversi caratteri nucleari (rapporto nucleo/citoplasma aumentato). Possibile confusione con elementi
neoplastici. La giunzione squamo-colonnare tende a scendere in rapporto alle modificazione del ciclo. A un
certo punto anziché essere all’ orifizio si trova sulla porzione vaginale. È un aspetto fisiologico: erosione o
eversione o ectopia. All’ osservazione colposcopica si vede la mucosa rossa e non rosea. Il glicogeno
accumulato nelle cellule viene usato dai batteri e questo provoca una caduta del PH vaginale ; l’ endocervice
è molto sensibile alle modificazioni del microambiente vaginale e subisce una trasformazione metaplastica in
epitelio squamoso. L’ epitelio rigenerativo è diverso dall’ epitelio normale, perché manca di glicogeno (che è
alla base del test di Schiller con soluzione iodata) nell’ esame colposcopico eseguito con spennellatura:
normalmente colora rosso mogano l’ epitelio pavimentoso. Problema di DD tra displasia e K. Giunzione
squamo-cellulare: è il punto in cui l’epitelio da cilindrico passa a squamoso. Si trova sull’ esocervice,
perifericamente all’ orifizio esterno. Da qui originano la maggior parte delle alterazioni preneoplastiche e
neoplastiche della cervice. Con il passare del tempo la giunzione squamocellulare si sposta verso l’ esterno
(eversione endocervicale). L’epitelio cilindrico viene cosi esposto all’ ambiente acido vaginale = va incontro
a metaplasia pavimentosa.
Leiomiomi uterini
Non evolvono in leiomiosarcomi.
Frequenza elevata (4-11% delle donne; 40% oltre i 50 anni).
Formazioni nodulari molto ben delimitate.
Sede:
Sottomucosi = in genere non sintomi, ma il peduncolo può torcersi dando emorragia.
Intramurali = possibile interferenza con le contrazioni uterino e con ampiezza del canale del parto; se
molto grandi possono dare compressione dell’ uretere e idronefrosi. Possibile menorragia.
Sottosierosi = in genere non sintomi. Possono avere due aspetti: larga base di impianto sul miometrio
o peduncolati che possono andare incontro a inginocchiamento o torsioni con ostacolo al deflusso
venoso e infarcimento emorragico (addome acuto)
Aspetto microscopico: cellule fusate in fasci più stroma ialino. Spesso presentano aspetti regressivi (ialinosi
del connettivo, deposizione di sali di calcio, imbibizione edematosa con aspetti cistici o presenza di tessuto
adiposo). Forme particolari: leiomioma cellulare: n° di cellule per unità di volume o di superficie è molto
aumentato però non c’ è necrosi, l’ indice mitotico è molto basso, assenza di atipie; leiomioma atipico o
bizzarro o pleiomorfo con numerose atipie ma non necrosi e indice mitotico molto basso.
Leiomiosarcoma
Molto raro nell’ utero, non deriva dal leiomioma
Macroscopicamente ha aspetto simile al leiomioma, nodulare, margini sfumati, però ha aree di necrosi e di
emorragia.
Microscopicamente: ipercellularità, polimorfismo e atipie; alto indice mitotico (>7-8 mitosi per 10 campi),
necrosi o emorragie.
Diffusione locale o a distanza (polmone e ossa per via ematogena)
Fibroleiomiomi dell’utero
I leiomiomi uterini, spesso chiamati fibromi, sono probabilmente il tumore umano più comune. Questi
tumori sono presenti nel 75% delle donne in età riproduttiva e in ogni utero si trova una media di 6,5 tumori.
Ogni leiomioma uterino è un’unica neoplasia clonale. La maggior parte dei leiomiomi ha un normale
caroitipo, ma circa il 40% ha una anomalia cromosomica semplice. Sono stati identificati sei sottogruppi
citogenetica: una traslocazione bilanciata tra i cromosomi 12 e 14, parziali delezioni del braccio lungo del
cromosoma 7, trisomia 12 e riarrangiamenti del 6p, 3q e 10q. Anche quando molto estesi possono essere
asintomatici. I sintomi più importanti sono determinati dai leiomiomi sottomucosi (perdite ematiche atipiche)
compressione della vescica (pollachiuria) improvviso dolore se si verifica l’ interruzione dell’ apporto
ematico e compromissione della fertilità. I miomi nelle donne gravide aumentano la frequenza di aborti
spontanei anomalie di presentazione del feto inerzia uterina ed emorragia postpartum. La trasformazione
maligna (leiomiosarcoma) di un leiomioma è rara.
Natura e caratteristiche anatomopatologiche dei leiomiomi:
Sono tumori ben circoscritti, demarcati, rotondi, di consistenza dura, grigio-bianchi di dimensioni variabili
da piccoli noduli a malapena visibili fino a grosse masse che occupano l’intera pelvi. Tranne che in rare
situazioni, si rinvengono nel contesto del miometrio del corpo. Solo infrequentemente interessano i
legamenti uterini, il segmento uterino inferiore o il collo. Possono presentarsi entro il miometrio
(intramurale), appena al di sotto dell’endometrio (sottomucosi) o al di sotto della sierosa (sottosierosi).
Indipendentemente dalle loro dimensioni il caratteristico aspetto fascicolato delle fibre muscolari lisce al
taglio solitamente rende queste lesioni facilmente identificabili all’esame macroscopico. Grossi tumori
possono sviluppare aree di rammollimento di colore giallo-marrone fino al rosso (degenerazione rossa).
Esame istologico (EE): il leiomioma è composto di fasci intrecciati di cellule muscolari lisce che
assomigliano al circostante miometrio non coinvolto. Di solito le singole cellule sono uniformi nella
grandezza e nella forma hanno un caratteristico nucleo ovalare e lunghi processi bipolari citoplasmatici
affusolati. Le figure mitotiche sono scarse. Varianti benigne comprendono tumori atipici o bizzarri
(simplastici) con atipica nucleare e cellule giganti e leiomiomi cellulari. Tutti presentano un basso indice
mitotico. Una varinte estremamente rara il leiomiome metastatizzante benigno si estende all’interno dei vasi
e migra verso altre sedi in genere verso il polmone. La leiomiomatosi peritoneale diffusa si presenta sotto
forma di multipli piccoli noduli nel peritoneo. Ambedue sono considerati benigni malgrado il loro inusuale
comportamento.
Altre localizzazioni: i leiomiomi possono anche insorgere nei muscoli erettori del pelo presenti nella cute,
nel capezzolo, nello scroto e nelle labbra vulvari e nell’esofago. Piu rari nello stomaco e nell’ intestino tenue.
Rapporti con i leiomiosarcomi: queste rare neoplasie maligne compaiono ex novo direttamente dal
miometrio o dallo stroma endometriale che va incontro a differenziazione muscolare liscia. Possiedono
cariotipi complessi e più casuali rispetto ai leiomiomi. Comprendono delezioni su un certo numero di
cromosomi. Crescono all’interno dell’utero come masse voluminose carnose che invadono la parete uterina o
masse polipoidi che protrudono nel lume uterino. All’esame istologico mostrano un’ampia gamma di atipia
da forme molto ben differenziate fino a linee anaplastiche che presentano le alterazioni citologiche di
sarcomi in accrescimento selvaggio. La distinzione tra leiomiomi e leiomiosarcomi è basata sul grado di
atipia nucleare, dll’ indice mitotico e della necrosi zonale. La presenza di 10 o più mitosi per campi ad alto
ingrandimento 400x è segno di malignità in presenza o meno di atipia cellulare. Se il tumore contiene atipie
nucleari o cellule epiteliomorfe con ampio citoplasma (epiteliodi) 5 mitosi per campo ad alto ingrandimento
sono sufficienti per giustificare una diagnosi di malignità. Rare eccezioni comprendono leiomiomi attivi dal
punto di vista mitotico in donne giovani o gravide e una certa cautela deve essere posta nell’ interpretare tali
neoplasie come maligne. Un certo numero di neoplasie della muscolatura liscia può risultare impossibile da
classificare ed esse sono denominate tumori del muscolo liscio a incerto potenziale di malignità. I
leiomiosarcomi sono ugualmente frequenti prima e dopo la menopausa con un picco di incidenza tra i 40 e i
60 anni. Questi tumori hanno una sorprendente tendenza a recidivare dopo la loro asportazione e più della
metà dei casi metastatizza infine per via ematica a organi distanti come i polmoni l’osso e il cervello. La
disseminazione lungo tutta la cavità addominale è ugualmente possibile. Il tasso di sopravvivenza a 5 anni
mediamente è di circa il 40%. Le lesioni ben differenziate hanno una migliore prognosi rispetto alle lesioni
anaplastiche che presentano un basso tasso di sopravvivenza a 5 anni di circa il 10-15%.
EPICRISI
Causa iniziale: RAA complicato da stenosi mitralica trattata con commisurotomia
Causa intermedia: FA trattata con cardioversione fermacologica e ristenosi mitralica trattata con sostituzione
valvolare con protesi metallica
Causa finale: ipocinesia ventricolare diffusa e insufficienza renale e possibile multi-organ-failure.
Altri stati morbosi rilevanti: gastrite cronica moderata attiva da H.P., ulcera peptica, polmone, fegato e milza
da stasi cronica, fibroleiomiomi dell’ utero.