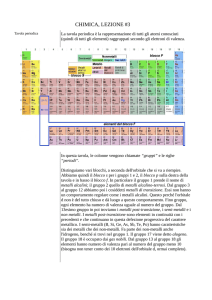
TAVOLA PERIODICA
La classificazione periodica degli elementi
Nel 1869 Mendeleev scoprì che gli elementi potevano essere classificati e ordinati,
sulla base delle proprietà chimiche e fisiche possedute. La tavola periodica moderna è
costituita da 111 elementi chimici. Soltanto 89 sono presenti in natura, principalmente
sotto forma di composti e raramente come elementi puri (come Oro, Platino, Argento,
Rame, Carbonio, Ossigeno, Azoto, Zolfo e pochi altri). Altri 20 elementi, che occupano
la parte bassa della Tavola Periodica, sono stati scoperti nel corso delle ricerche
sull’energia atomica oppure sono stati ottenuti mediante apposite reazioni nucleari.
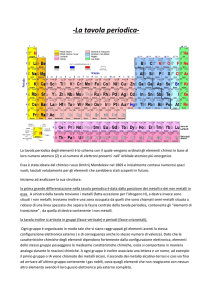
La sottostante Tavola Periodica degli Elementi è suddivisa in colonne verticali che sono
denominate gruppi e in linee orizzontali che si chiamano periodi.
Nella Tavola periodica si distinguono:
I GRUPPI, rappresentati dalle colonne verticali, che riuniscono gli elementi con
configurazioni elettroniche simili; poiché gli elettroni esterni sono quelli che entrano in
gioco nei fenomeni di tipo chimico, elementi di uno stesso gruppo presentano
proprietà chimiche analoghe, soprattutto per quanto riguarda gli elementi successivi al
primo, che spesso presenta in parte caratteristiche proprie.
IL COMPORTAMENTO CHIMICO DEGLI ATOMI È DETERMINATO DAGLI
ELETTRONI DI VALENZA.
I PERIODI, rappresentati dalle righe orizzontali, con gli elementi disposti in ordine di
peso atomico crescente, sono indicati da un numero progressivo all’estrema sinistra
1
della Tavola. Lungo il periodo si ha una graduale variazione delle proprietà, legata alle
variazioni nella struttura elettronica.
Se, invece, rivolgiamo la nostra attenzione ai periodi, possiamo osservare che il primo
periodo è costituito soltanto da due elementi (idrogeno ed elio), cui seguono due
periodi di otto elementi ciascuno. A partire dal quarto periodo, la zona centrale è
occupata dai cosiddetti elementi di transizione con variazioni di proprietà molto
limitate. Il quarto ed il quinto periodo comprendono 18 elementi, mentre il sesto ed il
settimo comprendono un numero maggiore di elementi, per cui è stato necessario
sistemare due serie di elementi a parte: si tratta, rispettivamente, dei LANTANIDI, o
terre rare, (che seguono il lantanio, La Z = 57) e degli ATTINIDI (che iniziano con
l’attinio, Ac Z = 89).Gli elementi che costituiscono ciascuna di queste due serie
presentano tra loro proprietà chimiche molto simili e si sono sempre incontrate
notevoli difficoltà per
separarli.
Come accennato, nella Tavola Perodica possono essere individuate zone
corrispondenti al riempimento dei diversi tipi di orbitali; possiamo distinguere vari
BLOCCHI:
· BLOCCO-S: in cui gli elettroni più esterni occupano ORBITALI S, e che comprende i
gruppi I e II (primi due gruppi a sinistra).
· BLOCCO-P: in cui gli elettroni esterni occupano ORBITALI P, e che comprende i
gruppi III, IV, V,VI, VII, oltre al Gruppo 0 (ultimi sei gruppi a destra).
· BLOCCO-D: in cui vengono progressivamente riempiti gli ORBITALI D, e che
comprende gli elementi nella parte centrale della Tavola che, oltre a presentare
proprietà analoghe verticalmente, si somigliano anche orizzontalmente.
· BLOCCO F: in cui vengono riempiti gli ORBITALI F, e che comprende lantanidi ed
attinidi.
Gli otto gruppi del blocco-s e del blocco-p sono i cosiddetti ELEMENTI
RAPPRESENTATIVI; per gli elementi di questa sezione della Tavola periodica il numero
del gruppo indica il numero di elettroni nel livello più esterno. Gli elementi del bloccod e del blocco-f rappresentano, invece, gli ELEMENTI DI
TRANSIZIONE; per questi, la relazione tra il numero del gruppo e gli elettroni esterni
è un pò più complicata. Lantanidi ed attinidi rappresentano i cosiddetti ELEMENTI DI
TRANSIZIONE INTERNI.
2
Secondo un’ultima suddivisione, si può osservare che la maggior parte degli elementi
della Tavola periodica sono METALLI, mentre i NONMETALLI sono concentrati nella
parte destra della Tavola; i gas nobili (ultima colonna a destra) vengono considerati
un gruppo particolare di nonmetalli.
Metalli e non-metalli vengono spesso separati da una linea diagonale a scalini: gli
elementi lungo questa linea sono i METALLOIDI (chiamati anche semi-metalli), non
classificabili in modo preciso, che per certi aspetti presentano proprietà metalliche,
pur avendo anche alcune proprietà dei non-metalli. Tra le proprietà considerate per
distinguere i metalli dai nonmetalli, la conducibilità elettrica e la natura (acida o
basica) degli ossidi.
Quindi, il carattere metallico diminuisce lungo i periodi da sinistra verso destra ed
aumenta nei gruppi dall’alto in basso: l’elemento con più spiccate caratteristiche
metalliche è il cesio, quello con caratteristiche in assoluto più non-metalliche il fluoro.
La forma irregolare della tavola è determinata dal fatto che gli elementi che
presentano somiglianze nel comportamento sono stati disposti uno sotto l'altro e
formano perciò i gruppi. Inizialmente tutto ciò fu fatto esaminando le caratteristiche
macroscopiche degli elementi, cioè il loro evidente comportamento chimico, senza
poter comprendere il perchè di queste somiglianze. La spiegazione di questo
comportamento è ora nota e va come al solito ricercata a livello microscopico.
Esaminiamo ora gli elementi che costituiscono il gruppo II, i metalli alcalino-terrosi.
Questi hanno notevoli somiglianze (sono elementi solidi di scarsa durezza, molto
reattivi e quindi presenti in natura come composti ecc.); proviamo ad osservarne le
configurazioni elettroniche.
elemento
numero
atomico
configurazione elettronica
Berillio
Magnesio
Calcio
Stronzio
Bario
Radio
Z=4
Z=12
Z=20
Z=38
Z=56
Z=88
1s22s2
1s22s22p63s2
1s22s22p63s23p64s2
1s22s22p63s23p64s23d104p65s2
1s22s22p63s23p64s23d104p65s24d105p66s2
1s22s22p63s23p64s23d104p65s24d105p66s24f145d106p67s2
elettroni
di
valenza
2
2
2
2
2
2
Il berillio (Z=4) nel livello più esterno possiede 2 elettroni. Se adesso passate al
magnesio che sta proprio sotto al berillio noterete che anch'esso possiede 2 elettroni
nel livello più esterno; mentre per il berillio il livello più esterno è il secondo per il
magnesio è il terzo perchè ha un numero atomico maggiore. Se osservate i dati del
calcio (Z=20) noterete che anche questo elemento possiede 2 elettroni nel livello più
esterno (stavolta è il quarto) e così via fino alla fine del gruppo. Tutti questi elementi
possiedono 2 elettroni nel livello più esterno che vengono solitamente indicati come
elettroni di valenza. Questi elementi presentano perciò la stessa configurazione
elettronica esterna. Ecco spiegato il perchè delle somiglianze di comportamento
chimico:
Il numero degli elettroni dell'ultimo livello (elettroni di
valenza) determina il comportamento chimico degli
elementi e quindi gli elementi di uno stesso gruppo
3
possiedono caratteristiche chimiche simili perchè hanno la
stessa configurazione elettronica esterna.
Se provate con altri gruppi otterrete lo stesso tipo di risultato; gli elementi del gruppo
I possiedono tutti 1 elettrone nell'ultimo livello, quelli del gruppo VII ne possiedono 7
e così via. Gli elettroni dell'ultimo strato sono dunque molto importanti per
determinare il comportamento degli elementi chimici; per conoscere questo numero
non è necessario scrivere tutta la configurazione elettronica, è sufficiente osservare il
numero del gruppo di cui l'elemento fa parte.
Esiste una facile relazione tra la configurazione elettronica di un elemento e la sua
posizione nella tavola. Osserviamo quella del fosforo in cui è stata sottolineata la
configurazione elettronica esterna:
1s22s22p63s23p3
Questo elemento possiede gli elettroni di valenza nel livello 3 e infatti è posizionato
nel 3° periodo della tavola periodica, gli elettroni di valenza sono 5 ( 2 nel
sottolivello s e 3 nel sottolivello p) ed esso appartiene al gruppo V. Possiamo provare
il procedimento inverso: il carbonio fa parte del 2° livello e appartiene al gruppo IV,
la sua configurazione elettronica come era logico aspettarsi è infatti la seguente:
1s22s2
Per il fatto che le configurazioni elettroniche dei diversi elementi variano in modo
periodico, anche molte proprietà correlate a questa struttura seguono lo stesso
andamento facendo della tavola un'utile fonte di informazioni.
GRUPPI CARATTERISTICI
METALLI ALCALINI (GRUPPO I) ED ALCALINO-TERROSI
(GRUPPO II)
Tutti i metalli del Gruppo I hanno un elettrone s nello strato
esterno (ns1), mentre i metalli del Gruppo II anno due
elettroni s esterni (ns2); gli elettroni
esterni debolmente trattenuti dal nucleo, rendono molto
reattivi questi metalli, che perdono facilmente gli elettroni
esterni e formano ioni stabili (con carica
+1 per i metalli alcalini, +2 per gli alcalino-terrosi).
Ad esempio:
Na Na+ + eCa Ca2+ + ePresentano sempre stati di ossidazione di +1 e +2,
rispettivamente; questi sono perfettamente giustificabili,
osservando i valori delle energie di ionizzazione: ad esempio,
nel caso di Na staccare il secondo elettrone richiede nove
volte più energia rispetto al primo.
ALOGENI (Gruppo VII)
Caratterizzati tutti da molecole biatomiche, gli alogeni possono presentarsi in diversi
stati fisici (lo iodio è solido, il bromo è liquido, cloro e fluoro sono gas); il loro nome,
4
che significa .generatori di sali., sottolinea la forte reattività di questi non metalli che
mostrano, nonostante alcune differenze, proprietà
molto simili tra loro, conseguenza della somiglianza tra le strutture elettroniche (ns2
np5, 7 elettroni nello strato esterno). Diversamente dagli elementi del blocco s,
possono assumere nei composti diversi numeri di ossidazione.
GAS NOBILI (GRUPPO 0)
Sono caratterizzati da una grande inerzia chimica, che può essere messa in relazione
con lo strato esterno completo (orbitali s e orbitali p completamente riempiti, ns2 np6),
molto stabile. Si presentano come molecole monoatomiche e, a causa delle ridotte
interazioni tra atomi, hanno bassi punti di ebollizione e di fusione.
DAL CARBONIO AL PIOMBO (GRUPPO IV)
Gli elementi di questo gruppo, tutti con configurazione elettronica dello strato esterno
ns2 np2, mostrano, caratteristiche meno omogenee rispetto ad altri gruppi: il carbonio
è un non-metallo, silicio e germanio sono metalloidi, stagno e piombo presentano le
caratteristiche tipiche dei metalli. Le differenze di proprietà al crescere del numero
atomico possono essere messe in relazione con l’aumento del carattere metallico (cui
corrisponde una diminuzione del carattere non-metallico) a mano a mano che si
scende lungo il gruppo.
METALLI DI TRANSIZIONE
Gli elementi dallo scandio (Z = 21) allo zinco (Z = 30) formano la prima serie degli
elementi di transizione; analogamente, nei periodi successivi
possono essere individuate una seconda ed una terza serie. Nelle tre serie si ha il
riempimento degli orbitali 3d, 4d e 5d, rispettivamente. In questa zona
della Tavola periodica gli elementi presentano analogia di proprietà anche
orizzontalmente, ed ancora una volta questo può essere messo in
relazione con la struttura elettronica poco dissimile. Il terzo ed il quarto livello hanno
energie vicine e risultano parzialmente sovrapposti: infatti, nell’ordine di riempimento
degli orbitali l’orbitale 4s viene riempito prima del 3d, pur appartenendo ad un livello
successivo.
I METALLI
Proprietà macroscopiche:
si trovano alla sinistra della riga in
grassetto che compare nella tavola
periodica
sono quasi tutti solidi
sono duttili (si possono ridurre in fili) e
malleabili (si possono ridurre in lamine)
sono buoni conduttori di elettricità e
calore
sono lucenti ma opachi anche in strato
sottile
La maggior parte degli elementi della tavola periodica presenta caratteristiche metalliche; queste
aumentano procedendo da destra verso sinistra e dall'alto verso il basso cosicchè l'elemento con le
caratteristiche metalliche più spiccate è quello che si trova in fondo al gruppo 1 (francio). Anche le
famiglie dei lantanidi e degli attinidi che non compaiono nella figura a destra presentano
5
caratteristiche metalliche.
I metalli presentano bassi valori sia di energia di prima ionizzazione che di elettronegatività e
questo perchè possiedono pochi elettroni nel livello più esterno e tendono perciò a cederli
trasformandosi in cationi. In questo modo essi assumono una configurazione elettronica più stabile
simile a quella dei gas nobili (ottetto).
Proviamo a considerare un metallo qualsiasi: il sodio. La sua configurazione elettronica è la
seguente:
1s22s22p63s1
Na
Il sodio ha un unico elettrone di valenza che occupa il sottolivello s del livello 3; questo elettrone è
trattenuto molto debolmente dal nucleo e viene quindi ceduto con facilità. Il sodio ha dunque una
notevole tendenza a trasformarsi nel seguente catione:
1s22s22p6
Na+
In questo modo il sodio assume la configurazione elettronica del gas nobile che lo precede nella
tavola periodica (il neon) e assume una configurazione elettronica ad ottetto nel livello 2.
(ATTENZIONE! Perdendo un elettrone il sodio si trasforma in catione e non certo in un atomo di
neon perchè il suo nucleo in questa trasformazione non è cambiato.)
Il fatto che i metalli si comportino in questo modo giustifica appieno i bassi valori di energia di
ionizzazione e di elettronegatività riscontrabili in questi elementi; infatti poichè essi trattengono
debolmente i propri elettroni di valenza l'energia che serve per allontanare l'elettrone più esterno
sarà molto piccola come del resto sarà molto scarsa la tendenza ad attirare elettroni.
I NON METALLI
I non metalli:
si trovano alla destra della
riga in grassetto che compare
nella tavola periodica
si trovano allo stato solido,
liquido e aeriforme.
non sono duttili e malleabili
non sono buoni conduttori di
elettricità e calore
Solo una piccola parte degli elementi della tavola periodica presenta caratteristiche non
metalliche; queste aumentano da sinistra verso destra e procedendo dal basso verso l'alto
cosicchè l'elemento con le più spiccate caratteristiche non metalliche è il fluoro che si trova
nell'angolo in alto a destra della Tavola.
Dal punto di vista della configurazione elettronica i non metalli presentano parecchi elettroni
nel livello più esterno e da ciò deriva la loro tendenza ad acquistare elettroni trasformandosi
in anioni; così facendo essi assumono una configurazione elettronica più stabile simile a
quella dei gas nobili (ottetto).
Proviamo a considerare un non metallo qualsiasi: il fluoro. La sua configurazione elettronica
è la seguente:
6
F
1s22s22p5
Il fluoro ha 7 elettroni di valenza che occupano i sottolivelli s e p del livello 2;
questo elemento ha dunque un'elevata tendenza ad acquistare l'ultimo elettrone
necessario ad arrivare all'ottetto trasformandosi dunque nel seguente anione:
F-
1s22s22p6
In questo modo il fluoro assume la configurazione elettronica del gas nobile che
lo segue nella tavola periodica (il neon) e assume una configurazione elettronica
ad ottetto nel livello 2. (ATTENZIONE! Acquistando un elettrone il fluoro si
trasforma in anione e non certo in un atomo di neon perchè il suo nucleo in
questa trasformazione non è cambiato.)
Il fatto che i non metalli si comportino in questo modo giustifica gli elevati valori
di energia di prima ionizzazione riscontrabili in questi elementi; infatti poichè
essi trattengono fortemente i propri elettroni di valenza l'energia che serve per
allontanare l'elettrone più esterno sarà molto elevata. I valori di elettronegatività
dei non metalli sono anch'essi elevati.
PROPRIETA’ PERIODICHE
RAGGIO ATOMICO E RAGGIO IONICO
Determinare le dimensioni di un atomo pone qualche difficoltà, in quanto l’atomo non
ha limiti definiti; sono state formulate varie definizioni di raggio atomico, inteso come
metà della distanza tra i nuclei misurata alla distanza minima a cui possono
avvicinarsi due atomi uguali. Nella tavola periodica, il
raggio atomico cresce nei GRUPPI dall’alto in basso, cioè all’aumentare del numero di
livelli elettronici: infatti, al crescere di n, i livelli si troveranno
mediamente ad una maggiore distanza dal nucleo, e questo effetto sarà maggiore per
piccoli valori di n, vista la più ampia differenza di energia tra due livelli successivi.
Muovendosi lungo un PERIODO, i raggi atomici diminuiscono da sinistra a destra, in
quanto le cariche positive del nucleo risultano progressivamente maggiori; di
conseguenza gli elettroni sono più trattenuti, con conseguente
contrazione delle dimensioni atomiche. Tuttavia, l’entità della diminuzione del raggio
diventa meno rilevante a mano a mano che gli atomi sono più pesanti: in proporzione,
l’aggiunta di un protone provoca una variazione della forza minore rispetto a quello
che accade in un atomo piccolo. Infine, all’interno di una SERIE DI TRANSIZIONE, si
ha una variazione di dimensioni molto limitata,
dovuta al fatto che la forza attrattiva del nucleo si mantiene approssimativamente
costante.
Per quanto riguarda gli ioni, i cationi (a carica +) sono più piccoli degli atomi da cui
derivano, in quanto gli elettroni rimasti sono più attratti dal nucleo. Al contrario, gli
anioni (a carica -) hanno dimensioni maggiori, in quanto gli elettroni sono meno
trattenuti dal nucleo e tendono ad allontanarsi a causa della reciproca repulsione. Per
specie isoelettroniche, che hanno cioè lo stesso
numero di elettroni e la stessa configurazione, il raggio ionico diminuisce al crescere
della carica e del numero atomico. Ad esempio, se confrontiamo Na, Mg, Ne, Na+ e
Mg2+, abbiamo che Mg è più piccolo di Na (si trova più a destra nello stesso periodo),
Ne ancora più piccolo (ha solo due livelli), i cationi sono più piccoli dei rispettivi atomi,
in particolare, essendo Ne, Na+ e Mg2+ isoelettronici (10 elettroni, 1s2 2s2 2p6), Na+ è
più piccolo di Ne (carica nucleare 11 contro 10 del neon) ed Mg2+ è ancora più piccolo.
7
Andamento generale del raggio degli atomi
ENERGIA DI IONIZZAZIONE
Si chiama energia di prima ionizzazione l’energia richiesta per allontanare un elettrone
da un atomo neutro quando si trova allo stato gassoso.
La ionizzazione di un atomo può essere indicata nel modo seguente:
X + Energia X+ + edove X rappresenta un atomo generico, X+ il corrispondente ione positivo, el’elettrone rimosso.
“ La energia di prima ionizzazione dipende strettamente dalla configurazione
elettronica degli atomi”, per cui ha un tipico andamento periodico: le energie di
ionizzazione degli atomi crescono da sinistra verso destra, diminuiscono dall’alto verso
il basso nell’interno di un gruppo.
Questo andamento si comprende bene se si considerano le dimensioni degli atomi: gli
elettroni degli strati più alti più lontani dal nucleo e quindi anche più schermati dagli
elettroni interni, sono sempre più facilmente rimovibili.
Se ci ricordiamo inoltre che un atomo tende a essere stabile quando il suo strato, o
quello sottostante, è completo ( ottetto completo) e questo lo fa o cedendo o
acquistando elettroni. Oltre all’energia di prima ionizzazione si parla anche di energia
di seconda ionizzazione, di terza ionizzazione, ecc. che sono le energie di ionizzazione
necessarie per rimuovere i successivi elettroni:
processi di ionizzazione successiva possono essere così indicati:
X+ + Energia di 2a ionizzazione X2+ + eX2+ + Energia di 3a ionizzazione X3+ + eChiaramente le energie di ionizzazione successiva sono maggiori rispetto all’energia di
prima
ionizzazione perché si tratta di rimuovere elettroni (negativi) da ioni positivi.
8
AFFINITA’ ELETTRONICA
Mentre l’energia di ionizzazione si riferisce alla cessione di elettroni, l’AFFINITÀ
ELETTRONICA è una misura della variazione di energia che accompagna l’acquisto di
un elettrone. Secondo le convenzioni comunemente adottate, essa
è negativa se la reazione è esotermica, e positiva per processi endotermici; valori
positivi si hanno anche per acquisto di un secondo elettrone, che deve
vincere la repulsione con uno ione negativo. Passando da valori negativi a valori
progressivamente più positivi, l’acquisto di un elettrone avviene via via con maggiore
difficoltà.
In generale, atomi piccoli che occupano la parte destra della Tavola periodica hanno
affinità elettroniche molto negative, dovute al fatto che un elettrone acquisito può
disporsi più vicino al nucleo in un atomo di ridotte dimensioni. Per motivi opposti, gli
atomi nella parte bassa dei gruppi, di dimensioni maggiori, avranno in generale
affinità elettroniche meno negative rispetto agli elementi all’inizio del gruppo.
Quando un atomo fa parte di una molecola, la sua tendenza ad attrarre gli elettroni di
legame può essere espressa in termini di elettronegatività.
Di questa proprietà periodica si parlerà in relazione alla natura dei legami.
Atomo(g) + elettrone → Atomo−(g) + energia (A.E.)
L’elettrone in più conferisce una carica negativa all’atomo che diventa uno ione
negativo o anione.
L'ELETTRONEGATIVITA'
Un'importante proprietà degli elementi chimici è la loro elettronegatività. Possiamo
definire questa grandezza nel seguente modo:
L'elettronegatività di un elemento esprime la sua tendenza
ad attirare gli elettroni di un altro atomo con cui
interagisce
Questa grandezza viene di norma misurata utilizzando la scala creata dal chimico
L.Pauling che attribuisce il valore più elevato (4) al fluoro e i valori più bassi agli
elementi cesio e francio (0,7). Tutti gli altri elementi chimici possiedono valori di
elettronegatività intermedi. I valori di elettronegatività sono numeri puri, non hanno
cioè un'unità di misura, in quanto esprimono semplicemente la tendenza di un atomo
ad attrarre elettroni. Questa grandezza ha molta importanza nel determinare il tipo di
legame che si può instaurare tra due atomi.
Nella tavola periodica l'elettronegatività ha l'andamento riportato sotto:
Possiamo osservare che l'elettronegatività aumenta da sinistra verso destra lungo il
periodo e dal basso verso l'alto lungo il gruppo.
9