La terapia del dolore
Corso di Formazione Regionale
Medici di Medicina Generale
ASL 02 Lanciano – Vasto - Chieti
Anno 2013
Tutor : Dott. Lucio Zinni
Medico di Medicina Generale – Paglieta (CH)
Docente: Dott. Amedeo Costantini
Direttore UO Terapia del dolore- Ospedale Clinicizzato SS. Annunziata - Chieti -
Razionale del Corso
La Legge n° 38 approvata il 9 marzo 2010 rappresenta un elemento fortemente innovativo nell’ambito delle
Cure Palliative e della Terapia del Dolore. Molte sono le novità introdotte e sono coinvolti tutti livelli
assistenziali e molte funzioni professionali. Ma se un aspetto decisivo deve essere focalizzato esso riguarda
la costruzione della Rete Nazionale e Regionale del Dolore dove un ruolo fondamentale è assegnato ai
Medici di Medicina Generale (MMG), organizzati in Aggregazioni Funzionali Territoriali (AFT). I MMG in
molte occasioni saranno chiamati ad erogare cure antalgiche direttamente alla maggior parte dei propri
assistiti, indirizzando casi più complessi al Centro di Terapia del Dolore (HUB) attivo sul territorio, oppure
negli Ambulatori di terapia antalgica (SPOKE).
E’ stato definitivamente eliminato il ricettario speciale per la prescrizione degli oppiacei che può pertanto
essere direttamente prescritto dal MMG.
In ospedale medici e infermieri devono misurare il livello di dolore registrarne il valore in cartella clinica.
In sostanza si afferma una diversa concezione del dolore inteso come malattia da gestire.
Obiettivo Generale del Corso
Il MMG partecipante al Corso sarà messo in grado di definire correttamente il dolore e dunque la sua origine,
la sua tipologia, la sua intensità
Obiettivi specifici
Il MMG al termine del corso deve saper:
individuare le indicazioni all’impiego delle classi di farmaci utilizzate
impostare la terapia secondo gli schemi più adeguati al soggetto da trattare,
prevenire eventuali prevedibili effetti avversi.
Premessa
Il tema dolore durante tutto il percorso formativo del Medico, fin dagli studi universitari, è sempre parte
dello studio di altro, nell’ambito di particolari patologie o sindromi. In nessun momento formativo il dolore
viene affrontato in modo sistematico come caratteristica a sé stante di numerosi processi patologici.
Fare del dolore l’aspetto centrale di una determinata situazione clinica è una rivoluzione copernicana dal
punto di vista metodologico ma è necessario per affrontarne le dimensioni in modo sistematico e non
occasionale, indipendentemente dalle cause che lo originano.
Un italiano su quattro soffre di dolore cronico, la cui durata media di 7 anni.
La prevalenza di un sottotrattamento del dolore nel paziente oncologico è del 25%, che in alcuni gruppi
arriva al 55%[Breivik et al. (2006), Melotti et al. (2009) e Apolone et al. (2009)].
L’Italia ancora nel 2009 era al primo posto in Europa per il consumo pro-capite di Farmaci Antinfiammatori
Non Steroidei (FANS) e all’ultimo per quello degli oppiacei.
Nonostante il tentativo legislativo che istituiva il Comitato per l’Ospedale senza Dolore con una serie di
disposizioni pur encomiabili, nei fatti non decollava un diverso moderno e civile approccio alla gestione dei
pazienti con dolore.
La Rete del Dolore
Al fine di garantire le cure antalgiche tanto in Ospedale quanto al domicilio del Paziente è strutturata la Rete
Regionale del Dolore che ha tre nodi fondamentali e interagenti fra loro secondo il sistema Hub & Spoke
1. Hub: Centri di riferimento di terapia del dolore con i seguenti requisiti minimi:
a. 30 ore di attività ambulatoriale settimanale erogazione di prestazioni antalgiche invasive in
day-surgery/day-hospital/ degenza ordinaria,
b. almeno 2 posti letto per 2 giorni la settimana
c. espletamento di consulenze nel presidio entro 24 ore
d. espletamento di consulenze per pazienti in assistenza domiciliare e hospice entro 72 ore
e.
equipe di professionisti con competenza clinica relativa a procedure invasive di terapia
antalgica (documentazione dei volumi d’attività),
i. almeno 2 medici (dei quali 1 medico anestesista) dedicati all’attività di terapia
antalgica
2. Spoke: ambulatorio di terapia antalgica con i seguenti requisiti minimi:
a. 18 ore di attività ambulatoriale settimanale
b. • espletamento di consulenze per pazienti in assistenza domiciliare e hospice entro 72 ore
c.
almeno 1 medico anestesista
3. Il presidio ambulatoriale territoriale con competenze di terapia antalgica gestito dal team di MMG
con competenze antalgiche specifiche, organizzati in AFT e in grado di ridurre consistentemente gli
accessi impropri in PS per patologie dolorose.
In tutti i casi sono previsti adozione di procedure quali la definizione di percorsi diagnostico-terapeutici con
protocolli/procedure basati sulle evidenze e la valutazione delle performance con indicatori di processo e
risultato
La valutazione di un paziente con dolore nel setting della Medicina Generale
Il MMG è decisamente facilitato nell’approcciare e definire il dolore riferito dal suo paziente. Egli è infatti in
grado di definire rapidamente se si tratti di dolore riacutizzato nell’ambito di una malattia già nota o se si
tratti di un primo episodio di una malattia ancora da diagnosticare. E’ possibile inoltre che si possa trattare
di una cronicizzazione di un processo correlato ad una malattia inguaribile.
Il dolore va definito anche in base all’intensità e per questo esistono vari tipi di scale unidimensionali:
VAS (Visual Analogue Scale, scala visuoanalogica), che propone un’asta di 10 cm con due estremità
che corrispondono l’una a “nessun dolore” e l’altra a “il massimo dolore di cui si è avuto
esperienza”.
VRS (Verbal Rating Scale, scala verbale), che ripropone l’asta di 10 cm in cui la scelta viene
facilitata (ma anche condizionata) dalla presenza di aggettivi che quantificano il dolore.
NRS (Numerical Rating Scale, scala numerica), che propone l’asta di 10 cm in cui però la scelta
viene esplicitata da un numero, da zero a dieci (0 = nessun dolore, 10 = massimo dolore
immaginabile).
In generale si può affermare che vanno trattati con terapia antalgica quei pazienti il cui dolore interferisce
con la vita quotidiana e dunque la valutazione di intensità è imprescindibile per iniziare e per monitorare la
risposta al trattamento farmacologico. Fino al livello 3 delle scale si possono utilizzare paracetamolo da solo
o in associazione con FANS. Dal livello 4 a salire si utilizzeranno il paracetamolo associato a codeina e via
via gli altri antalgici fino agli oppiacei come suggerito dalla terapia a tre gradini suggerita dall’OMS.
Il Dolore Cronico
Per convenzione si definisce tale un dolore che persista con le medesime caratteristiche, più o meno
continuativamente, da almeno tre mesi.
Il discrimine preliminare che il Medico si trova a dover affrontare è quello che passa fra il dolore nocicettivo
e quello neuropatico.
Il dolore nocicettivo (es: lombalgia) è la risposta “fisiologica” ad uno stimolo algogeno. È il dolore di più
frequente riscontro: processi infiammatori, alterazioni osteoarticolari, patologie muscolari, fratture, traumi. È
generalmente ben circoscritto, provocato dalla stimolazione (meccanica, termica, chimica) dei nocicettori
periferici che inviano lo stimolo attraverso le fibre nervose del sistema somato-sensoriale al midollo spinale,
quindi al talamo e alla corteccia cerebrale. Il dolore nocicettivo è di due tipi:
1. meccanico-strutturale origina dai nocicettori sottoposti a stimoli di elevata intensità (sopra la soglia).
2. infiammatorio è causato da una sensibilizzazione dei nocicettori periferici da parte dei mediatori del
processo flogistico
Il dolore neuropatico (es: nevralgia del trigemino) è la conseguenza di una lesione di una via nervosa: un
danno ai nervi periferici (dolore neuropatico periferico) o al sistema nervoso centrale (dolore neuropatico
centrale) ed è caratterizzato da una quasi completa mancanza di correlazione tra l’entità dello stimolo
periferico e la sensazione dolorosa provocata essendo determinato da un’abnorme attività degli impulsi
generati.
Il dolore misto: (es: lombosciatalgia) il dolore è misto quando i sintomi del dolore nocicettivo si sommano
a quelli del dolore neuropatico.
La valutazione anamnestica del dolore ha un’importanza preliminare e spesso decisiva nella distinzione
tipologica del dolore. La probabilità che il dolore sia di tipo neuropatico è tanto più alta se il dolore:
è causato da una malattia nota che riporta a una lesione del sistema nervoso
la distribuzione del dolore riferita dal paziente coincide con l’innervazione di un territorio nervoso.
è riferito dal paziente come sensazione di bruciore, di scossa elettrica, di puntura di spillo
Se le tre condizioni sopraesposte sono contemporaneamente presenti la probabilità di dolore neuropatico è
vicina alla certezza.
La valutazione con esame obiettivo si sofferma innanzitutto sull’area del dolore, sulla sua localizzazione ed
estensione, sulla presenza di lesioni trofiche o modificazioni del trofismo superficiale o profondo (massa
muscolare)il disegno e l’estensione dell’area permettono di dedurre un eventuale danno neurologico.e in
secondo luogo sull’integrità del sistema somatosensoriale del paziente. Queste semplici considerazioni
consentono una valutazione rapida e soprattutto traducibile poi in appropriatezza terapeutica.
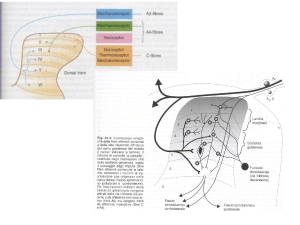
Il sistema somato-sensoriale è costituito da
Fibre di piccolo calibro nocicettive
1. di tipo C (amieliniche) dolore lento (secondo dolore) e ha le caratteristiche di dolore sordo,
profondo, che brucia come calore. Sono responsabili della percezione termica e si possono valutare
con una provetta di acqua calda, e questa è la prova più significativa per la valutazione dell’integrità
del sistema somato-sensoriale
2. di tipo A-delta (debolmente mielinizzate). dolore rapido (primo dolore) e ha le caratteristiche di
scarica elettrica, puntura. Sono responsabili del dolore rapido. La loro integrità si può valutare con la
puntura di uno spillo.
Queste fibre decorrono nei nervi periferici e hanno la cellula nel ganglio della radice posteriore e un
prolungamento centripeto che raggiunge i neuroni spinali WDRN (Wide Dynamic Range Neurons, neuroni
ad ampio spettro dinamico).
Fibre di calibro maggiore di tipo A-beta (mieliniche), che trasmettono la sensibilità tattile e propriocettiva.
Queste fibre hanno anch’esse la cellula nel ganglio della radice posteriore e hanno un prolungamento
centripeto che risale nel midollo spinale (senza una sinapsi spinale) e invia un ramo ai neuroni WDRN Il
dolore delle fibre tattili è il cosiddetto dolore-parestesia avvertito in forma di spilli o di aghi.Tali fibre sono
responsabili del tatto e della vibrazione e la loro integrità può essere esplorata con un cotton-fioc o
monofilamento.
La valutazione condotta con i sistemi semplici appena indicati, può dunque indicarci tre risposte:
1. NEGATIVA: integrità delle vie di conduzione somatosensoriali, ci indica con certezza che siamo di
fronte ad un dolore nocicettivo.
2. POSITIVA: lesione del sistema sensitivo, siamo certamente di fronte ad un dolore neuropatico
3. INCERTO: le tre prove non sono univoche.
Negli ultimi due casi è bene inviare il paziente presso un Centro Specialistico per inquadrare bene il dolore e
impostare una adeguata terapia.
Il MMG si trova dunque a dover trattare direttamente il dolore nocicettivo, ma, per poterlo fare al meglio,
deve valutare la soglia algica attraverso il dolore evocato con la somministrazione di stimoli nell’area riferita
come dolorosa da confrontare con il medesimo stimolo nell’area simmetrica corrispondente non dolorosa. Se
la soglia algica è ridotta è il caso di somministrare FANS che agiscono sulla componente certamente
infiammatoria di quel dolore nocicettivo, ma se la soglia risulta normale è del tutto inutile e privo di un
razionale usare i FANS, bisogna utilizzare analgesici.
Come abbiamo visto c’è un’area nella quale la funzione del MMG deve integrarsi nella Rete Dolore prevista
dalla Legge 38. Quali sono dunque i casi per i quali attivare i Centri Specialistici Hub&Spoke e su quali
criteri?
Dolore cronico senza una diagnosi di malattia causale
Consulto terapeutico allo specialista algologo
o Per contenere il dolore al di sotto di un certo limite di VAS
o Per monitorare le terapie adottate e per gestire processi di cura complessi
Principi di terapia del dolore
Alla valutazione e all’impostazione del percorso diagnostico-terapeutico si affianca e segue una terapia in
genere farmacologica. Abbiamo accennato più sopra allo schema a tre scalini dell’OMS che consente di
classificare il dolore in altrettante categorie: lieve, moderato, severo. In ciascuna di queste categorie saranno
impiegati farmaci con caratteristiche diverse.
III gradino
Dolore severo
Oppioidi forti con o
senza adiuvanti
II gradino
I gradino
Dolore moderato
Dolore lieve
Oppioidi deboli con o
Se il dolore persiste o
senza adiuvanti
aumenta
Non oppioidi – FANS
Se il dolore persiste o
con o senza adiuvanti
aumenta
Nel dolore lieve è possibile usare il paracetamolo, che tuttavia non è dotato di azione
antinfiammatoria. Sempre nel primo gradino possono essere utilizzati i FANS, i farmaci
antinfiammatori non steroidei, e i cosiddetti farmaci “adiuvanti”, che non sono veri e
propri analgesici ma potenziano questi ultimi. Quando il dolore diventa più forte siamo nel
secondo gradino: il paracetamolo non è più sufficiente e all’eventuale uso di FANS deve
essere associata la prescrizione di oppioidi deboli, come il tramadolo e la codeina.
Purtroppo tutti i farmaci del secondo gradino (oppioidi deboli e FANS) presentano l’effetto
tetto: aumentandone il dosaggio oltre una certa soglia non si ha un beneficio terapeutico
(poiché è stato appunto raggiunto il tetto terapeutico) ma soltanto un aumento degli effetti
collaterali
Se il dolore aumenta ulteriormente d’intensità dovranno essere utilizzati gli oppioidi forti, ai quali potranno
essere associati FANS e adiuvanti.
Gli oppioidi forti non hanno effetto tetto, per cui aumentandone il dosaggio si ha un aumento dell’effetto
analgesico. Questi farmaci non sono tuttavia esenti da effetti spiacevoli: nei primi giorni di terapia possono
causare nausea, vomito, capogiri e stitichezza. In seguito l’unico sintomo a persistere è, generalmente, la
stitichezza. La rotazione degli oppioidi, cioè il cambio di questi farmaci, si rende necessaria quando gli
effetti collaterali sono troppo fastidiosi, anche se l’effetto analgesico è soddisfacente.
La scala a 3 gradini dell’O.M.S. è stata ulteriormente arricchita di un 4° e 5° gradino: nel
4° esiste la possibilità di cambiare l’ oppioide seco ndo una scala di equianalgesia
(rotazione o “switching”) e nel 5° gradino vengono considerati tutti gli interventi invasivi
(pompe intratecali, stimolatori midollari, cordotomie, etc.) che si eseguono in quella
piccola percentuale di pazienti (5 -6%) che non rispondono ad alcuna terapia.
L’approccio moderno al trattamento del dolore prevede una terapia multimodale (combination therapy) che
permette di trattare il dolore in funzione delle sue diverse caratteristiche ed aspetti (origine, intensità, durata)
associando più farmaci a basso dosaggio delle varie classi, riducendo quindi, al tempo stesso, la possibilità di
eventi avversi.
GRADINO 1: DOLORE LIEVE (Intensità da 1 a 3 della scala numerica)
Farmaci di riferimento:
•
Paracetamolo,
•
ASA/ FANS
•
± un adiuvante
Prima linea: paracetamolo, ibuprofene, diclofenac, naprossene
Seconda linea: altri FANS e Cox 2 inibitori
Un paziente con dolore lieve dovrebbe ricevere o un FANS o paracetamolo a dosi adeguate. La scelta si deve
basare sull’analisi del rapporto rischio beneficio per ogni singolo paziente .
I pazienti che utilizzano i FANS e sono ad elevato rischio di eventi avversi gastrointestinali dovrebbero
ricevere un’adeguata protezione gastrointestinale
GRADINO 2: DOLORE MODERATO (Intensità da 4 a 6 della scala numerica)
Farmaci di riferimento:
•
Codeina
•
Buprenorfina
•
Tramadolo
•
Propossifene
•
± paracetamolo/FANS ± un adiuvante
Prima linea codeina + non oppiode, tramadolo
Se l’effetto di un oppioide per il dolore moderato alla dose ottimale non è adeguato, non si deve sostituirlo
con un altro oppioide per il dolore moderato. Si deve passare al gradino 3 della scala.
GRADINO 3: DOLORE SEVERO (Intensità da 7 a 10 della scala numerica)
Farmaci di riferimento:
•
Morfina
•
Metadone
•
Fentanyl
•
Ossicodone
•
Idromorfone
•
± paracetamolo/FANS ± un adiuvante
Prima linea: morfina + non oppiode
Seconda linea: fentanyl + non oppiode
altri oppioidi forti
Rassegna di alcuni farmaci a disposizione nella terapia del dolore
Più sopra si è accennato ai farmaci cosiddetti adiuvanti che saranno usati secondo le valutazioni già discusse
sul tipo di dolore e secondo il livello di intensità.
Si tratta di molecole che non hanno come prima indicazione il trattamento del dolore, ma che in alcune
situazioni si comportano come analgesici veri e propri. Tra questi prevalgono i farmaci antidepressivi e
antiepilettici. Essi, molto schematicamente sono:
Carbamazepina e oxcarbazepina: l’indicazione principale è nella nevralgia essenziale del
trigemino.
Antidepressivi triciclici: gravati da alcuni effetti collaterali che ne limitano in alcuni casi l’impiego,
rimangono i farmaci di prima scelta in pazienti con dolori di questo tipo.
Anestetici locali (lidocaina): difficilmente somministrabili nel lungo periodo, ma efficaci in
somministrazione endovenosa.
Gabapentinoidi (gabapentin, pregabalin)
Clonazepam.
Antidepressivi (triciclici e non).
Corticosteroidi, da utilizzare quando sia ravvisabile una condizione di flogosi delle vie nervose
Secondo lo schema appena sopra illustrato consideriamo dapprima il dolore lieve-moderato:
Farmaci antinfiammatori non steroidei (FANS): possono essere utilizzati in fase di valutazione e per brevi
periodi in numerose sindromi algiche in cui prevale un processo infiammatorio. La lunga durata d’azione ne
consiglia la somministrazione giornaliera. Riducono la sensibilizzazione dei recettori tissutali L’effetto
analgesico è mediato dalla riduzione dell’infiammazione
I FANS hanno effetto analgesico e antinfiammatorio mediante l’inibizione della ciclossigenasi (COX), un
enzima che permette la trasformazione dell’acido arachidonico in prostaglandina H2, precursore di tutte le
prostaglandine (PG) che svolgono un ruolo importante nel garantire l’integrità della mucosa gastrica, un
normale flusso plasmatico renale e una funzione piastrinica efficiente. L’enzima COX ha due diverse
isoforme, denominate COX-1 e COX-2 e l’effetto inibitorio dei FANS tradizionali si esplica su entrambe le
forme della COX, producendo così anche effetti dannosi, per esempio a livello dei meccanismi di protezione
della mucosa gastrica. La COX- 2 viene prodotta invece prevalentemente nelle sedi di flogosi e dunque viene
inibita esclusivamente in quella sede. A livello renale l’inibizione della ciclossigenasi blocca la sintesi delle
prostaglandine E2, importanti vasodilatatori delle arteriole renali, con conseguente riduzione dell’afflusso
sanguigno che può portare a insufficienza renale specie nei soggetti anziani, nei pazienti che fanno uso di
diuretici e di ACE-inibitori
In commercio abbiamo oggi solo due COX inibitori, celecoxib ed etoricoxib, per indicazioni diverse per tipo
e dosaggi: artrosi, artrite reumatoide, spondilite anchilosante e gotta acuta (solo etoricoxib) .
Salicilati. Le caratteristiche farmacologiche fondamentali dell’ASA consistono in un rapido
assorbimento, diffusa distribuzione nell’organismo ed eliminazione renale. L’ASA, oltre ad avere
un effetto antinfiammatorio, antipiretico e analgesico, ha anche un effetto antiaggregante piastrinico
a basse dosi, 100-500 mg/die. L’effetto antinfiammatorio si esplica a dosi > 1000 mg/die.
Indolici (indometacina) Emivita molto breve; per coprire le 24 ore necessita di tre
somministrazioni/die. Metabolizzati dal fegato ed escreti per via urinaria e fecale; dose massima
150 mg/die. È fortemente gastrolesiva.
Fenilacetici (diclofenac, aceclofenac). Metabolizzazione a livello epatico; dose massima 150
mg/die, suddivisa in due o tre dosi, ma talora anche in unica somministrazione.
Acidi propionici (ibuprofene, ketoprofene e naproxene).Rapido assorbimento gastrointestinale,
metabolizzati dal fegato ed eliminati per via renale. Ibuprofene ha emivita molto breve e può
richiedere tre o quattro somministrazioni giornaliere. Ketoprofene e, soprattutto, naproxene hanno
emivita più lunga e devono essere somministrati non più di 2 volte/die. Buona tollerabilità gastrica
Pirazolonici, (noramidopirina, metamizolo). Sono metabolizzati dal fegato ed eliminati per via
biliare. Antagonizzano l’azione di diversi antipertensivi, tra cui i diuretici.
Oxicam, piroxicam meloxicam Lunga emivita: una sola somministrazione giornaliera.
Naftilcanoni, (nabumetone). Dose massima 1 g/die; dotato di lunga emivita.
Nimesulide. Il farmaco (dose massima 200 mg/die) ha emivita compresa tra 5 e 7 ore e ne è stata
segnalata una particolare tossicità epatica
Paracetamolo
Al giusto dosaggio analgesico (1 g x 3/die) va considerato come prima scelta soprattutto nelle forme di
dolore lieve e continuo. Presenta ottima tollerabilità. Prima scelta nella terapia del dolore, in particolare nel
dolore cronico.
Tradizionalmente è incluso nella categoria dei FANS, con i quali condivide l’effetto
analgesico e antipiretico, mentre non ne possiede l’effetto antinfiammatorio. Inibisce la produzione di
prostaglandine, ma non interferisce con quelle che proteggono la mucosa gastrica e può essere assunto
indipendentemente dai pasti. L’interferenza con le vie degli oppioidi e della serotonina a livello del SNC
caratterizza l’azione analgesica esclusiva del paracetamolo.
Rapido assorbimento per via gastrointestinale con emivita altrettanto rapida. Nel dolore cronico si devono
tenere conto di questi tempi di efficacia, quindi è consigliabile stabilire somministrazioni ogni 4-6 ore Non si
deve superare la dose di 4 g/die. Nei soggetti con epatopatia il paracetamolo può indurre necrosi epatica
dose-dipendente con nausea, vomito, dolore addominale e, dopo alcuni giorni, aumento delle transaminasi e
della bilirubina.
Paracetamolo-codeina
dosaggi di 2 cpr x 3/die. Sono Modesti gli effetti collaterali degli oppiacei a dosaggio pieno (sonnolenza,
stipsi da utilizzare quando il dolore ha un’intensità lieve/moderata (VAS < 4). la codeina si trasforma in parte
in morfina, a cui è ascrivibile il potere analgesico. Il 15% circa della popolazione manca dell’enzima epatico
che trasforma la codeina in morfina e, anche nei pazienti in cui l’enzima è presente, la capacità di
trasformare codeina in morfina non è illimitata, pertanto si ha effetto tetto per mancanza di enzimi
metabolizzatori.
Metabolizzato dal fegato ed eliminato per via renale
La codeina manifesta il suo effetto dopo 15-30 minuti, mentre la sua emivita è di 3 ore; il paracetamolo ha
un’emivita di 1-4 ore.
Le controindicazioni sono rappresentate da ipersensibilità, porfiria, insufficienza renale grave, insufficienza
epatica grave, danni miocardici, anemia emolitica, tosse con pericolo di ristagno del secreto, stipsi cronica,
enfisema polmonare, asma bronchiale, ostruzione intestinale.
Effetti indesiderati: reazioni cutanee, eritema multiforme, angioedema, edema alla laringe, shock anafilattico,
trombocitopenia, leucopenia, anemia, agranulocitosi, alterazioni della funzionalità epatica ed epatiti,
alterazioni a carico del rene, reazioni gastrointestinali e vertigini.
Paracetamolo tramadolo
Da utilizzare in pazienti con dolore lieve-moderato (VAS < 5). In alcuni soggetti può provocare nausea e
vomito come del resto il tramadolo da solo. In questo caso è bene associare un farmaco antiemetico 10-15
minuti prima dell’assunzione. Gli intervalli di assunzione sono di almeno 6 ore.
Controindicazioni: intossicazione acuta da alcool, insufficienza epatica, assunzione di farmaci ipnotici,
analgesici centrali, oppiacei o sostanze psicotrope. Epilessia non controllata dal trattamento.
Oppiacei
Nel dolore moderato-grave non è possibile prescindere dall’uso degli oppiacei la cui efficacia è indiscussa,
benchè abbiano anch’essi scarso successo nel dolore neuropatico centrale e nel dolore evocato di tipo
meccanico.
La terapia deve essere assolutamente personalizzata, sia per il tipo di oppiaceo di volta in volta usato, sia per
il suo dosaggio. I loro effetti collaterali sono talvolta intollerabili .
In relazione alla potenza analgesica, si distinguono:
Oppiacei per il dolore lieve-moderato: codeina, tramadolo, propossifene.
Oppiacei per il dolore forte: buprenorfina, morfina, metadone, fentanil, oxicodone, idromorfone.
In relazione all’attività intrinseca e all’interazione recettoriale si distinguono:
Oppiacei agonisti puri (morfina, meperidina, fentanil, remifentanil). presentano un rapporto dose-effetto
lineare in assenza di un “effetto-tetto”.
Oppiacei agonisti parziali (buprenorfina). Il rapporto dose-effetto è caratterizzato dalla presenza di un
“effetto-tetto”. Tale effetto è poco rilevante nella clinica giacché l’effetto analgesico completo si raggiunge a
dosi molto inferiori rispetto a quelle necessarie a far sviluppare l’effetto-tetto
Oppiacei antagonisti (naloxone, naltrexone): essi scalzano dal recettore un agonista già presente. Sono
utilizzati nel sovradosaggio per togliere gli effetti depressivi sulla ventilazione e sullo stato di veglia.
Fentanil citrato
Le preparazioni commerciali prevedono due tipi di somministrazione:
-- transdermico: 12, 25, 50, 75 e 100 μg/ora. Il cerotto deve essere sostituito ogni 72 ore;
--orale transmucoso: 200, 400, 600, 800, 1200, 1600 μg (5-15 μg/kg) ogni 4-6 ore (da succhiare e non da
masticare).
E’ eliminato per via epatica, non ha effetto tetto
Gli effetti si manifestano dopo 12-18 ore per via transdermica, dopo 5-15 minuti per via orale transmucosa.
Il picco d’azione per somministrazione orale transmucosa 20-30 minuti, transdermica 24-72 ore (per il
primo cerotto), 12-24 ore (per i successivi). Durata d’azione: transdermica 3 giorni, orale transmucosa 1-2
ore.
Da non utilizzare in caso di grave compromissione del sistema nervoso centrale
Effetti indesiderati: cefalea, vertigini, , nausea, vomito, stipsi, lipotimia, sincope, ipotensione, miosi prurito.
Morfina solfato
Esiste in preparazioni diverse secondo la rapidità di rilascio:
-- rapide: formulazione monodose 10 mg soluzione orale (5 ml); formulazione monodose 30 mg soluzione
orale (5 ml); soluzione orale 20 ml, 20 mg/ml; sciroppo 100 ml, 2 mg/ml; il periodo di latenza nella
comparsa dell’effetto analgesico è di 10-20 minuti, picco d’azione 30-60 minuti, durata 3-6 ore.
-- retard: 10 mg cpr, 30 mg cpr, 60 mg cpr, 100 mg cpr, 200 mg cpr. La latenza nella comparsa dell’effetto
analgesico è di 60-90 minuti, il picco d’azione fra 1e 4 ore, la durata d’azione di 6-12 ore. La via di
eliminazione è epatica.
Non va utilizzata nell’ addome acuto, nell’ileo paralitico, durante un attacco di asma bronchiale, nè in caso di
scompenso cardiaco secondario ad affezioni croniche del polmone, dopo interventi chirurgici delle vie
biliari.
Gli effetti indesiderati sono del tutto sovrapponibili a quelli del Fentanil.
Tramadolo
è disponibile in forma iniettabile, endovenosa e/o intramuscolare,
e come preparazione orale. Viene
eliminato per via renale. La durata dell’effetto analgesico è di circa 6 ore. E’ Controindicato in gravidanza,
nell’ allattamento, nell’intossicazione acuta da alcool, ipnotici, analgesici, oppiacei o psicofarmaci. Gli
Effetti indesiderati comprendono nausea, vomito, stipsi, vertigini, allucinazioni, confusione.
Buprenorfina transdermica
Il cerotto deve essere portato ininterrottamente per 72 ore. L’emivita è di 30 ore. Il farmaco viene eliminato
per via renale e fecale.
Oxicodone cloridrato
Disponibile in diversi dosaggi e preparazioni per uso orale, va somministrato ogni 12 ore. Metabolizzato dal
fegato è eliminato per via renale. L’effetto analgesico è rapido e si manifesta fin da 10-5 minuti
dall’assunzione raggiungendo il picco dopo 30-60 minuti. La durata dell’effetto è di 3- 6 ore. Aumenta
l’effetto di farmaci depressivi del sistema nervoso centrale. L’analgesia è aumentata e prolungata da
analgesici narcotici e non narcotici (acido acetilsalicilico, paracetamolo, alfa2-agonisti e clonidina).
Gli effetti indesiderati sono quelli degli altri oppiacei: stipsi, debolezza, nausea, vomito, secchezza delle
fauci, sonnolenza, capogiri, prurito, diminuzione della libido, broncospasmo, spasmi biliari, ipotensione.
Idromorfone cloridrato
Le preparazioni sono tutte in compresse per uso orale da inghiottire intere ogni 24 ore. E’ eliminato per via
renale. La manifestazione dell’effetto analgesico è dopo 15-30 minuti; il picco d’azione 30-60 minuti; durata
4-6 ore. Alcool, sedativi, narcotici, antistaminici, fenotiazine, butirrofenoni rappresentano un ostacolo alla
somministrazione. L’idromorfone può ridurre l’effetto dei diuretici in pazienti con insufficienza cardiaca
congestizia. Gli effetti indesiderati: vertigini, sonnolenza; ipotensione, stipsi, nausea, vomito
Paracetamolo-oxicodone.
L’azione è lenta ma potente: impiega circa 40 minuti per agire completamente Da utilizzare quando il dolore
ha intensità moderata (VAS 4-6). Le preparazioni sono in compresse per uso orale. L’eliminazione è per via
renale ed epatica. Le controindicazioni sono rappresentate da: porfiria, deficit di glucosio-6-fosfato
deidrogenasi e grave anemia emolitica, insufficienza epatocellulare grave, insufficienza renale grave,
insufficienza respiratoria, asma bronchiale cronico, pazienti in trattamento con farmaci antidepressivi.
I possibili effetti indesiderati sono: stipsi, confusione mentale, nausea, vomito, sonnolenza, ipotensione
ortostatica.
Il dolore oncologico
Nel dolore non oncologico l’obiettivo terapeutico primo è quello di ridurre la disabilità del paziente per
consentirgli il ritorno alle sue quotidiane attività, mentre in quello di tipo oncologico si tratta di garantire ad
un paziente senza prospettiva di recupero delle proprie abilità, di non soffrire durante la progressiva perdita
di esse. Nei casi complessi e avanzati non è più neppure sufficiente la sola arma farmacologica, poiché il
dolore coinvolge tutte le componenti della persona. L’approccio al malato oncologico deve contemplare una
valutazione necessariamente multidisciplinare che assuma su di sè la soluzione dei molteplici aspetti della
sofferenza del malato e della sua famiglia. Tale percorso è possibile con l’attivazione della Rete delle Cure
Palliative di pari passo alla la Rete del Dolore. Lo stesso MMG deve superare il solipsismo suo tipico e
mettersi in Rete in modo da poter interagire con gli altri MMG che operano nello stesso territorio, con i
servizi territoriali del Distretto, sia con i Centri di riferimento ospedalieri e con gli Hub&Spoke della Rete
del Dolore e delle Cure Palliative.
Nell’origine del dolore oncologico, di fatto, non vi sono sostanziali differenze rispetto all’origine di quello
non oncologico
Nel 70% dei casi l’origine è di tipo compressivo e/o infiltrativo a carico di strutture somatiche,
viscerali o nervose con risultanti di dolore variabili secondo le strutture colpite. Il dolore di tipo
neuropatico può essere anche correlato anche all’azione dell’acidosi indotta dal tumore, che
sensibilizza i gangli, o ancora dalla produzione di dinorfine, specie nelle metastasi ossee
Negli altri casi c’è un’azione diretta del tumore di tipo infiammatorio, oppure dovuto direttamente al
rilascio di sostanze algogene, quali le endoteline (ET-1), peptidi ad azione vasocostrittrice.
In molti casi il dolore insorge come conseguenza di trattamenti, di complicanze, di comorbilità
Nell’adottare la scala a tre gradini dell’OMS bisogna considerare che sarà presto imprescindibile ricorrere
all’utilizzo di farmaci oppiacei e che se si manifestano componenti disestesiche o neuropatiche occorre
utilizzare i farmaci adiuvanti. In una parte dei casi ove non sia possibile gestire il dolore con la terapia
farmacologica tradizionale occorre ricorrere a pratiche di tipo specialistico.
Ci sono fattori che determinano diversità fra persona e persona nell’ assorbimento, distribuzione,
metabolismo ed eliminazione degli oppiacei. Tale diversità può determinare effetti osservabili diversi sia per
quanto attiene agli effetti analgesici sia per gli effetti collaterali. Questo fenomeno viene definito responsività
ed ha diverse origini. Ciò che è importante sottolineare a tale riguardo è il fatto che in assenza di una risposta
analgesica efficace deve essere sostituito il farmaco oppiaceo, variando, se necessario, anche la via di
somministrazione.
Questa pratica prende il nome di rotazione degli oppiacei e si attua qualora vi sia un rapporto negativo tra
efficacia analgesica ed effetti collaterali, o quando si presenti il fenomeno della tolleranza (all’aumento
progressivo del dosaggio non c’è copertura della soglia algica).
Ci sono pochi chiari criteri cui attenersi nell’impostazione e nel monitoraggio di una terapia analgesica nel
dolore oncologico:
Prevenzione della comparsa del dolore controllandolo con la somministrazione del farmaco a
intervalli prefissati.
Somministrazione del farmaco attraverso la via più razionale (di solito la via orale): ciò
semplifica anche il compito del caregiver.
Personalizzazione della farmacoterapia: il dosaggio, il tipo di farmaco e la via di
somministrazione devono essere scelti in base alle esigenze del singolo paziente
Gradualità dell’approccio terapeutico: dal 1986 l’OMS ha stilato la cosiddetta “scala analgesica a
tre gradini”, per descrivere un approccio farmacologico sequenziale proporzionato all’intensità del
dolore.
Prevenzione degli effetti collaterali legati alla terapia.
E’ decisivo controllare il dolore fin da quando si manifesta e uno stretto monitoraggio per implementare
rapidamente la terapia in caso di ricomparsa del dolore. Se il dolore è di intensità moderata-severa è
opportuno saltare il 2° gradino OMS (oppiacei per il dolore debole), passando direttamente a quello
successivo.
L’OMS e i dati di letteratura indicano come necessaria una titolazione dell’oppiaceo quando si decida di far
ricorso a questi farmaci. Tuttavia in questo caso il termine titolazione non ha lo stesso significato che nella
farmacologia clinica, dove ci si riferisce esclusivamente ad un progressivo incremento della dose. La
titolazione qui ha cinque fasi sequenziali da percorrere in pochi giorni:
1. ricerca della giusta dose giornaliera; se il paziente non è già in trattamento con oppiacei si può, ad
esempio utilizzare morfina a pronto rilascio per via orale, secondo il processo di titolazione
raccomandato dall’EAPC (European Association for Palliative Care).
a. 5 mg di morfina ogni 4 ore (se si utilizza morfina a pronto rilascio in gocce in soluzione
20‰ equivalgono a 4 gocce). Se il dolore è intenso la somministrazione può essere
anticipata, anche a ogni ora. Al paziente viene richiesto di misurare il dolore su una scala
numerica e di riportare il valore corrispondente su un foglio.
b. Al secondo giorno il medico, in base al sollievo o meno dal dolore, modifica la posologia
della singola assunzione di morfina (es. aumenta di 1-2 gocce nel caso il dolore sia ancora
presente oppure diminuisce di 1-2 gocce nel caso di efficacia della terapia). In genere sono
sufficienti alcuni giorni per conoscere la dose giornaliera in grado di controllare il dolore.
Tuttora nella pratica quotidiana vediamo che il primo farmaco prescritto è spesso invece una
preparazione transdermica a lento rilascio, eppure nel processo di titolazione non ne è
raccomandabile l’uso iniziale per il
ritardo nella comparsa dell’effetto analgesico. Le
preparazioni transdermiche andrebbero dunque riservate a pazienti con dolore controllato e
stabile.
I pazienti invece che sono già in trattamento con oppiacei devono iniziare con un dosaggio diverso di
nuovo oppiaceo e dunque bisogna far riferimento alle tabelle di equianalgesia dell’OMS che
esprimono per ogni oppiaceo la quantità di farmaco necessaria per ottenere lo stesso effetto
analgesico di un farmaco di riferimento (generalmente la morfina solfato per via orale). Per ottenere
l’effetto maggiore si incrementerà del 30-50% il valore ottenuto.
Codeina 30 mg
Divido per 10
Morfina = 3 mg
Tramadolo 100 mg
Divido per 5
Morfina = 20 mg
Morfina fiale 10 mg
Moltiplico per 3
Morfina = 30 mg
Oxicodone 5 mg
Moltiplico per 2
Morfina = 10 mg
Idromorfone 4 mg
Moltiplico per 5
Morfina = 20 mg
Buprenorfina 35 μg/h
-
Morfina = 60 mg/die
Fentanil 25 μg/h
-
Morfina = 60 mg/die
2. ricerca della giusta posologia; - considerato che è la farmacocinetica di un determinato farmaco a
dettare la posologia, va aggiunto che, nel caso del paziente oncologico, la posologia va adeguata alle
particolari esigenze del paziente in modo da ottenere il migliore effetto analgesico quantitativamente
e qualitativamente
3. ricerca della via ottimale di somministrazione;
4. controllo profilattico degli effetti indesiderati noti (presenti in quasi tutti i pazienti);
a. idratazione adeguata per evitare la disidratazione che innesca a per l’instaurarsi: nausea,
stipsi, vertigini, confusione mentale;
b. prevenzione della stipsi indotta da oppiacei (Opioid-Induced Constipation, OIC). la
somministrazione di un lassativo deve essere contemporanea alla prima prescrizione di un
oppiaceo.
c. nausea-vomito. In alcuni selezionati pazienti restii alla somministrazione di oppiaceo è bene
utilizzare in via profilattica un farmaco antinausea (metoclopramide, domperidone)
5. controllo di effetti collaterali che si manifestano su specifici pazienti (non sempre presenti). nausea e
vomito, prurito, sindromi vertiginose, senso di obnubilamento del sensorio, delirio, confusione
mentale. Occorre un trattamento specifico ed un controllo completo di questi segni e sintomi per
considerare conclusa la fase di titolazione
Dolore Episodico Intenso (DEI) o Breakthrough Pain (BP)
Aumento improvviso e imprevedibile del dolore, in un paziente già in trattamento e con dolore di base ben
controllato.
Esso può essere causato da movimenti (dolore incidente) oppure scatenato da colpi di tosse, distensione delle
vie urinarie o intestinali. In molti casi non viene identificata una causa (DEI idiopatico). La sede spesso è
quella del dolore di base, è prevalentemente notturno e la durata è breve. Si associa spesso ad ansia, nausea e
depressione. Il DEI mina fortemente la qualità di vita, quindi il suo trattamento è una priorità clinica ed etica
La letteratura è molto discordante in relazione alla prevalenza del DEI.
Il trattamento del DEI può essere effettuato aumentando il dosaggio del trattamento analgesico di base (e di
conseguenza ottenendo una maggior sedazione del paziente) oppure all’insorgere di esso con farmaci a
rapida azione (morfina fiale, fentanil transmucoso)