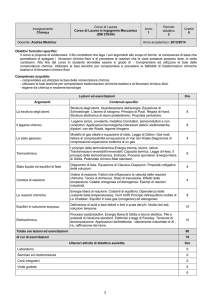
Insegnamento
Chimica inorganica e organica
Corso di Laurea
Corso di Laurea in Ingegneria Gestionale
(DM 270/04)
Docente: Marilena Tolazzi
Anno
2
Periodo
didattico
2
Crediti
6
Anno accademico: 2013/2014
Obiettivi formativi specifici:
Il Corso intende fornire allo studente le nozioni di base di chimica inorganica (proprietà chimiche degli elementi in relazione
alla loro posizione nel sistema periodico) e di chimica organica (classificazione, struttura e proprietà chimiche dei gruppi
funzionali organici). Le competenze corrispondenti sono: a) conoscenza della struttura elettronica e delle proprietà chimiche
degli elementi in base alla loro posizione nel sistema periodico; b) capacità di saper valutare la reattività chimica di un
composto chimico; c) capacità di orientarsi nella vasta nomenclatura organica e conoscenza delle reazioni principali dei
gruppi funzionali
Competenze acquisite:
- Conoscenza della struttura elettronica e delle proprietà chimiche degli elementi in base alla loro posizione nel sistema
periodico
- Capacità di saper valutare la reattività chimica di un composto chimico.
- Capacità di orientarsi nella vasta nomenclatura organica e conoscenza delle reazioni principali dei gruppi funzionali.
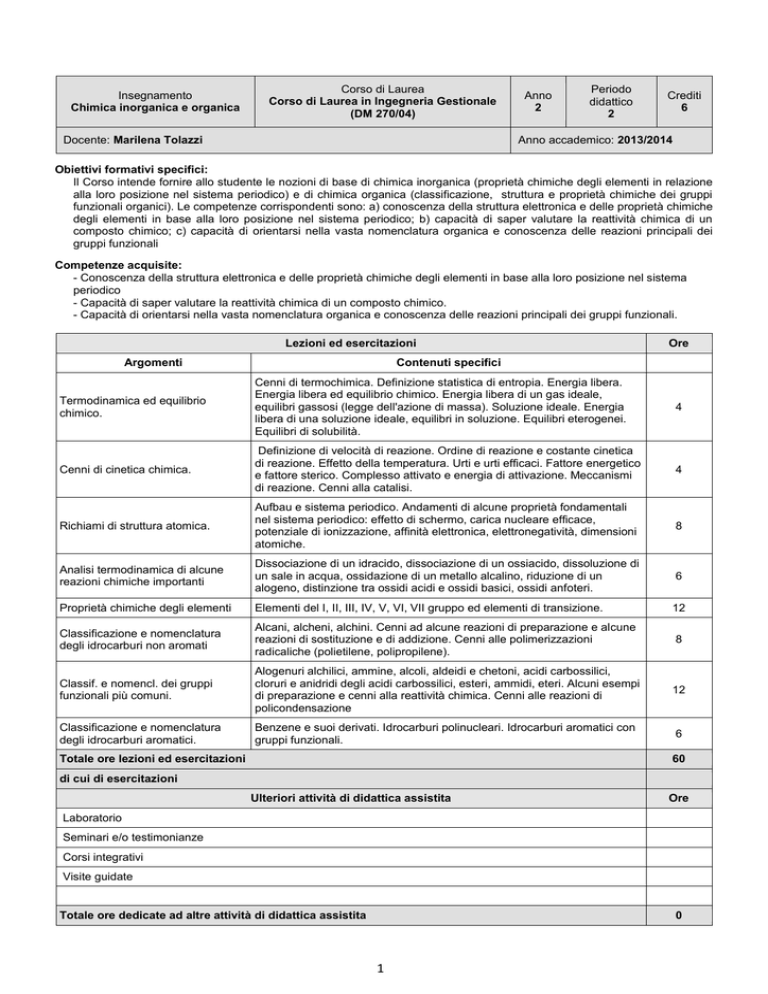
Lezioni ed esercitazioni
Argomenti
Ore
Contenuti specifici
Termodinamica ed equilibrio
chimico.
Cenni di termochimica. Definizione statistica di entropia. Energia libera.
Energia libera ed equilibrio chimico. Energia libera di un gas ideale,
equilibri gassosi (legge dell'azione di massa). Soluzione ideale. Energia
libera di una soluzione ideale, equilibri in soluzione. Equilibri eterogenei.
Equilibri di solubilità.
4
Cenni di cinetica chimica.
Definizione di velocità di reazione. Ordine di reazione e costante cinetica
di reazione. Effetto della temperatura. Urti e urti efficaci. Fattore energetico
e fattore sterico. Complesso attivato e energia di attivazione. Meccanismi
di reazione. Cenni alla catalisi.
4
Richiami di struttura atomica.
Aufbau e sistema periodico. Andamenti di alcune proprietà fondamentali
nel sistema periodico: effetto di schermo, carica nucleare efficace,
potenziale di ionizzazione, affinità elettronica, elettronegatività, dimensioni
atomiche.
8
Analisi termodinamica di alcune
reazioni chimiche importanti
Dissociazione di un idracido, dissociazione di un ossiacido, dissoluzione di
un sale in acqua, ossidazione di un metallo alcalino, riduzione di un
alogeno, distinzione tra ossidi acidi e ossidi basici, ossidi anfoteri.
6
Proprietà chimiche degli elementi
Elementi del I, II, III, IV, V, VI, VII gruppo ed elementi di transizione.
12
Classificazione e nomenclatura
degli idrocarburi non aromati
Alcani, alcheni, alchini. Cenni ad alcune reazioni di preparazione e alcune
reazioni di sostituzione e di addizione. Cenni alle polimerizzazioni
radicaliche (polietilene, polipropilene).
8
Classif. e nomencl. dei gruppi
funzionali più comuni.
Alogenuri alchilici, ammine, alcoli, aldeidi e chetoni, acidi carbossilici,
cloruri e anidridi degli acidi carbossilici, esteri, ammidi, eteri. Alcuni esempi
di preparazione e cenni alla reattività chimica. Cenni alle reazioni di
policondensazione
12
Classificazione e nomenclatura
degli idrocarburi aromatici.
Benzene e suoi derivati. Idrocarburi polinucleari. Idrocarburi aromatici con
gruppi funzionali.
6
Totale ore lezioni ed esercitazioni
60
di cui di esercitazioni
Ulteriori attività di didattica assistita
Ore
Laboratorio
Seminari e/o testimonianze
Corsi integrativi
Visite guidate
Totale ore dedicate ad altre attività di didattica assistita
0
1
Totale ore complessive
60
Modalità d'esame: Prova scritta
Testi consigliati:
- Lezioni ed Esercitazioni di Chimica. Autori: S.Brückner, V.Novelli, M.Tolazzi. Edizioni Forum, 2010, Udine
2