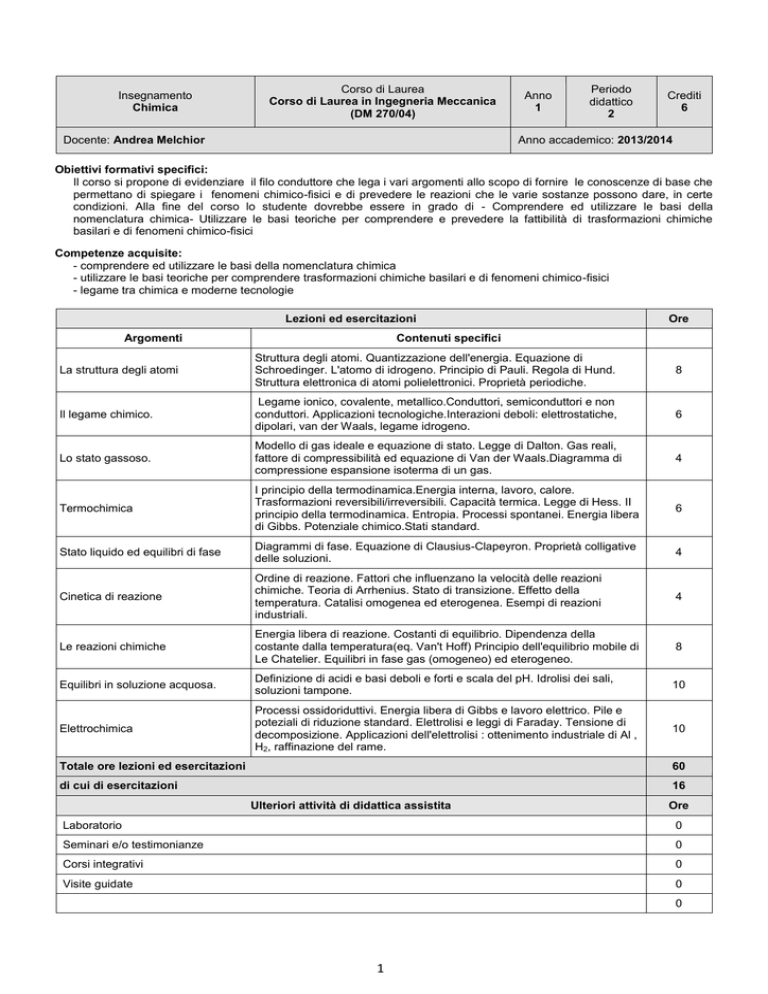
Insegnamento
Chimica
Corso di Laurea
Corso di Laurea in Ingegneria Meccanica
(DM 270/04)
Docente: Andrea Melchior
Anno
1
Periodo
didattico
2
Crediti
6
Anno accademico: 2013/2014
Obiettivi formativi specifici:
Il corso si propone di evidenziare il filo conduttore che lega i vari argomenti allo scopo di fornire le conoscenze di base che
permettano di spiegare i fenomeni chimico-fisici e di prevedere le reazioni che le varie sostanze possono dare, in certe
condizioni. Alla fine del corso lo studente dovrebbe essere in grado di - Comprendere ed utilizzare le basi della
nomenclatura chimica- Utilizzare le basi teoriche per comprendere e prevedere la fattibilità di trasformazioni chimiche
basilari e di fenomeni chimico-fisici
Competenze acquisite:
- comprendere ed utilizzare le basi della nomenclatura chimica
- utilizzare le basi teoriche per comprendere trasformazioni chimiche basilari e di fenomeni chimico-fisici
- legame tra chimica e moderne tecnologie
Lezioni ed esercitazioni
Argomenti
Ore
Contenuti specifici
La struttura degli atomi
Struttura degli atomi. Quantizzazione dell'energia. Equazione di
Schroedinger. L'atomo di idrogeno. Principio di Pauli. Regola di Hund.
Struttura elettronica di atomi polielettronici. Proprietà periodiche.
8
Il legame chimico.
Legame ionico, covalente, metallico.Conduttori, semiconduttori e non
conduttori. Applicazioni tecnologiche.Interazioni deboli: elettrostatiche,
dipolari, van der Waals, legame idrogeno.
6
Lo stato gassoso.
Modello di gas ideale e equazione di stato. Legge di Dalton. Gas reali,
fattore di compressibilità ed equazione di Van der Waals.Diagramma di
compressione espansione isoterma di un gas.
4
Termochimica
I principio della termodinamica.Energia interna, lavoro, calore.
Trasformazioni reversibili/irreversibili. Capacità termica. Legge di Hess. II
principio della termodinamica. Entropia. Processi spontanei. Energia libera
di Gibbs. Potenziale chimico.Stati standard.
6
Stato liquido ed equilibri di fase
Diagrammi di fase. Equazione di Clausius-Clapeyron. Proprietà colligative
delle soluzioni.
4
Cinetica di reazione
Ordine di reazione. Fattori che influenzano la velocità delle reazioni
chimiche. Teoria di Arrhenius. Stato di transizione. Effetto della
temperatura. Catalisi omogenea ed eterogenea. Esempi di reazioni
industriali.
4
Le reazioni chimiche
Energia libera di reazione. Costanti di equilibrio. Dipendenza della
costante dalla temperatura(eq. Van't Hoff) Principio dell'equilibrio mobile di
Le Chatelier. Equilibri in fase gas (omogeneo) ed eterogeneo.
8
Equilibri in soluzione acquosa.
Definizione di acidi e basi deboli e forti e scala del pH. Idrolisi dei sali,
soluzioni tampone.
10
Elettrochimica
Processi ossidoriduttivi. Energia libera di Gibbs e lavoro elettrico. Pile e
poteziali di riduzione standard. Elettrolisi e leggi di Faraday. Tensione di
decomposizione. Applicazioni dell'elettrolisi : ottenimento industriale di Al ,
H2, raffinazione del rame.
10
Totale ore lezioni ed esercitazioni
60
di cui di esercitazioni
16
Ulteriori attività di didattica assistita
Ore
Laboratorio
0
Seminari e/o testimonianze
0
Corsi integrativi
0
Visite guidate
0
0
1
Totale ore dedicate ad altre attività di didattica assistita
0
Totale ore complessive
60
Modalità d'esame: Prova scritta
Testi consigliati:
- "Chimica generale ed inorganica" Fusi - Bacchi - Giorni - Marchetti - Messori - Paoli - Punzo - Sortino - Tolazzi Editore:
Idelson – Gnocchi
- Schiavello, L. Palmisano “Fondamenti di chimica”, Edises, (Napoli, 3° Ed.)
- T. L. Brown, H. E. Le May Jr., B.E.Bursten, C.J. Murphy, P.M. Woodward, “Fondamenti di Chimica”, Edises (Napoli, 3°
Ed.)
- R.A. Michelin, A.Munari, Fondamenti di Chimica per le Tecnologie, Cedam, Padova
Ulteriore materiale didattico o informazioni reperibili al sito http://materialedidattico.uniud.it
2












