DAL PARTICOLARE AL GENERALE
Una diagnosi tardiva di mixoma atriale sinistro.
Come guadagnare tempo?
Ferdinando Maria Massari1, Tatiana Tonella1, Giuseppe Pomè2, Alessandra Di Mauro2, Claudio Clemente3,
Federico Lombardi1
1
U.O.C. Malattie Cardiovascolari, Fondazione Ospedale Maggiore Policlinico, Mangiagalli e Regina Elena, Università degli Studi, Milano
2
U.O. Cardiochirurgia, Istituto Clinico Sant’Ambrogio, Gruppo San Donato, Milano
3
Servizio di Anatomia Patologica e Citodiagnostica, IRCCS Policlinico San Donato, San Donato Milanese (MI)
A 56-year-old man presented to the Outpatient Cardiology Unit for dyspnea that had been lasting 6 months
and an occasional episode of cold perspiration on climbing a flight of stairs. In the suspicion of coronary artery disease, he was prescribed a complete blood panel, an echocardiogram and a treadmill stress test. The
echocardiogram, performed as late as 78 days after the first evaluation and only by chance scheduled 2 days
before the stress test, enabled a diagnosis of left atrial myxoma for which the patient successfully underwent
cardiac surgery. The authors discuss the aspecific and potentially misleading nature of myxoma symptoms and
highlight the latency between cardiological evaluation and diagnostic echocardiography.
Key words. Atrial myxoma; Echocardiography.
G Ital Cardiol 2016;17
INTRODUZIONE
Il mixoma atriale, pur essendo il più comune tra i tumori benigni del cuore – negli adulti circa il 50% di tutte le neoplasie
cardiache primitive – rimane pur sempre una patologia rara,
essendo stimata una incidenza compresa tra 0.0017% e
0.19% come reperto autoptico in autopsie non selezionate1,2
e in vivo dello 0.5 per milione di individui per anno3,4. Un recente studio di popolazione prospettico in tema di tumori cardiaci primitivi è quello condotto da Cresti et al.5 che nello specifico del mixoma atriale indica una incidenza di 0.65/100 000
abitanti/anno, con un’età media dei pazienti di 64 anni (range 13-86) e un rapporto maschi:femmine di 1:2.5. Per quanto concerne invece le recidive, queste vengono segnalate nel
3% dei casi nelle forme non familiari e dal 21% al 67% nelle
forme familiari6.
L’anamnesi e l’esame obiettivo, nella loro multiformità, in
prima battuta non consentono al medico di indirizzarsi verso
una diagnosi certa: il primo sospetto diagnostico è quasi sempre ecografico, anche se test di imaging di secondo livello con
tomografia computerizzata o risonanza cardiaca7 possono spesso rendersi necessari prima di proporre il paziente al cardiochirurgo.
L’ecocardiogramma, quale primo step diagnostico strumentale, risulta, tuttavia, raramente contestuale alla valutazione clinica ed elettrocardiografica a meno che il paziente non
giunga per eventi clinici acuti e/o ingravescenti in un Pronto
Soccorso dotato di cardiologo in grado anche di effettuare
l’esame.
© 2016 Il Pensiero Scientifico Editore
Ricevuto 16.11.2015; nuova stesura 28.12.2015; accettato 04.01.2016.
Gli autori dichiarano nessun conflitto di interessi.
Per la corrispondenza:
Dr. Ferdinando Maria Massari Via Caposile 8, 20137 Milano
e-mail: [email protected]
Talora accade che il paziente venga inviato ad altri specialisti diversi dal cardiologo, come ad esempio lo pneumologo o il
neurologo, per spiegare una dispnea o una sincope ritenuta di
tutt’altra origine, con un’ovvia perdita di tempo che può in via
teorica risultare anche foriera di eventi invalidanti o letali.
La vicenda clinica che viene descritta è emblematica dei
tempi anche lunghi che possono trascorrere tra il primo contatto medico-paziente e la definizione di una diagnosi peraltro
estremamente semplice da portare a conclusione: le riflessioni
che ne scaturiscono necessariamente vanno ben oltre la discussione della patologia tumorale in senso stretto.
CASO CLINICO
Storia clinica
In data 20/11/2014 veniva valutato presso gli ambulatori del
nostro ospedale un uomo di 56 anni, con familiarità positiva
per coronaropatia (un fratello), fumatore di 20 sigarette/die sino al 2009 e storia di pregressa ulcera duodenale in remissione da 4 anni. La visita cardiologica era stata prescritta per due
motivi: (a) una progressiva riduzione della soglia di comparsa
della dispnea da sforzo che ormai da 6 mesi era divenuta abituale, (b) un episodio di sudorazione algida occorsa nel settembre 2014 dopo aver percorso una rampa di scale.
Al momento della visita si rilevava una pressione arteriosa
pari a 120/80 mmHg, la frequenza cardiaca era 64 b/min,
l’obiettività e l’ECG risultavano normali. Si riporta testualmente la conclusione del verbale ambulatoriale: “Paziente in ritmo
sinusale e stabile compenso emodinamico. I sintomi riferiti sono meritevoli di approfondimento diagnostico con ecocardiogramma, ECG da sforzo e profilo lipidico in quanto sospetti per
equivalenti ischemici. Rivalutazione cardiologica con esito degli
esami richiesti”.
Le indagini furono prenotate dal paziente attraverso i canali ufficiali e gli appuntamenti vennero fissati a distanza di 78
G ITAL CARDIOL | VOL 17 | MARZO 2016
1
FM MASSARI ET AL
giorni dalla visita ambulatoriale laddove, del tutto occasionalmente, la data di esecuzione dell’ecocardiografia precedeva di
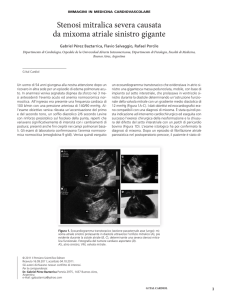
48h la data di esecuzione del test ergometrico. L’ecocardiogramma documentava una formazione occupante pressoché
totalmente la cavità atriale sinistra, peduncolata, mobile e aggettante nell’ostio mitralico ad ogni sistole atriale, tutti elementi
che portarono a formulare la diagnosi di mixoma (Figura 1).
In data 7/2/2015, entro 24h dal ricovero, veniva trasferito in
cardiochirurgia ove, previa coronarografia risultata negativa per
lesioni coronariche, venne sottoposto ad intervento chirurgico
di exeresi della massa atriale. L’approccio chirurgico prevedeva
un’atriotomia destra e successivamente, attraverso un’apertura di circa 3.5 cm a livello della fossa ovale, veniva repertata
una massa di consistenza gelatinosa parzialmente capsulata,
con doppia base di impianto, a livello della fossa ovale e del
tetto dell’atrio. La valvola mitrale appariva integra e normofunzionante, le vene polmonari e l’auricola non presentavano
residui al loro interno. L’immagine istologica è mostrata in Figura 2.
L’intervento è stato portato a termine con ottimo risultato
chirurgico e a distanza di 8 mesi la rivalutazione ecocardiografica non ha documentato una recidiva della patologia.
DISCUSSIONE
Il mixoma cardiaco trova localizzazione in atrio sinistro nel 7585% dei casi. In tale contesto, la sintomatologia è variabile e dipende dalle dimensioni, dalla struttura, dalla localizzazione e
dalla mobilità della massa intracavitaria; si riconosce una triade
di multiformi manifestazioni cliniche costituita da:
•
•
•
eventi embolici sistemici legati essenzialmente alla friabilità e documentati sino al 40% dei casi8-13;
sintomi legati all’ostruzione intracardiaca e nella fattispecie
dell’orifizio mitralico (50-67% dei casi): congestione polmonare anche secondaria a danno delle strutture mitraliche, aritmie, sincope sino alla morte improvvisa11,13-15;
sintomi a carattere sistemico come la perdita di peso (17%),
febbre (19%), mialgie/ artralgie (5%) e segni di infezioni ricorrenti14,16-23, il tutto collegato alla produzione di interleuchina-6 e di immunocomplessi costituiti da anticorpi contro
gli antigeni tumorali presenti in questi pazienti21.
I sintomi che vengono riferiti possono essere collegabili a
uno o più delle singole componenti la triade, derivandone che
la sola valutazione clinica non è sufficiente per giungere alla
diagnosi; addirittura il paziente può essere del tutto asintoma-
Figura 2. Le cellule del mixoma si dispongono in modo caratteristico ad anello in multistrato intorno ai vasi
che sono infiltrati da linfociti; lo stroma è diffusamente
mixoide con presenza di macrofagi e pigmento emosiderinico (ematossilina-eosina, 100x).
tico e il riscontro ecografico della neoformazione verificarsi del
tutto occasionalmente22.
Nonostante le numerose segnalazioni non emerge, tuttavia, dalla letteratura la quantificazione della latenza che sussiste tra primo contatto medico e diagnosi ecografica né, di conseguenza, si evincono proposte che consentano una contrazione dei tempi di diagnosi spesso troppo lunghi.
Il paziente visitato nel nostro ambulatorio denunciava una
sintomatologia dispnoica comparsa circa 6 mesi prima e interpretata, in corso di visita cardiologica, come equivalente ischemico; a suggerire tale ipotesi diagnostica anche l’episodio di
sudorazione algida insorta 2 mesi prima avendo affrontato una
rampa di scale.
A nostro parere correttamente, anche come sequenza, il
medico prescrisse gli esami ematochimici, l’ecocardiogramma e
il test da sforzo, indagini che, prenotate attraverso canali ufficiali, vennero fissate a distanza di 78 giorni dalla prima visita,
laddove del tutto occasionalmente la data di esecuzione dell’ecocardiografia precedeva di 2 giorni la data di esecuzione del
test ergometrico. Durante questo periodo il paziente ha continuato ad accusare una sintomatologia dispnoica sempre più invalidante, anche se ciò non lo ha spinto a contattare il proprio
medico di famiglia né a rivolgersi ad un Pronto Soccorso.
Dalla vicenda clinica ci pervengono tre messaggi: un messaggio di conferma, un messaggio di insegnamento ed un terzo messaggio relativo alle tematiche clinico-organizzative.
La ovvia conferma è che l’ecocardiografia risulta fondamentale per l’inquadramento del paziente che manifesta una
Figura 1. Immagine ecocardiografica della massa intra-atriale sinistra che durante la sistole atriale si impegna nell’orifizio valvolare mitralico (a sinistra).
2
G ITAL CARDIOL | VOL 17 | MARZO 2016
MIXOMA CARDIACO E RITARDO DIAGNOSTICO
sintomatologia di natura cardiopolmonare e, in un caso come
il mixoma, indispensabile e insostituibile per giungere a diagnosi vista la fallacità della semplice valutazione anamnestica,
clinica ed elettrocardiografica.
L’insegnamento è che, seppure si stia parlando di una patologia rara, nella diagnosi differenziale di un sintomo quale
può essere la sudorazione algida altrimenti non spiegata, la dispnea, la sincope o la palpitazione, occorre sempre tener presente la possibilità che possa trattarsi di un mixoma cardiaco
solitario.
Il terzo messaggio che si propone in discussione parte da
un’ipotesi: se il cardiologo che in prima istanza ha effettuato
la visita, pur avanzando il sospetto di coronaropatia, avesse
avuto a disposizione un ecografo in ambulatorio anche solo
per un’ecoscopia, la diagnosi di mixoma sarebbe stata contestuale alla visita stessa e di conseguenza sarebbe stato immediato l’invio del paziente in cardiochirurgia, una “immediatezza” che certo si è realizzata, ma solo a distanza di oltre 2
mesi durante i quali il paziente è rimasto esposto a tutte le
possibili complicanze collegate con le caratteristiche del tumore.
È ormai assodato che lo sviluppo di apparecchiature sempre
di minore dimensione, ma certo non di minore affidabilità, ha
permesso di portare la metodica fuori dalla sala di ecocardiografia, al letto del malato: con il termine focus assessed transthoracic echocardiography (FATE), si vuole indicare quel particolare approccio che, con un rapporto tempo/informazione
favorevole, ha lo scopo di rispondere ad un preciso dubbio o
quesito clinico nel contesto di una patologia nota o in via di
definizione, quindi per impostare o rivedere la diagnosi e il secondario trattamento, il tutto in un lasso cronologico assolutamente rapido24-26. È anche vero tuttavia che tale modus operandi oggi come oggi è previsto in un contesto di urgenza/emergenza ma non in un qualsivoglia ambulatorio di cardiologia, in altri termini non è prevista la sequenza visita-ECGecocardiogramma in concomitanza alla valutazione ambulatoriale, sia pure essa “prima visita”.
Nel documento di consenso sull’appropriatezza dell’ecografia e la definizione delle classi di priorità stilato dalla Società Italiana di Ecografia Cardiovascolare, il nostro paziente rientrava nella classe IB: vale a dire, utilità certa dell’ecografia ed
esame da effettuarsi entro 60 giorni secondo gli auspicati criteri “clinici”, a fronte dei 78 giorni realmente trascorsi essendo stato fissato l’appuntamento secondo gli abituali criteri
“cronologici”27.
Le linee guida dell’ASL Milano sull’appropriato utilizzo delle indagini diagnostiche cardiovascolari28, per ovvi motivi di po-
litica ed economia sanitaria, in assenza di cardiopatia nota, senza indicare una tempistica, indicano di “prescrivere” (quindi
non “eseguire” al momento della visita) un ecocardiogramma
“solo se presenza di sintomi e/o segni con alte probabilità di
patologia cardiaca identificabile con l’esame e in presenza di
sintomi cardiorespiratori (cardiopalmo, angina, dispnea, sincope) o soffio cardiaco”.
Per la valutazione del rischio cardiovascolare, nello stesso
documento, l’ecocardiogramma viene previsto negli ipertesi ma
non negli anginosi ai quali è riservato solo l’ECG e l’ECG da
sforzo; l’ecocardiografia di routine non è neppure considerata
preliminarmente ad un test ergometrico come invece, a nostro
avviso correttamente, è stato effettuato, evitando in tal modo
facili ma imprevedibili inconvenienti durante l’esecuzione della
prova da sforzo.
A sostegno di quanto riportato nel documento, vengono
chiamati in causa i costi generali aumentati, il costo dell’ecografia stessa ritenuta a torto bassa, le liste di attesa molto lunghe, l’inutilità del 15-18% degli esami effettuati, il fatto che il
29% delle ecografie è stata effettuata senza una preliminare visita cardiologica con ECG, la possibilità che da minime alterazioni ecocardiografiche possa scaturire tutta una catena di ulteriori indagini anche invasive.
Non è facile dunque giungere ad una univoca conclusione
tanto più che nella carriera di un cardiologo trovarsi di fronte ad
un paziente con mixoma è un’occasione rara se non unica: un
singolo caso clinico ovviamente non fa testo, ma è anche vero
che si può trovare in esso lo spunto per un approfondimento
della questione così da coniugare un’efficienza ottimale a costi
sostenibili, nell’ottica di una massima garanzia in primis per il
paziente ma anche per il medico, comunque sempre esposto a
problematiche di responsabilità professionale.
RIASSUNTO
Un uomo di 56 anni veniva valutato ambulatoriamente per dispnea
presente da 6 mesi e un episodio di sudorazione algida occorso 2
mesi prima salendo una rampa di scale. Nel sospetto di coronaropatia, venivano prescritti ematochimica, ecocardiogramma e test
ergometrico. L’ecografia, effettuata dopo 78 giorni dalla prima visita e solo occasionalmente programmata 2 giorni prima del test ergometrico, permise di porre diagnosi di mixoma atriale sinistro per
il quale il paziente venne sottoposto con successo ad intervento
cardiochirurgico. Gli autori discutono la tipologia dei sintomi che da
soli non indirizzano la diagnosi e la latenza tra la prima visita e
l’ecocardiografia indispensabile per tale scopo.
Parole chiave. Ecocardiografia; Mixoma atriale.
BIBLIOGRAFIA
1. Reynen K. Cardiac myxomas. N Engl J
Med 1995;333:1610-7.
2. McAlister HA Jr, Fenoglio JJ Jr. Tumors
of the cardiovascular system. Atlas of tumor
pathology. 2nd series. Washington, DC:
Armed Forces Institute of Pathology, 1978:
1-20.
3. Odim J, Reehal V, Laks H, Mehta U, Fishbein MC. Surgical pathology of cardiac tumors. Two decades at an urban institution.
Cardiovasc Pathol 2003;12:267-70.
4. Molina JE, Edwards JE, Ward HB. Primary cardiac tumors: experience at the Uni-
versity of Minnesota. Thorac Cardiovasc
Surg 1990;38(Suppl 2):183-91.
5. Cresti A, Chiavarelli M, Glauber M, et
al. Incidence rate of primary cardiac tumors:
a 14-year population study. J Cardiovasc
Med 2016;17:37-43.
6. Mendoza C, Bernstein E, Ferreira A.
Multiple recurrences of nonfamilial cardiac
myxomas: a report of two cases. Tex Heart
Inst J 2007;34:236-9.
7. Fussen S, De Boeck BW, Zellweger MJ,
et al. Cardiovascular magnetic resonance
imaging for diagnosis and clinical manage-
ment of suspected cardiac masses and tumours. Eur Heart J 2011;32:1551-60.
8. Bjessmo S, Ivert T. Cardiac myxoma: 40
years’ experience in 63 patients. Ann Thorac Surg 1999;63:697-700.
9. Blondeau P. Primary cardiac tumors French studies of 533 cases. Thorac Cardiovasc Surg 1990;38(Suppl 2):192-5.
10. Silverman J, Olwin JS, Graettinger JS.
Cardiac myxomas with systemic embolization. Review of the literature and report of
a case. Circulation 1962;26:99-103.
11. St John Sutton MG, Mercier lA, GiuG ITAL CARDIOL | VOL 17 | MARZO 2016
3
FM MASSARI ET AL
liani ER, Lie JT. Atrial myxomas: a review of
clinical experience in 40 patients. Mayo Clin
Proc 1980;55:371-6.
12. Jones DR, Warden HE, Murray GF, et
al. Biatrial approach to cardiac myxomas: a
30-year clinical experience. Ann Thorac
Surg 1995;59:851-6.
13. Goodwin JF. The spectrum of cardiac
tumors. Am J Cardiol 1968;21:307-14.
14. Aldridge HE, Greenwood WF. Myxoma
of the left atrium. Br Heart J 1960;22:189200.
15. Annoni A, Tomasoni L, Cellino F, et al.
Il mixoma atriale: un caso con inusuale esordio clinico e revisione della letteratura. Cardiol Sci 2014;9:209-11.
16. McCoskey EH, Metha JB, Krishnan K,
Roy TM. Right atrial myxoma with extracardiac manifestations. Chest 2000;118:547-9.
17. Murphy MC, Sweeney MS, Putman JB
Jr, et al. Surgical treatment of cardiac tumors: a 25-year experience. Ann Thorac
Surg 1990;49:612-7.
18. Fitzpatrick AP, Lanham JG, Doyle DV.
Cardiac tumors simulating collagen vascular disease. Br Heart J 1986;55:592-5.
4
G ITAL CARDIOL | VOL 17 | MARZO 2016
19. Thomas MH. Myxoma masquerading
as polyarteritis nodosa. J Rheumatol 1981;
8:133-7.
20. Huston KA, Comb JJ Jr, Lie JT, Giuliani
ER. Left atrial myxoma simulating peripheral vasculitis. Mayo Clin Proc 1978;53:7526.
21. Krikler DM, Rode J, Davies MJ, Woolf
N, Moss E. Atrial myxoma: a tumor in
search of its origins. Br Heart J 1992;67:8991.
22. Wrisley D, Rosenberg J, Giambartolomei A, Levy I, Turiello C, Antonini T. Left
ventricular myxoma discovered incidentally
by echocardiography. Am Heart J 1991;
121:1554-5.
23. Scrofani R, Carro C, Villa L, Botta M,
Antona C. Il mixoma cardiaco: risultati chirurgici e follow-up clinico a 15 anni. Ital Heart J Suppl 2002;3:753-8.
24. Labovitz AJ, Noble , VE, Bierig M, et
al.; American Society of Echocardiography.
Consensus Statement. Focused cardiac ultrasound in the emergent setting: a consensus statement of the American Society
of Echocardiography and American College
of Emergency Physicians. J Am Soc Echocardiogr 2010;23:1225-30.
25. Shah SB, Ahmadvazir S, Pabla JS,
Zacharias K, Senior R. The role of urgent
transthoracic echocardiography in the evaluation of patients presenting with acute
chest pain. Eur J Emerg Med 2012;19:27783.
26. Blyth L, Atkinson P, Gadd K, Lang E.
Bedside focused echocardiography as predictor of survival in cardiac arrest patients: a
systematic review. Acad Emerg Med 2012;
19:1119-26.
27. Mandorla S, Trambaiolo P, De Cristofaro M, Baldassini M, Penco M. Appropriatezza dell’esame ecocardiografico e definizione delle classi di priorità: una proposta
della Società di Ecografia Cardiovascolare.
G Ital Cardiol 2010;11:503-33.
28. Linee Guida per l’appropriato utilizzo
della diagnostica cardiovascolare. Regione
Lombardia ASL Milano 1 http://www.
aslmi1.mi.it/modulistica/doc_view/2800lg-appropriato-utilizzo-della-diagnosticacardiovascolare.html [ultimo accesso 15
aprile 2016].