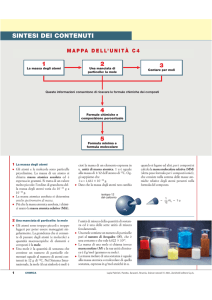
LA CENTRALITA’ DELLA MOLE.
DEFINIZIONI:
1) la MOLE è la quantità di sostanza che contiene tante particelle quanti sono gli atomi contenuti in 12
grammi di carbonio -12 (definizione del SI);
2) la MOLE è la quantità di sostanza che contiene un numero di Avogadro (NA = 6, 022 x 1023
particelle/mol) di particelle (atomi, molecole…);
3) la MOLE è il peso atomico o molecolare espresso in grammi.
DAI GRAMMI DI SOSTANZA ALLE MOLI:
n
g
PM
DALLE MOLI AI GRAMMI DI SOSTANZA: g n PM
DETERMINAZIONE DELLA FORMULA CHIMICA DI UN COMPOSTO.
a) Si determina sperimentalmente la % in massa degli elementi che costituiscono il composto di cui si
vuole trovare la formula.
b) Si divide ogni % per il peso atomico dell’elemento al quale si riferisce.
c) Si dividono i quozienti ottenuti per il più piccolo di essi; i risultati che si ottengono vengono
arrotondati e costituiscono gli indici della cosiddetta FORMULA MINIMA (indica il più semplice
rapporto espresso con numeri interi secondo cui gli atomi dei vari elementi sono presenti nella
molecola).
d) Si determina sperimentalmente il PM del composto e di calcola il PM corrispondente alla formula
minima.
e) Si divide il PM sperimentale per il PM della formula minima ottenendo un numero che va
moltiplicato per tutti gli indici della formula; si ottiene così la vera formula chimica o FORMULA
MOLECOLARE del composto in esame.
ESEMPIO:
a) L’analisi di un composto ternario avente PM = 180 u ha fornito i seguenti risultati (composizione % in
massa):
C = 40%
H = 7%
O = 53%
b) Utilizzando i valori dei PA arrotondati all’unità:
C = 40 / 12 = 3,3
H=7/1=7
O = 53 / 16 = 3,3
quoziente più piccolo
c) Carbonio 3,3 / 3,3 = 1
Idrogeno 7 / 3,3 = 2
Ossigeno 3,3 / 3,3 = 1
d – e)
------->
------->
------->
1 atomo di C
2 atomi di H
1 atomo di O
Calcolo PM CH2O = 12 + 2 x 1 + 16 = 30 u
PMcomposto
180 u
=
PM CH2O
= 6
30 u
FORMULA MOLECOLARE
C6H12O6
FORMULA MINIMA CH2O