SINTESI DEI CONTENUTI
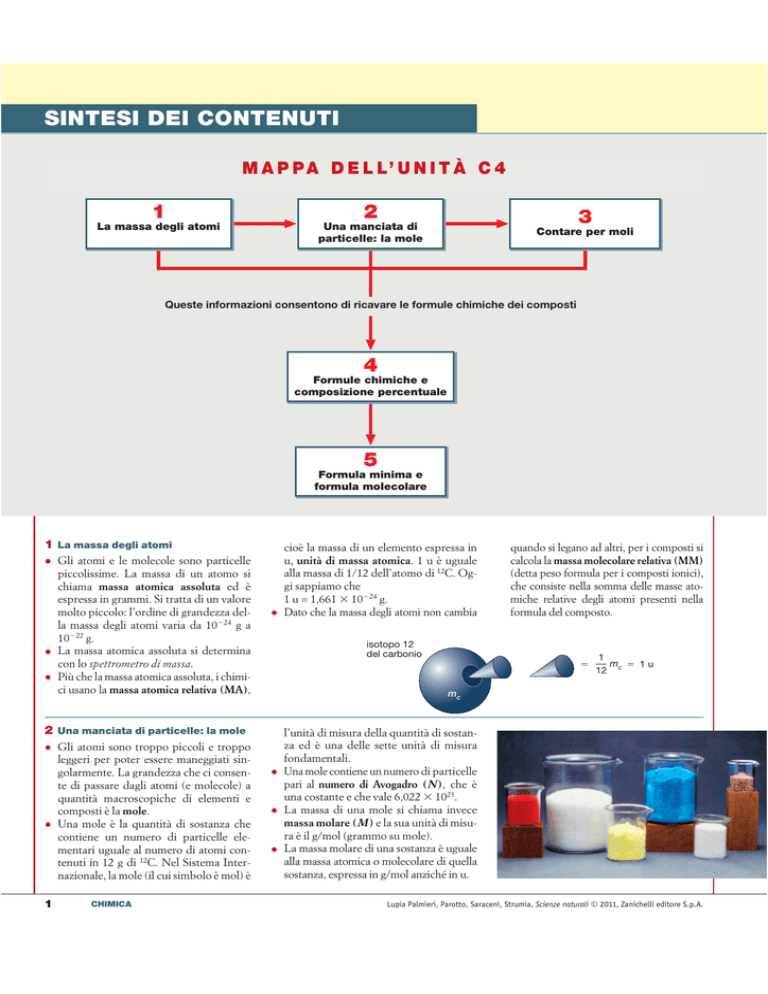
M A P P A D E L L’ U N I T À C 4
1
2
La massa degli atomi
Una manciata di
particelle: la mole
3
Contare per moli
Queste informazioni consentono di ricavare le formule chimiche dei composti
4
Formule chimiche e
composizione percentuale
5
Formula minima e
formula molecolare
1 La massa degli atomi
• Gli atomi e le molecole sono particelle
•
•
piccolissime. La massa di un atomo si
chiama massa atomica assoluta ed è
espressa in grammi. Si tratta di un valore
molto piccolo: l’ordine di grandezza della massa degli atomi varia da 1024 g a
1022 g.
La massa atomica assoluta si determina
con lo spettrometro di massa.
Più che la massa atomica assoluta, i chimici usano la massa atomica relativa (MA),
•
isotopo 12
del carbonio
• Gli atomi sono troppo piccoli e troppo
•
1
CHIMICA
quando si legano ad altri, per i composti si
calcola la massa molecolare relativa (MM)
(detta peso formula per i composti ionici),
che consiste nella somma delle masse atomiche relative degli atomi presenti nella
formula del composto.
1
m 1u
12 c
mc
2 Una manciata di particelle: la mole
leggeri per poter essere maneggiati singolarmente. La grandezza che ci consente di passare dagli atomi (e molecole) a
quantità macroscopiche di elementi e
composti è la mole.
Una mole è la quantità di sostanza che
contiene un numero di particelle elementari uguale al numero di atomi contenuti in 12 g di 12C. Nel Sistema Internazionale, la mole (il cui simbolo è mol) è
cioè la massa di un elemento espressa in
u, unità di massa atomica. 1 u è uguale
alla massa di 1/12 dell’atomo di 12C. Oggi sappiamo che
1 u = 1,661 1024 g.
Dato che la massa degli atomi non cambia
•
•
•
l’unità di misura della quantità di sostanza ed è una delle sette unità di misura
fondamentali.
Una mole contiene un numero di particelle
pari al numero di Avogadro (N ), che è
una costante e che vale 6,022 1023.
La massa di una mole si chiama invece
massa molare (M ) e la sua unità di misura è il g/mol (grammo su mole).
La massa molare di una sostanza è uguale
alla massa atomica o molecolare di quella
sostanza, espressa in g/mol anziché in u.
Lupia Palmieri, Parotto, Saraceni, Strumia, Scienze naturali © 2011, Zanichelli editore S.p.A.
3 Contare per moli
• La grandezza che consente di effettuare
•
•
• Per calcolare il numero di particelle, Np,
presenti in un numero di moli n si deve
moltiplicare questo numero per il numero di Avogadro, N.
Np n N
il calcolo delle masse dei reagenti coinvolti in una reazione è la mole.
Conoscendo il numero (n) di moli necessarie per la reazione e la massa molare
(M) dei composti è possibile ricavare la
massa (m) espressa in grammi da impiegare in laboratorio. Infatti, m n M
Il numero di moli si ricava dividendo la
massa di un reagente per la sua massa
molare:
m
n M
1 mole contiene
6,022 1023 particelle
4 Formule chimiche e composizione
percentuale
•
•
•
•
Ogni composto è caratterizzato da una
formula chimica che evidenzia il rapporto di combinazione tra gli atomi che costituiscono quella sostanza.
I simboli della formula chimica indicano
quali elementi sono presenti nella molecola o nel reticolo ionico; gli indici indicano quanti atomi di quell’elemento sono presenti.
Ogni elemento possiede una propria
massa caratteristica che contribuisce alla
massa molecolare (o al peso formula) in
una misura che dipende dal numero di
atomi di quell’elemento presenti nella
formula del composto.
La composizione percentuale di un
composto permette di mettere in relazione il rapporto tra le masse degli elementi
5 Formula minima e formula
molecolare
• I dati necessari per determinare la for-
•
•
mula chimica di un composto si ricavano
da un procedimento sperimentale chiamato analisi.
Le analisi chimiche più sofisticate vengono realizzate tramite lo spettrometro di
massa, che fornisce la composizione percentuale del campione e la massa molecolare. Queste informazioni sono sufficienti per determinare la formula minima e la formula molecolare del composto in esame.
La formula minima di un composto indica il rapporto minimo di combinazione tra gli atomi di una molecola o di un
composto ionico.
•
• I coefficienti nelle equazioni chimiche
non indicano solo il numero di molecole
di reagenti e prodotti, ma anche il numero di moli coinvolte nella reazione.
1/2 mole contiene
3,011 1023 particelle
2 moli contengono
12,044 1023 particelle
che si combinano e il numero di atomi
presenti nella formula chimica della sostanza.
Per calcolare la composizione percentuale si procede in questo modo:
– Si calcola la massa molecolare (MM)
del composto.
– Si imposta una proporzione per determinare la percentuale rappresentata da ciascun elemento nella formula
del composto. MA : MM x : 100
– Si sostituiscono i valori noti in questa
proporzione. Si calcola la x, cioè il valore percentuale di quell’elemento nel
composto.
– Si ripete lo stesso passaggio per tutti
gli elementi presenti nel composto.
• Per determinare la formula minima si
opera nel modo seguente:
– si scrive la massa (m) espressa in
grammi di ciascun elemento che si
trovano in 100 g di composto, ricavandola dalla composizione percentuale.
– Si calcola il numero di moli (n) di
ciascun elemento dividendo la massa di ciascun elemento per la sua
massa molare (M).
– Si sceglie il numero di moli minore e
per esso si dividono tutti i valori n
calcolati.
– I valori ottenuti sono gli indici della
formula minima e si scrivono in basso a destra del simbolo di ogni elemento.
Lupia Palmieri, Parotto, Saraceni, Strumia, Scienze naturali © 2011, Zanichelli editore S.p.A.
Na 30,9 g
ⴙ
Cl 47,6 g
ⴙ
O2 21,5 g
ⴝ
NaClO 100 g
• La formula molecolare indica l’esatto
•
numero di atomi dei diversi elementi
che si combinano tra loro in una molecola del composto.
La formula molecolare è un multiplo
della formula minima ricavata dall’analisi. La si determina conoscendo la
massa molecolare (MM) del composto.
25,4%
Al
P
O
52,5%
22,1%
U N I T À C4• La quantità di materia: la mole
2












