ASSE IPOTALAMO-IPOFISI-TESTICOLO
INTRODUZIONE
L’apparato genitale maschile (vedi figura 1) è essenziale per il mantenimento della
specie attraverso due funzioni essenziali: la gametogenesi e la funzione sessuale. Per quanto
riguarda la prima, risulta importante la funzione endocrina del testicolo, che comprende un
sistema integrato di regolazione tra il sistema nervoso centrale, l’ipofisi anteriore ed il
testicolo.
L’ipotalamo, attraverso la secrezione pulsatile dell’ormone rilasciante le
gonadotropine (GnRH), controlla la secrezione ipofisaria dell’ormone follicolo-stimolante
(FSH) e dell’ormone luteinizzante (LH) i quali a loro volta stimolano il testicolo a produrre il
testosterone, che assieme ai suoi metaboliti (diidrotestosterone ed estradiolo) e all’inibina
prodotta dalle cellule di Sertoli, esercitano un controllo retrogrado sull’ipofisi inibendo la
produzione di LH ed FSH, rispettivamente (figura 2).
Il testicolo è costituito da due
compartimenti distinti funzionalmente: 1) il compartimento tubulare dove si trovano le cellule
di Sertoli deputate principalmente alla regolazione della spermatogenesi e 2) il compartimento
interstiziale dove si trovano le cellule di Leydig deputate alla produzione di testosterone
(figura 2). Quest’ultimo è l’androgeno più importante ed è responsabile dell’inizio, dello
sviluppo e del mantenimento dei caratteri sessuali primari e secondari. Il testosterone svolge
un ruolo importante nel determinare un normale comportamento sessuale ed una normale
frequenza di erezioni spontanee e di atti sessuali (1).
Come vedremo successivamente, il testicolo umano è sede di importanti interazioni tra
cellule diverse coinvolgenti sia i meccanismi paracrini che quelli autocrini; in questa piccola
ghiandola endocrina (la cui misura è nell’adulto di circa 5 x 3 cm; volume di 16-30 ml e peso
di 10-14 g) due gruppi di cellule differenti interagiscono tra loro: cellule somatiche (cellule di
Leydig, cellule di Sertoli, e cellule mioidi) e le cellule germinali. Le cellule testicolari
collaborano tra loro nella realizzazione dei principali processi deputati alla steroidogenesi e
gametogenesi umana.
SPERMATOGENESI
Il sistema riproduttivo dell’uomo è costituito dall’asse endocrino ipotalamoadenoipofisi-testicolo (fig. 2) La riproduzione sessuale comporta un processo molto
complesso per il testicolo e l’ovaio. Per la specie umana i sistemi riproduttivi possiedono una
duplice funzione:
a) funzione endocrina, rappresentata dalla secrezione di ormoni steroidei (funzione
steroidogenetica) di natura androgenica per l’uomo ed estrogeno-progestinica per la
donna;
b) funzione gametogenetica, rappresentata dalla produzione di cellule germinali
(spermatozoi per l’uomo e cellule uovo per la donna).
Cellule germinali e spermatogenesi
La spermatogenesi è un complesso processo di proliferazioni e modificazioni cellulari
concernenti l’epitelio germinale del testicolo e che culmina con la produzione degli
spermatozoi. Gli spermatozoi lasciano i tubuli seminiferi (attraverso la rete testis, l’epididimo
e il vaso deferente) e raggiungono le vescichette seminali che, con le loro caratteristiche
secrezioni, contribuiscono alla formazione di gran parte del volume finale dell’eiaculato (2).
La spermatogenesi è un processo «unico», i cui tempi e stadi di differenziazione
cellulare sono abbastanza conosciuti. Durante la spermatogenesi l’epitelio germinale
interviene con una duplice funzione nel produrre gli spermatozoi: a) genera milioni di
spermatozoi ogni giorno (ogni testicolo umano produce 123 ± 18 x 106 spermatozoi/giorno);
b) rimpiazza, di continuo, gli spermatogoni, la popolazione cellulare che dà inizio al processo.
Questo richiede un processo di replicazione cellulare tale da garantire sia un insieme di cellule
indifferenziate di riserva, sia una popolazione di cellule destinate a una completa
differenziazione culminante con la produzione degli spermatozoi. Lo spermatozoo è tra le
cellule più piccole dell’uomo: è lungo circa 50 mm, ossia circa la metà del diametro
dell’oocita completamente sviluppato (circa 120 mm), la cellula più grande dell’organismo
femminile, e ha un volume che è circa 1/100.000 di quello dell’uovo. Lo spermatozoo è
composto da tre parti principali a cui corrispondono altrettante funzioni: a) la testa contiene il
materiale genico (aploide) e svolge la funzione di attivazione; b) la parte intermedia è sede del
metabolismo; c) la coda è il centro motorio della cellula. La spermatogenesi inizia con la
pubertà e continua per quasi tutta la vita dell’uomo; l’inizio di questo processo si accompagna
alla maturazione funzionale dei testicoli. La concentrazione del testosterone plasmatico
incrementa a partire dalla pubertà e raggiunge i livelli tipici dell’adulto dopo il 17° anno;
questi livelli rimangono costanti sino al 70°-80° anno di vita e decrescono rapidamente dopo
l’80° anno. La produzione dello sperma ha un andamento con l’età (a partire dalla pubertà)
molto ben correlato con la dinamica del testosterone plasmatico. La spermatogenesi inizia
con gli spermatogoni, che sono di due tipi principali:
a) lo spermatogonio «A», che genera altri spermatogoni;
b) lo spermatogonio «B», che sarà quello sottoposto a maturazione.
Gli spermatogoni assolvono al compito di cellule indifferenziate. La maggior parte di
queste cellule va incontro a una continua divisione mitotica (spermatogoni A) fornendo al
testicolo un compartimento di cellule staminali rinnovabili. Tali cellule rimangono nel
compartimento esterno o basale del tubulo seminifero. Una piccola parte degli spermatogoni,
quelli di tipo B, va incontro a un processo di divisione meiotica (la meiosi è un processo che
interessa esclusivamente le cellule germinali) e successiva maturazione (spermiogenesi) con
formazione degli spermatozoi. Il processo di meiosi si concretizza con la riduzione del
normale numero dei cromosomi, 46 (cellula diploide - spermatogonio), alla metà di tale
numero, 23 (cellula aploide - spermatide). Affinché lo spermatozoo abbia una sua tipica
mobilità è indispensabile la coda, una struttura capace di generare movimenti lineari e
ondulatori. Tale struttura è stata denominata «ciglio», si è sempre conservata durante la
filogenesi ed è molto simile in tutte le specie animali, dal più basso organismo all’uomo. Lo
spermatozoo presenta pertanto tutte le caratteristiche generali di una cellula specializzata alla
progressione. In molte specie inferiori la spermatogenesi è un fenomeno sincrono in ogni
parte del tubulo seminifero ed è facile osservare associazioni di singole cellule che variano in
tipologia secondo la specie (2). Ogni associazione cellulare contiene 4 o 5 tipi di cellule
germinali organizzate in un modello stratificato specifico; ogni strato rappresenta una
generazione cellulare. Viene definita «durata del ciclo dell’epitelio seminifero» il tempo
richiesto affinché una serie completa di associazioni cellulari diverse compaia in un dato
punto di un dato tubulo seminifero. La durata di un ciclo dipende dal turnover cellulare degli
spermatogoni. Nel ratto questo processo di maturazione è diviso in 14 tappe, ciascuna delle
quali è correlata con una specifica associazione cellulare (una contigua all’altra). Tutto ciò
non vale per la specie umana, in cui il processo della spermatogenesi è asincrono e le diverse
associazioni cellulari sembrano mescolate tra loro in modo del tutto casuale; tale
asincronismo dei processi di maturazione delle cellule germinali ha reso molto difficile la
valutazione quantitativa della spermatogenesi. La spermatogenesi umana avviene in 6 tappe
distinte; un ciclo completo ha luogo in circa 16 giorni mentre, per arrivare a una
spermatogenesi matura, sono necessari 4,5 cicli (74 ± 5 giorni). Una volta completata la
spermatogenesi, gli spermatozoi maturi vengono liberati nel lume del tubulo seminifero
(spermiazione) e trasportati, passivamente, dal fluido alla rete testis, ai dotti efferenti e
all’epididimo, dove subiscono ulteriori modificazioni maturative indispensabili per
raggiungere e fecondare la cellula uovo. Quando gli spermatozoi passano all’interno
dell’epididimo acquistano due caratteristiche fondamentali:
a) motilità rettilinea progressiva;
b) capacità fertilizzante.
Quando gli spermatozoi passano nella testa dell’epididimo diventano, per la prima
volta, attivamente mobili (processo che richiede l’esposizione delle cellule dell’epididimo agli
ormoni androgeni) mentre, nel corpo e nella coda epididimale, si realizza la rimanente
maturazione degli spermatozoi. Per poter transitare nei dotti deferenti gli spermatozoi
impiegano, mediamente, 12 giorni. Ciascun eiaculato contiene tre tipi diversi di spermatozoi:
normali, anormali e immaturi. In un uomo giovane la produzione spermatica è di circa 7
milioni di spermatozoi per giorno per grammo; dalla 5a alla 9a decade di vita decresce di
circa la metà, per arrivare a circa 3,5 milioni per giorno per grammo. Per quanto riguarda gli
spermatozoi non eiaculati, si pensa che una parte siano ingeriti dai macrofagi oppure
riassorbiti localmente o che passino nelle urine. Dopo l’eiaculazione gli spermatozoi
acquisiscono la capacità di fecondare (penetrazione all’interno del gamete femminile),
attraverso il processo di «capacitazione» che avviene durante il cammino nel tratto
riproduttivo femminile (3).
Cellule di Sertoli
Le cellule di Sertoli costituiscono la ‘spina dorsale’ dei tubuli seminiferi. Queste cellule
sono «posate» sulla lamina basale e sono legate l’una all’altra da complessi giunzionali
specializzati vicini alla zona basale di ogni cellula. Generalmente le cellule di Sertoli hanno
aspetto cilindrico, un nucleo basale «trilobato», con un nucleolo prominente localizzato al
centro. La cellula di Sertoli è l’unica cellula somatica presente nel tubulo seminifero. Per
quanto concerne l’epitelio germinativo del tubulo seminifero, la cellula di Sertoli svolge
numerose funzioni (2).
I fattori che regolano la funzione della cellula di Sertoli sono diversi; i principali sono
tre: a) regolazione endocrina da parte dell’FSH; b) regolazione paracrina da parte del
testosterone e c) regolazione autocrina da fattori prodotti dalla cellula di Sertoli stessa. La
cellula di Sertoli viene stimolata primariamente dall’FSH che, attraverso l’attivazione
dell’adenilatociclasi (produzione di AMPc), stimola la cellula a produrre il 17-estradiolo
(E2) da precursori steroidei androgenici (attraverso l’attivazione dell’enzima «aromatasi») e a
sintetizzare le proteine specifiche del testicolo (ABP e inibina) e le proteine non specifiche
(transferrina, somatomedina C, ceruloplasmina, attivatore del plasminogeno, vitamina A,
insulina, beta-endorfina, ecc.). Anche le cellule mioidi svolgono un ruolo importante
secernendo vari tipi di proteine che, mediante una regolazione paracrina, modulano l’azione
delle cellule di Sertoli e delle cellule di Leydig. Nei primi anni 70, venne dimostrata la
presenza nell’epididimo di una proteina che legava gli androgeni con legami di alta affinità e
bassa capacità: l’ABP (androgen-binding protein). L’ABP non è un recettore, bensì una
proteina di trasporto. La produzione di ABP, in vivo e in vitro, può essere ridotta e mantenuta
dall’FSH; in assenza di questo ormone lo stesso effetto viene esercitato dal testosterone.
L’ABP ha la funzione principale di trasportare il testosterone e il 5a-DHT nei tubuli
seminiferi e, probabilmente, anche nell’epididimo; ha una struttura chimica e proprietà
chimico-fisiche simili alla proteina legante gli ormoni sessuali, la SHBG (sex hormone
binding globulin) (3).
Le cellule di Sertoli svolgono una funzione di primaria importanza per il trofismo delle
cellule della linea seminale e per la normale maturazione degli spermatozoi. Esse
costituiscono anche la cosiddetta barriera ematotesticolare, la cui funzione principale risiede
nel separare le forme più immature delle cellule della linea germinale da quelle più mature.
Poiché le cellule di Sertoli sono provviste di microtubuli e microfilamenti, sono capaci di fare
progredire le cellule germinali che, in questa fase maturativa sono prive di movimenti
autonomi, dalla base al centro del tubulo seminifero (lume) secondo i diversi stadi di
maturazione. La barriera ematotesticolare è formata dai contatti fra le cellule di Sertoli
(complessi giunzionali) presenti all’interno del tubulo seminifero.
Nel corso della
maturazione, le cellule della linea seminale acquisiscono, progressivamente, nuove
caratteristiche immunogeniche, estranee all’organismo maschile normale. La barriera
ematotesticolare evita, quindi, la formazione di anticorpi specifici nei confronti delle cellule
più mature della linea seminale. A conferma di questa importante funzione esercitata da tale
barriera, è stato osservato che le alterazioni o i danni della barriera ematotesticolare possono
causare sterilità su base immunologia (4).
Un ruolo di primaria importanza per la funzionalità endocrina del testicolo umano è
svolta dall’inibina. Anche se l’esistenza dell’inibina era stata postulata molti anni addietro,
solo negli anni 80 è stato possibile isolarla da diversi substrati biologici, replicarla per sintesi
e caratterizzarla chimicamente. È una molecola costituita da due subunità che variano
lievemente da specie a specie. In tutte le specie animali fino a oggi esaminate sono state
identificate due diverse forme chimiche di inibina: inibina A e inibina B. Le molecole di
inibina sono eterodimeri, essendo costituite da due diverse subunità: la subunità a è comune a
entrambe le forme, mentre la subunità b è distinta per ciascuna forma (bA e bB). Le diverse
molecole di inibina sono entrambe potenti inibitori della secrezione di FSH (Figura 2).
L’inibina è membro di un’ampia famiglia di molecole glicoproteiche e fattori di crescita
compresi la sostanza inibente il dotto di Müller e il TGF- (transforming growth factor-). I
dimeri delle subunità a della inibina sono denominati attivine o FRP (FSH-releasing protein)
e sono stimolatori della secrezione di FSH dalle cellule gonadotrope dell’adenoipofisi. Le
attività sono molto diverse dal GnRH; i loro effetti sulla secrezione dell’FSH sono molto lenti
(alcune ore) e non vengono inibiti dagli antagonisti del GnRH. Nella figura 2 è riportato, in
forma schematica, il meccanismo di regolazione della secrezione dell’FSH circolante da parte
della inibina e della attivina (5).
Cellule di Leydig
Le cellule di Leydig devono il loro nome a Franz Leydig che per primo le descrisse nel
1850. Esse rappresentano circa il 3% del volume testicolare nell’uomo. Si ritrovano
raggruppate in ammassi presso i capillari, nel tessuto connettivo che separa i tubuli seminiferi,
in una posizione ottimale per influenzare la spermatogenesi con meccanismi paracrini e per
riversare in circolo il testosterone prodotto. La loro formazione avviene a partire da elementi
mesenchimali indifferenziati, e la loro comparsa è definibile nel feto di 32-33 mm. I momenti
in cui più massiccia e importante è la maturazione del tessuto leydigiano sono quelli fetali e
puberali. In generale la vita della cellula di Leydig può temporalmente essere suddivisa in 5
periodi:
a) sviluppo fetale;
b) modifiche alla nascita;
c) pubertà;
d) periodo adulto;
e) periodo della senescenza.
In ciascun periodo si verificano modifiche peculiari a livello ultrastrutturale e di attività
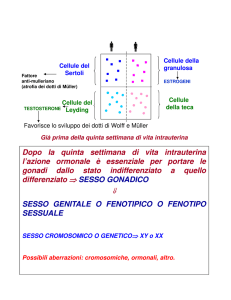
biosintetica (2). Nel corso dello sviluppo fetale, il testicolo embrionale, a partire dall’8a
settimana, inizia a maturare le cellule di Leydig che verso la 15a settimana sono in grado di
produrre testosterone che stimola la differenziazione sessuale in senso maschile. La
maturazione delle cellule leydigiane nel feto è legata alla presenza di HCG per il quale esse
sono dotate di specifici recettori. Le cellule di Leydig scompaiono poi a partire dalla
primissima infanzia e fino alla pubertà, quando ricompare una massiccia maturazione delle
stesse sotto la spinta dell’LH. In epoca puberale infatti, nel contesto di un testicolo
globalmente e progressivamente maturato sotto lo stimolo delle gonadotropine, le cellule di
Leydig si sviluppano rapidamente evolvendo dalle cellule mesenchimali e iniziano la
massiccia produzione di testosterone che si protrarrà durante l’età adulta. Nella fase di
senescenza si avvia un lento processo di trasformazione in senso involutivo/degenerativo delle
cellule di Leydig, con alterata attività steroidogenetica e conseguente riduzione della sintesi di
testosterone.
La principale funzione delle cellule di Leydig è la produzione del testosterone (circa 7
mg al giorno). Tuttavia il testicolo sintetizza anche piccole quantità di androgeni deboli come
l’androstenedione e il deidroepiandrosterone e circa un quarto della produzione quotidiana di
17-estradiolo. La biosintesi cellulare del testosterone (fig. 3) inizia come per gli altri steroidi
dal colesterolo. Il colesterolo deriva sia dalla sintesi de novo a partire dall’acetato fornito dal
flusso ematico, sia dal colesterolo LDL, il quale si lega a specifici recettori che ne permettono
l’incorporazione cellulare. La steroidogenesi leydigiana avviene in parte nei mitocondri, ove
la conversione del colesterolo in pregnenolone è una tappa limitante, e in parte nel reticolo
endoplasmatico liscio, ove il pregnenolone è metabolizzato fino alla formazione di
testosterone. La gonadotropina LH svolge l’azione più importante nel controllare la funzione
steroidogenetica delle cellule di Leydig sulla cui membrana cellulare si trovano recettori
specifici ad alta affinità per la gonadotropina; il legame di LH a questi recettori determina
l’attivazione della via dell’AMPc (6). Tale attivazione è tuttavia soggetta a tutta una serie di
modulazioni, capaci di diminuire o amplificare la risposta, a opera di fattori diversi
(angiotensina, estrogeni, prolattina, GH, CRF, etc).
La maggior parte del testosterone è secreto dal testicolo nel sangue periferico ove
circola per circa il 65% legato a proteine plasmatiche, principalmente la sex hormone binding
globulin (SHBG). Questa proteina lega esclusivamente, e in ordine decrescente di affinità, il
diidrotestosterone (DHT), il testosterone e l’E2. Il modello d’azione è identico a quello degli
altri ormoni steroidei. Il testosterone penetra nelle cellule in forma libera; può subire subito la
trasformazione in DHT o può rimanere tale. La trasformazione in DHT è operata dalla 5reduttasi situata a livello microsomiale. Il DHT o il testosterone si legano a un recettore
citosolico specifico, proteina di 100.000 dalton formata da due subunità (alfa e beta). Il
legame ormone-recettore è reversibile e il recettore ha un’affinità variabile a seconda dei vari
steroidi: massima per il DHT e quindi a scalare per il testosterone, l’estradiolo, il
progesterone, ecc. (figura 4).
INVECCHIAMENTO E FUNZIONE TESTICOLARE
La riduzione dei livelli circolanti di testosterone che si osserva con l'invecchiamento è
dovuta essenzialmente ad una riduzione della sua produzione e non ad un aumento della
‘clearance’, dal momento che è stato dimostrato che quest'ultima è addirittura ridotta
nell'anziano.
Durante l’invecchiamento, le principali alterazioni nella fisiologia dell'asse riproduttivo
si osservano a livello testicolare, dove si osserva una progressiva riduzione nel numero di
cellule di Leydig. Un uomo di 20 anni ha in media 700 milioni di cellule di Leydig ed
attraverso tecniche istometriche quantitative è stato possibile dimostrare che ogni anno se ne
perdono circa 6-7 milioni. Per questo motivo un uomo di 80 anni possiede circa 200 milioni
di cellule di Leydig. Peraltro non è ancora ben chiaro se la ridotta produzione di testosterone
dipenda esclusivamente dalla riduzione numerica delle cellule di Leydig. E' noto infatti che
anche l'attività degli enzimi della steroidogenesi nell'anziano è ridotta rispetto al giovane e
che la capacità del testicolo di incrementare la produzione di testosterone in seguito a stimolo
gonadotropinico è ridotta di circa la metà.
La riserva secretoria delle cellule di Leydig nell'uomo anziano, nonostante sia ridotta,
dovrebbe tuttavia essere sufficiente per normalizzare le concentrazioni di testosterone se lo
stimolo tonico delle gonadotropine ipofisarie fosse adeguato. Peraltro è stato dimostrato che
la capacità secretoria ipofisaria per l'LH, in seguito a stimoli con dosi fisiologiche di GnRH è
ben conservata o addirittura aumentata nell'anziano. Tuttavia il riscontro di ridotti livelli di
androgeni in presenza di un adeguata capacità secretoria di LH e di testosterone indica
chiaramente l'esistenza di alterazioni del controllo neuroendocrino della funzione gonadica, in
aggiunta a difetti primitivi della funzione testicolare. L’osservazione della riduzione del ritmo
circadiano e della ampiezza delle pulsazioni di LH nell’anziano potrebbe dipendere quindi da
una riduzione dei boli di GnRH ipotalamico rilasciati a intermittenza nella circolazione
portale ipofisaria, dal momento che la responsività delle cellule gonadotrope è mantenuta con
dosi fisiologiche di GnRH.
Durante l’invecchiamento si verifica inoltre una significativa riduzione del volume
dell'eiaculato, una normale concentrazione degli spermatozoi totali con una parallela
riduzione del numero di spermatozoi con motilità e morfologia tipica. Per una corretta
interpretazione di questi dati bisogna considerare che la ridotta frequenza eiaculatoria
nell'uomo anziano determina di per sé un aumento del numero di spermatozoi con ridotta
motilità. Pertanto la riduzione della frequenza eiaculatoria potrebbe mascherare una ridotta
funzione spermatogenetica che trova le proprie basi fisiopatologiche nella riduzione del
numero di cellule del Sertoli che determina una riduzione dei livelli sierici di inibina ed un
parallelo aumento dei livelli di FSH. I test di funzionalità nemaspermica sono risultati
sovrapponibili nel soggetto giovane e nell'anziano, mentre tra i parametri del plasma seminale
solo la concentrazione di fruttosio è risultata significativamente ridotta con l'invecchiamento.
Tuttavia non è stato possibile stabilire una relazione causa-effetto tra la riduzione della
funzione steroidogenetica del testicolo ed alterazioni nemaspermiche nell'anziano. Queste
ultime potrebbero quindi essere indipendenti dalla riduzione delle concentrazioni di
testosterone nel plasma nonché nel fluido interstiziale testicolare (8).
BIBLIOGRAFIA
1. Fabbri A, Aversa A and Isidori A. “Erectile dysfunction: an overview” Human
Reproduction Update 1997; 3: 455-66.
2. Gnessi L, Fabbri A, Spera G. “Gonadal peptides as mediators of development and
functional control of the testis: an integrated system with hormones and local environment”
Endocrine Reviews 1997; 18(4): 541-609.
3. Rolf C, Nieschlag E “Senescence”. Da “Andrology – Male reproductive health and
dysfunction” Cap. 21: 397-407. E. Nieschlag e H.M. Behre (Eds), Springer Werlag, 1997.
4. Limone P, Calvelli P, Molinatti GM. “La regolazione della secrezione delle
gonadotropine”. Da “Andrologia. Fisiopatologia e Clinica” Cap. 6: 75-80. Molinatti GM,
Fontana D. (Rds.), Verduci Editore, 1997.
5. Baccini C. “Spermatogenesi”. Da “Trattato di Andrologia” Cap. 2: 123-45. Porena M,
Menchini Fabris F (Rds.), Utet, 1999.
6. Yen SSC. “Neuroendocrinology of Reproduction”. Da “Reproductive Endocrinology”, Yen
SSC, Jaffe RB, Barbieri RL (Eds), Cap 2: m30-80, WB Saunders Company, 1999.
7. Foresta C, Scandellari C. La Medicina della Riproduzione: aspetti clinici e terapeutici.
Padova: Cleup Editrice, 2001.
8. Veldhuis JD “Recent insights into neuroendocrine mechanisms of aging of the human male
hypothalamic-pituitary-gonadal axis”. Journal of Andrology, 20 (1): 1-17, January/February
1999.
Figura 1. Apparato sessuale maschile rappresentato in sezione trasversale. In grigio è
indicata la via di trasferimento degli spermatozoi dal tubulo seminifero del testicolo (1)
alle veschichette seminali (2) e da queste ultime all’uretra (3). Gli spermatozoi lasciano
i tubuli seminiferi attraverso la rete testis e passano, poi, dall’epididimo e dal dotto
deferente (le frecce indicano il movimento degli spermatozoi verso le vescichette
seminali) per raggiungere le vescichette seminali. Dalle vescichette seminali lo sperma
lascia il corpo umano attraverso l’uretra.
Figura 2. Regolazione ormonale della funzione testicolare ed effetti degli androgeni.
Gli ormoni chiave sono LH e FSH, sintetizzati e secreti sotto il controllo ipotalamico
del GnRH. Le cellule di Leydig sono localizzate tra i tubuli seminiferi e sintetizzano e
secernono il testosterone sotto il controllo dell’LH. Il testosterone stimola la
maturazione delle cellule germinali nei tubuli seminiferi. L’FSH agisce direttamente sui
tubuli seminiferi. Nell’epitelio germinali solo le cellule di Sertoli posseggono recettori
per testosterone ed FSH. Si pensa pertanto che l’effetto trofico di testosterone/FSH sulla
gametogenesi sia mediato attraverso le cellule di Sertoli. Il testicolo e il sistema
ipotalamo-ipofisi comunicano tramite ormoni steroidei e proteici. Il testosterone inibisce
la secrezione del GnRH e delle gonadotropine. Inibina e follistatina sopprimono
selettivamente il rilascio ipofisario di FSH, mentre l’attivina stimola questo processo. In
aggiunta agli effetti sulla gametogenesi, testosterone svolge un ruolo importante sulla
crescita pilifera, metabolismo osseo, massa muscolare e composizione corporea,
caratteristiche sessuali secondarie e funzionamento degli organi riproduttivi maschili.
Figura 3. Biosintesi degli ormoni steroidei. La biosintesi steroidea è indotta dall’LH
attraverso la stimolazione dell’adenilatociclasi. Il materiale di partenza è il colesterolo
o acetato
Figura 4. Meccanismi di azione degli androgeni nella cellula bersaglio. (T, testosterone; DHT,
diidrotestosterone; Rn, recettore nucleare attivato; mRNA, RNA messaggero; Rc, recettore inattivo).