Incontri educativo-informativi sul tema della fertilita’
Fisiologia dell’asse ipotalamo-ipofisi-testicolo
Prof. Francesco Lombardo
Dipartimento di Medicina Sperimentale, Sezione di Fisiopatologia
Medica, Policlinico Umberto I, Università di Roma – La Sapienza
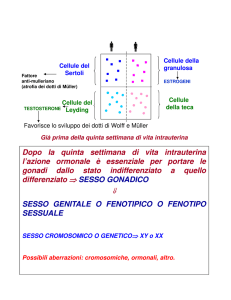
L'apparato genitale maschile è essenziale per il mantenimento della specie attraverso due funzioni essenziali:
la spermatogenesi e la funzione sessuale; tali funzioni vengono regolate da un sistema integrato di
regolazione che comprende il sistema nervoso centrale, l'ipofisi anteriore ed il testicolo. L'ipotalamo,
attraverso la secrezione pulsatile dell'ormone rilasciante le gonadotropine (GnRH), controlla la secrezione
ipofisaria dell'ormone follicolo-stimolante (FSH) e dell'ormone luteinizzante (LH) i quali a loro volta
stimolano il testicolo a produrre il testosterone, che assieme ai suoi metaboliti (diidrotestosterone ed
estradiolo) e all'inibina prodotta dalle cellule di Sertoli, esercitano un controllo retrogrado sull'ipofisi
inibendo la produzione di LH ed FSH, rispettivamente. Il testicolo è costituito da due compartimenti
distinti funzionalmente:
1) il compartimento tubulare dove si trovano le cellule di Sertoli deputate principalmente alla regolazione
della spermatogenesi
2) il compartimento interstiziale dove si trovano le cellule di Leydig deputate alla produzione di
testosterone.
Spermatogenesi
La spermatogenesi è un complesso processo di proliferazioni e modificazioni cellulari concernenti l'epitelio
germinale del testicolo e che culmina con la produzione degli spermatozoi. Gli spermatozoi lasciano i tubuli
seminiferi (attraverso la rete testis, l'epididimo e il vaso deferente) e raggiungono le vescichette seminali
che, con le loro caratteristiche secrezioni, contribuiscono alla formazione di gran parte del volume finale
dell'eiaculato .
Durante la spermatogenesi l'epitelio germinale interviene con una duplice funzione nel produrre gli
spermatozoi: a) genera milioni di spermatozoi ogni giorno; b) rimpiazza, di continuo, gli spermatogoni, la
popolazione cellulare che dà inizio al processo.
Le cellule di Sertoli sono "posate" sulla lamina basale e sono legate l'una all'altra da complessi giunzionali
specializzati vicini alla zona basale di ogni cellula. Generalmente le cellule di Sertoli hanno aspetto cilindrico,
un nucleo basale "trilobato", con un nucleolo prominente localizzato al centro. La cellula di Sertoli è l'unica
cellula somatica presente nel tubulo seminifero. Per quanto concerne l'epitelio germinativo del tubulo
seminifero, la cellula di Sertoli svolge numerose funzioni.
I fattori che regolano la funzione della cellula di Sertoli sono diversi; i principali sono tre:
a) regolazione endocrina da parte dell'FSH
Anatomia e Fisiopatologia dell'apparato riproduttivo maschile e femminile – 11 giugno 2012
Incontri educativo-informativi sul tema della fertilita’
b) regolazione paracrina da parte del testosterone
c) regolazione autocrina da fattori prodotti dalla cellula di Sertoli stessa
La cellula di Sertoli viene stimolata primariamente dall'FSH che, attraverso l'attivazione dell'adenilatociclasi
(produzione di AMPc), stimola la cellula a produrre il 17 -estradiolo (E2) da precursori steroidei
androgenici (attraverso l'attivazione dell'enzima "aromatasi") e a sintetizzare le proteine specifiche del
testicolo (ABP e inibina) e le proteine non specifiche (transferrina, somatomedina C, ceruloplasmina,
attivatore del plasminogeno, vitamina A, insulina, beta-endorfina, ecc.). Anche le cellule mioidi svolgono un
ruolo importante secernendo vari tipi di proteine che, mediante una regolazione paracrina, modulano
l'azione delle cellule di Sertoli e delle cellule di Leydig. Nell'epididimo è presente, inoltre, una proteina che
lega gli androgeni con legami di alta affinità: l'ABP (androgen-binding protein). La produzione di ABP, in vivo
e in vitro, può essere ridotta e mantenuta dall'FSH; in assenza di questo ormone lo stesso effetto viene
esercitato dal testosterone. L'ABP ha la funzione principale di trasportare il testosterone e il 5a-DHT nei
tubuli seminiferi e, probabilmente, anche nell'epididimo.
Le cellule di Sertoli svolgono una funzione di primaria importanza per il trofismo delle cellule della linea
seminale e per la normale maturazione degli spermatozoi. Esse costituiscono anche la cosiddetta barriera
ematotesticolare, la cui funzione principale risiede nel separare le forme più immature delle cellule della
linea germinale da quelle più mature. Poiché le cellule di Sertoli sono provviste di microtubuli e
microfilamenti, sono capaci di fare progredire le cellule germinali che, in questa fase maturativa sono prive
di movimenti autonomi, dalla base al centro del tubulo seminifero (lume) secondo i diversi stadi di
maturazione. La barriera ematotesticolare è formata dai contatti fra le cellule di Sertoli (complessi
giunzionali) presenti all'interno del tubulo seminifero. Nel corso della maturazione, le cellule della linea
seminale acquisiscono, progressivamente, nuove caratteristiche immunogeniche, estranee all'organismo
maschile normale. La barriera ematotesticolare evita, quindi, la formazione di anticorpi specifici nei
confronti delle cellule più mature della linea seminale. A conferma di questa importante funzione esercitata
da tale barriera, è stato osservato che le alterazioni o i danni della barriera ematotesticolare possono
causare sterilità su base immunologia.
Un ruolo di primaria importanza per la funzionalità endocrina del testicolo umano è svolta dall'inibina, una
molecola costituita da due subunità che variano lievemente da specie a specie. In tutte le specie animali fino
a oggi esaminate sono state identificate due diverse forme chimiche di inibina: inibina A e inibina B. Le
molecole di inibina sono eterodimeri, costituite da due subunità: , comune a entrambe le forme, e ?,
distinta per ciascuna forma (? A e ?B). Le diverse molecole di inibina sono entrambe potenti inibitori della
secrezione di FSH.
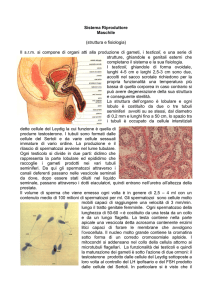
Le cellule di Leydig rappresentano circa il 3% del volume testicolare nell'uomo. Si ritrovano raggruppate in
ammassi presso i capillari, nel tessuto connettivo che separa i tubuli seminiferi, in una posizione ottimale
per influenzare la spermatogenesi con meccanismi paracrini e per riversare in circolo il testosterone
prodotto. La loro formazione avviene a partire da elementi mesenchimali indifferenziati, e la loro comparsa
è definibile nel feto di 32-33 mm. I momenti in cui più massiccia e importante è la maturazione del tessuto
leydigiano sono quelli fetali e puberali. In generale la vita della cellula di Leydig può temporalmente essere
suddivisa in 5 periodi: fetale; nascita; pubertà; adulto; senescenza.
In ciascun periodo si verificano modifiche peculiari a livello ultrastrutturale e di attività biosintetica. La
Anatomia e Fisiopatologia dell'apparato riproduttivo maschile e femminile – 11 giugno 2012
Incontri educativo-informativi sul tema della fertilita’
principale funzione delle cellule di Leydig è la produzione del testosterone (circa 7 mg al giorno) a partire,
come per gli altri steroidi, dal colesterolo. La gonadotropina LH svolge l'azione più importante nel
controllare la funzione steroidogenetica delle cellule di Leydig sulla cui membrana cellulare si trovano
recettori specifici ad alta affinità per la gonadotropina; il legame di LH a questi recettori determina
l'attivazione della via dell'AMPc. Tale attivazione è tuttavia soggetta a tutta una serie di modulazioni, capaci
di diminuire o amplificare la risposta, a opera di fattori diversi.
La maggior parte del testosterone è secreto dal testicolo nel sangue periferico ove circola per circa il 65%
legato a proteine plasmatiche, principalmente la sex hormone binding globulin (SHBG). Questa proteina
lega esclusivamente, e in ordine decrescente di affinità, il diidrotestosterone (DHT), il testosterone e l'E2.
Il modello d'azione è identico a quello degli altri ormoni steroidei. Il testosterone penetra nelle cellule in
forma libera; può subire subito la trasformazione in DHT o può rimanere tale. La trasformazione in DHT è
operata dalla 5 -reduttasi situata a livello microsomiale. Il DHT o il testosterone si legano a un recettore
citosolico specifico, proteina di 100.000 dalton formata da due subunità (alfa e beta).
Anatomia e Fisiopatologia dell'apparato riproduttivo maschile e femminile – 11 giugno 2012