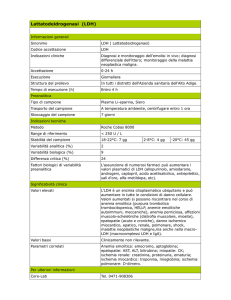
Enzimi in Biochimica Clinica
Enzimi in diagnostica: esempi
•
•
•
•
•
•
•
Enzima
Alanina amminotransferasi
Fosfatasi acida
Fosfatasi alcalina
Amilasi
Creatina chinasi
-glutammil transferasi
Lattico deidrogenasi
•
•
•
•
•
•
•
Sorgenti
Danni epatici
Prostata
Ossa
Pancreas
Muscoli
Fegato
Varie sorgenti (vedi
poi)
Gli enzimi presenti nel plasma sono stati distinti in due grandi categorie:
- enzimi plasma specifici
- enzimi non plasma-specifici.
Gli enzimi plasma-specifici svolgono la loro funzione nel plasma (gli enzimi
che regolano la coagulazione, la lipoproteina lipasi, la lectina-colesterolo
aciltransferasi, etc.).
Gli enzimi non plasma-specifici non esercitano nel plasma alcuna funzione
fisiologica.
Si distinguono in:
- enzimi di secrezione che si trovano nel siero perché secreti da alcune
cellule ghiandolari
( amilasi, lipasi, fosfatasi ) e vengono eliminati
attraverso le vie biliari o attraverso le urine.
-enzimi legati al metabolismo cellulare che sono presenti nelle cellule in
elevata concentrazione.
Alterazione dei livelli plasmatici
dovuta a :
•
•
•
•
Alterata sintesi
Variazione della quantità di tessuto
Variazione nella permeabilità cellulare
Alterazione nella velocità di inattivazione/
degradazione
• Ostruzione di una normale via di escrezione
• Altri fattori che influenzano l’attività (inibitori,
carenza di cofattori...)
Quando le strutture cellulari vengono danneggiate gli
enzimi cellulari si liberano e si riversano nel circolo
sanguigno.
Un aumento della loro concentrazione nel campione può
rappresentare un indice abbastanza preciso di un danno
cellulare.
Transaminasi
Le transaminasi sono enzimi ubiquitari, ma particolarmente abbondanti
in fegato e muscolo striato, che catalizzano reazioni di trasferimento di
un gruppo amminico da un aa. donatore su un -chetoacido accettore,
secondo lo schema generale:
AA1 + KA2 KA1 + AA2
Le transaminasi contengono un coenzima vitaminico, il piridossal
fosfato (PLP), che durante la catalisi riceve il gruppo –NH2 dal Glu
e diventa piridossamina fosfato (PMP)
Il meccanismo catalitico richiede la formazione di una base di Schiff
tra il gruppo aldeidico del PLP e il gruppo amminico dell’aa.
ALT, Alanina aminotransferasi (Sinonimo GPT): 0-35 U/L
L’enzima è localizzato principalmente nelle cellule epatiche dalle quali fuoriesce in
seguito a danni a carico della loro parete.
E’ un indicatore abbastanza specifico di un danno epatico senza però chiarirne la causa.
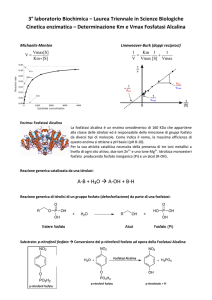
Esso catalizza la reazione reversibile:
L-alanina + alfa-chetoglutarato ----------> piruvato + L-glutammato
Per dosare l'ALT si utilizza una reazione accoppiata utilizzando l'enzima lattico
deidrogenasi che agisce sul substrato piruvato prodotto dall'ALT. Quanto più acido
lattico si forma dal piruvato ad opera della lattico deidrogenasi tanto più è presente
l'ALT.
Quindi la diminuzione di assorbanza a 340nm allo spettrofotometro misura
l'attività enzimatica dell'ALT
L-alanina + alfa-chetoglutarato ----------> L-glutammato + acido piruvico
Dosaggio accoppiato
ALT, Alanina aminotransferasi (Sinonimo GPT): 0-35 U/L
Esso catalizza la reazione reversibile:
L-alanina + alfa-chetoglutarato ----------> piruvato + L-glutammato
Si aggiunge un enzima ausiliario (LDH) e il NADH
LDH
Piruvato + NADH + H+ <=> Lattato + NAD+
Si segue la scomparsa del NADH a 340 nm
AST, Aspartato aminotransferasi (Sinonimo GOT): 0-35 U/L
E’ contenuto in diverse cellule ma risulta particolarmente concentrato in particolari
distretti delle cellule epatiche (mitocondri) e del tessuto muscolare e cardiaco.
Il fatto che siano localizzati all’interno di subunità cellulari fa sì che si abbia , un rilascio
più lento dell’enzima nel sangue a seguito di danni che coinvolgono il fegato, ma ciò
indica anche un danno più grave alle cellule del fegato o dei muscoli.
catalizza la reazione reversibile:
L-aspartato + alfa-chetoglutarato ----------> ossalacetato + L-glutammato
Per dosare l'AST si usa l'enzima malato deidrogenasi che utilizza come substrato
l'ossalacetato prodotto dall'AST. Quanto più acido malico si forma dall'ossalacetato ad
opera della malato deidrogenasi tanto più è presente l'AST.
Quindi la diminuzione di assorbanza a 340nm allo spettrofotometro misura l'attività
enzimatica dell'AST.
L-aspartato + alfa-chetoglutarato ----------> L-glutammato + ossalacetato
ossalacetato + NADH + H +
Malato + NAD+
Metodi accoppiati: A a 340 nm
La sigla NAD, "nicotinammìdeadenìndinucleotìde“, è un coenzima il cui ruolo
biologico consiste nel trasferire gli elettroni, quindi nel permettere le ossido-riduzioni;
esso svolge il suo importante ruolo tramite lo spostamento di atomi di idrogeno.
ISOENZIMI
Gli isoenzimi sono proteine che catalizzano la stessa reazione, ma
presentano diversa carica elettrica, diversa solubilità, cioè diverse
caratteristiche chimico-fisiche.
La determinazione di una forma isoenzimatica è importante nella
diagnosi di una specifica patologia.
I metodi di studio degli isoenzimi possono essere:
di tipo generale consentono di determinare l’attività e/o espressione di tutti i possibili
isoenzimi presenti nel materiale biologico
di tipo specifico diretti alla misura del singolo isoenzima di interesse diagnostico.
Tra i metodi generali troviamo l’elettroforesi, la cromatografia, l’ elettrofocalizzazione.
I metodi selettivi si basano sull’ inibizione selettiva di uno o più isoenzimi, seguita dalla
misura dell’attività residua.
Es di isoenzimi sono LDH, CK, ALP, ACP
•
•
•
•
•
•
Gli isoenzimi possono differire
in:
Parametri cinetici
Specificità
pH ottimale
Caratteristiche di carica (pI)
Sensibilità all’inibizione
Sensibilità al calore (termostabilità)
Lattico deidrogenasi (LDH).(120-240 U\L)
Enzima della glicolisi presente nella maggior parte dei tessuti e in
concentrazione più elevata nel cuore, fegato, muscolo scheletrico,
rene, eritrociti.
E’ costituito da quattro monomeri (H, M) per cui può esistere in cinque
isoenzimi che differiscono per caratteristiche chimico-fisiche utili per
l’identificazione.
L'isoenzima M4 (LDH5) è predominante nei muscoli e nel fegato,
mentre H4 (LDH1) nel cuore e H3M1 (LDH2) negli eritrociti.
L'isoenzima cardiaco (LDH1) è facilmente riconoscibile perché è in
grado di catalizzare la trasformazione dell'α-idrossibutirrato in α-chetobutirrato.
LDH (lattico deidrogenasi)
• Composta da 4 subunità di 2 tipi H (heart) e
M (muscle)
• 5 possibili combinazioni
H
H
H
LDH 1,
LDH 2,
H
H
H
H
M
LDH 3,
H
H
M
M
LDH 4,
M
LDH 5
M
M
H
M
M
• Catalizza la reazione
Ac. piruvico
+
NADH +
H+
Ac. lattico
+
NAD+
M
M
Isoforme LDH
e prevalenza nei tessuti
m. scheletrica
rene
5 4 3 2 1
5 4 3 2 1
m. cardiaca
fegato
5 4 3 2 1
emazie
5 4 3 2 1
5 4 3 2 1
Valori elevati di LDH si osservano:
Nell’infarto del miocardio
In malattie epatiche
In anemie emolitiche e anemia perniciosa
Nella leucemia
In malattie muscolari (es. distrofia muscolare).
Dosaggio dell’LDH
Dosaggio degli isoenzimi dell’LDH
La separazione degli isoenzimi avviene mediante elettroforesi su acetato di cellulosa.
La striscia di carta viene messa a contatto con acido lattico e NAD al termine della
reazione si forma piruvato e NADH.
Quest'ultimo sviluppa colore sulle bande isoenzimatiche in presenza di appositi
reagenti.
L'intensità del colore è proporzionale alla quantità plasmatica di isoenzima.
Le fosfatasi sono una classe di enzimi idrolasi che catalizzano la
rimozione di gruppi fosfato. In pratica, rappresentano i catalizzatori della
reazione di defosforilazione. In relazione al pH in cui operano, si
distinguono due tipi di fosfatasi: la fosfatasi acida (ACP) e la fosfatasi
alcalina (ALP).
Fosfatasi alcalina.
La fosfatasi alcalina (AP) è una glicoproteina a struttura dimerica
contenente zinco, che catalizza l'idrolisi a pH alcalino di numerosi
fosfomonoesteri. Essa è specificatamente associata a membrane
citoplasmatiche e microsomi delle cellule della mucosa dell'intestino
tenue e del tubulo convoluto prossimale del rene, degli osteoblasti,
degli epatociti e del sinciziotrofoblasto placentare.
Prodotta dal tessuto osseo , fegato, intestino, placenta.
Ne sono noti vari isoenzimi.
AUMENTA nell’accrescimento e in gravidanza (cond. fisiologiche), e
nell’epatopatie e nelle malattie osse (cond. patologiche).
Significato clinico della fosfatasi alcalina totale
Valori normali:
bambini fino a 15 anni <300 UI/L;
ragazzi da 15 a 18 anni <400 UI/L;
adulti <170 UI/L.
I valori elevati di bambini e adolescenti sono dovuti al
maggiore ricambio osseo. Valori superiori alla norma
possono essere indice diartrite deformante, carcinoma
biliare, epatite, malattia di Paget, metastasi epatiche e
ossee, alterazioni delle vie biliari, mieloma, mononucleosi,
osteomielite, rachitismo, sarcoidosi, fratture ossee,
insufficienza renale, sarcoma osteogenico.
Valori inferiori possono essere causati da anemia, età
avanzata, ipotiroidismo, malnutrizione.
Combinazione di metodi immunologici, elettroforetici e di
digestione enzimatica per distinguere le isoforme ossea ed epatobiliare di fosfatasi alcalina.
Creatin-fosfo-chinasi (CPK)
• Enzima deputato al trasporto dell’ATP dall’interno dei
mitocondri al citoplasma delle cellule muscolari
Si tratta di un enzima addetto alla produzione di energia (ATP) a partire dalla fosfocreatina
Membrana
mitocondriale
Interno del
mitocondrio
ATP
ATP
Fosforilazione
creatina
Citoplasma fibrocellula
muscolare
CPK
CPK
ossidativa
ADP
ADP
ATP
creatina
fosfocreatina
fosfocreatina
Energia per
contrazione
ADP
CPK - isoenzimi
• CPK formato da due diverse sub unità M (muscle) e B (brain)
• 3 possibili combinazioni isoenzimatiche (M-M M-B B-B)
M
M
M
B
B
• Contenuto nei tessuti:
– Muscolatura scheletrica
96
4
0%
– Muscolatura cardiaca
80
20
0%
– Cervello
96%
B
Gli isoenzimi della
creatina chinasi
• Dimero costituito di subunità B
(brain) e M (muscle)
• Nell’infarto aumentano precocemente CK totale, CK-MB(2) e CKMM(3)
Determinazione
• CPK totale con metodo cinetico
• CK-MB metodo cinetico con immuno-inibizione delle
subunità M e valutazione delle % del CK-MB rispetto al
totale
• CK-MB massa
CK–MB massa
• Maggiore sensibilità del test immunochimico rispetto a
quello di cinetica enzimatica
• Maggiore specificità dovuta ad Ab moc e mancanza di
interferenze
• Vengono comunque dosate le quote di CK-MB massa
provenienti dalla muscolatura scheletrica
• Marcatore sensibile, poco specifico
CK-MB massa
• Incremento tra 2-6 ore, picco 10-24 ore,
rientro entro 3 gg.
• Utile (insieme alla Mioglobina) nelle prime 10
ore dall’inizio della sintomatologia
• Correla con estensione della zona infartuata
Differenza misurazione
ponderale-funzionale
• Nella misurazione ponderale si misura la
quantità di sostanza presente attraverso reazioni
chimiche o immunochimiche indipendentemente
dalla sua capacità di svolgere o meno la corretta
funzione
• Nella misurazione funzionale si valuta l’attività
della sostanza in esame non considerando
eventuali molecole alterate e quindi non
funzionanti
Metodi di misurazione
• Ponderale
– Unità di misura espressa in peso/volume:
• mg/dL
• Moli/litro
• Ecc.
• Funzionale
– Unità di misura espressa in:
• Unità/Volume [U/L (misurazioni di cinetica enzimatica)]
• Tempo (misurazione coagulative)
• Ratio oppure % di attività rispetto a un campione di
riferimento (misurazione coagulative rispetto a pool di plasmi di
riferimento)
• Ecc.
Esempi di diverse misurazioni
• Ponderali:
–
–
–
–
–
Glicemia
Creatininemia
CEA
CK-MB massa
Troponina
mg/dl
mg/dl
ng/mL
ng/mL
ng/mL
• Funzionali
– CPK
– AST
– Tempo di protrombina
U/L
U/L
secondi
Esempio di utilizzo degli isoenzimi CK-MB ed LDH1 nella diagnosi di
laboratorio dell’ infarto del miocardio
Enzima
Inizio
Picco
Basale
CK-MB
4h
18h
48h
AST
8h
24-48h
4 giorni
LDH1
24h
3 giorni
12 giorni
Valutazioni
cliniche e
quadro
enzimatico
Andamento temporale
dei marcatori cardiaci
CK-MB massa
Myo
cTpn
2
4
6
8
10
12
14 16
18
20 24
36
48
60
Gli enzimi sono proteine dotate di attività catalitica
L’enzima accelera la velocità di formazione del
complesso ES abbassando l’energia di attivazione
E+S
ES
EP
E+P
L’attività enzimatica si esprime in unità,
quantità di enzima che catalizza la
conversione di una micromole di substrato
per minuto in condizioni definite di temperatura, pH e
concentrazioni di substrato.
Come si misura l’attività di un
enzima ?
• Velocità di reazione: quantità di substrato
trasformato nel tempo
v = - d [S] / dT = d [P] / dT
• Si misura la variazione nel tempo di una
qualsiasi grandezza correlata alla
concentrazione del substrato o del prodotto
Che cos’è l’attività specifica
Attività specifica = attività / quantità totale proteine
In quali condizioni fare i
dosaggi?
Velocità iniziale
•
•
•
La velocità dipende dal substrato, ma [S]
cambia nel tempo (si consuma)
per semplicità, la cinetica viene studiata in
condizioni iniziali (tempo = 0)
in queste condizioni,
– [S] >> [E]
– [P] 0 (la reazione inversa da P a S è
trascurabile)
Precauzioni nei dosaggi enzimatici
• Substrati, tamponi, ecc. di alta purezza
• Anche la prep. enzimatica non deve contenere
composti che interferiscono col saggio
• L’enzima dovrebbe essere stabile
• Controllo di pH e temperatura
• La velocità deve essere costante nell’intervallo
considerato (v0)
• Reazioni accoppiate: enzima ausiliario puro e
non limitante, se possibile con Km piccola
• Escludere/valutare la presenza di reazioni non
enzimatiche