Isoenzimi
Gli isoenzimi sono enzimi che catalizzano la stessa reazione, ma hanno una
struttura chimica differente e diverse proprietà chimico fisiche (pH, pI,
conducibilità elettrica mobilità elettroforetica).
Possono essere presenti in individui diversi o anche in un stesso organismo a
livello di distretti cellulari differenti. Gli isoenzimi possono derivare o da geni
differenti o da modificazioni post-traduzionali diverse oppure dall'assemblaggio
alternativo delle differenti subunità.
Esempi importanti di isoenzimi umani sono rappresentati:
Citocromo p-450
Creatin chinasi
Fosfatasi alcalina (ALP1 ALP4)
Lattico deidrogenasi (LDH1 LDH5)
Aspartato transaminasi (AST1 – citoplasmatica, AST2 – mitocondriale)
Glucochinasi (fegato) e esochinasi (muscolo)
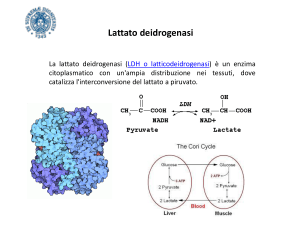
Lattato deidrogenasi
Cinque isoenzimi caratterizzano la lattato deidrogenasi (LDH), tutti tetramerici
quindi quattro catene polipeptidiche ma due tipi differenti, M ed H codificati
rispettivamente dai geni ldha e ldhb. Dalle diverse combinazioni delle due catene si
hanno i cinque isoenzimi: M4, M3H, M2H2, MH3, H4.
Localizzazioni:
LDH-1 (4H): cuore
LDH-2 (3H1M): siero
LDH-3 (2H2M): polmoni
LDH-4 (1H3M): reni, placenta, pancreas
LDH-5 (4M): fegato, muscolo striato
Poiché gli isoenzimi sono distribuiti in maniera differente nei vari organi, l'analisi
quantitativa di questi consente di risalire all'organo bersaglio della patologia.
Dunque livelli alterati di questi sono indici specifici di alcune malattie come quelle
cardiache, muscolari, ossee ecc...per questo sono di grande utilità diagnostica.
LDH1/LDH2 indice di infarto miocardico
Sieroproteine
Grazie alla diversità di PM, pI, dimensione e forma può essere possibile separare
elettroforeticamente le varie proteine in frazioni (protidogramma).
Esistono due classi principali nelle sieroproteine: albumina e globuline.
Albumina
Ha una carica maggiore negativa, quindi migra più velocemente verso l’anodo.
Globuline
-globuline: 1 - 2
-globuline
-globuline