DIAGNOSTICA ENZIMATICA
GLI ENZIMI SI DOSANO SU DIVERSI LIQUIDI BIOLOGICI:
-
PLASMA O SIERO
Altre matrici: URINE, SALIVA, ESSUDATI, ecc.
I CONTESTI DIAGNOSTICI IN CUI SI USANO QUESTI DOSAGGI SONO DUE:
1. Valutazione attività di produzione dell’enzima: malattie genetico-metaboliche con ↓
dell’attività enzimatica (per es., fenilchetonuria, glicogenosi, ecc.)
2. Valutazione della quantità di enzima rilasciata dalle cellule nei liquidi biologici per
iperproduzione o danno cellulare: ↑ dei valori (per es. infarto del miocardio, tumori, ecc.)
Generalmente per misura di un enzima si intende la misura della sua attività enzimatica
che si ottiene misurando la quantità di substrato che l’enzima presente nel campione
trasforma nel prodotto nell’unità di tempo.
Enzimi con valore diagnostico
I dosaggi enzimatici comunemente usati a scopo
diagnostico sono numericamente limitati: solo
una decina sono di impiego routinario e questi
oggi costituiscono circa il 30% del carico di
lavoro di un comune laboratorio diagnostico.
ENZIMI DI INTERESSE DIAGNOSTICO
GLI ENZIMI PRESENTI NEL SANGUE POSSONO ESSERE CLASSIFICATI IN
1. ENZIMI SPECIFICI (esplicano direttamente nel plasma le loro attività biologiche;
per es., quelli coinvolti nella coagulazione del sangue)
2. ENZIMI SECRETI O RIASSORBITI (svolgono la loro funzione nei liquidi organici, come avviene per gli enzimi delle
ghiandole esocrine)
3. ENZIMI CELLULARI (che svolgono funzioni intracellulari e sono riversati nel sangue nel turnover cellulare)
CARATTERISTICHE DEGLI ENZIMI
usati a scopo diagnostico
Gli aumenti o le diminuzioni di attività enzimatiche sieriche sono sempre correlati ad alterazioni
della funzionalità cellulare
GGT
ORGANI DIVERSI ESPRIMONO UN
PATTERN ENZIMATICO DIVERSO
• Organi diversi hanno una diversa dotazione
enzimatica (differenze metaboliche)
• Ci sono enzimi organo-specifici:
glutammatodeidrogenasi (GLDH o GD) è
l’enzima organo-specifico del fegato, mentre la
creatina chinasi (CK) lo è del muscolo
ISOENZIMI o ISOZIMI
Proteine che catalizzano la stessa reazione, ma
presentano diverse proprietà molecolari
(struttura primaria, struttura quaternaria, carica
elettrica, massa molecolare, parametri cinetici,
ecc.).
Aumentano il valore predittivo ed il ruolo
diagnostico dell’enzimologia
ORGANI DIVERSI ESPRIMONO
ISOENZIMI DIVERSI
•
•
Gli isoenzimi, o isozimi, sono forme multiple di un enzima che catalizzano la stessa reazione, ma
differiscono nella struttura o nella composizione in subunità. Ad esempio, la lattato deidrogenasi
(LDH) è una proteina tetramerica costituita da due differenti catene polipeptidiche, M ed H. Dalle
diverse combinazioni delle due catene si hanno cinque isoenzimi: M4, M3H, M2H2, MH3, H4.
La creatinachinasi (CK) è una proteina dimerica costituita da due differenti catene polipeptidiche, B
e M. Dalle diverse combinazioni di queste due catene si hanno tre isoenzimi: BB, BM e MM.
•
Hanno caratteristiche fisiche (i.e., massa), chimiche (i.e., composizione, pI) e biochimiche (pH
ottimale, costanti catalitiche (Km, Vmax)) diverse, e sono pertanto discriminabili con tecniche
analitiche specifiche.
•
Sono presenti in tessuti diversi. Per es., la M4 è prevalentemente espressa nel muscolo scheletrico,
mentre la forma H4 è presente solo nel miocardio. Altro esempio, la fosfatasi acida è presente nella
prostata, la fosfatasi alcalina è presente nel fegato e nelle ossa.
•
Poiché gli isoenzimi sono distribuiti in maniera differente nei vari organi, l'analisi quantitativa di
questi consente di risalire all'organo bersaglio della patologia. Dunque livelli alterati di questi sono
indici specifici di alcune malattie come quelle cardiache, muscolari, ossee, etc., per questo sono di
grande utilità diagnostica.
ISOENZIMI DELLA CK
Creatina chinasi (CK)
Lattato deidrogenasi (LDH)
FOSFATASI ALCALINA (ALP)
La ALP è presente soprattutto nel fegato (canalicoli biliari) e nelle ossa (osteoblasti),
placenta e rene.
La ALP aumenta nelle:
• Affezioni del sistema epato-biliare (poco in cirrosi, epatite);
• Alterazioni della sostanza ossea (rachitismo, metastasi ossee, Morbo di Paget);
• Iperparatiroidismo
• Patologie infiammatorie croniche intestinali
Utilità diagnostica della misura
dell’attività della ALP nel sangue
Un aumento elevato (5 volte superiore ai valori di riferimento) può essere dovuto a situazioni come:
•
cirrosi biliare
•
ostruzione delle vie biliari
•
morbo di Paget
•
altre patologie
Un aumento moderato (3 - 5 volte superiore ai valori di riferimento) può essere dovuto a situazioni come:
•
epatopatie
•
mononucleosi infettiva
•
altre patologie
Un aumento lieve (fino a 3 volte superiore ai valori di riferimento) può essere dovuto a situazioni come:
•
epatite virale
•
fratture
•
gravidanza
Una diminuzione può essere dovuta a situazioni come:
•
ipotiroidismo
•
scorbuto
•
cachessia
•
anemie
Valori di riferimento
• I valori dell’attività nel sangue della fosfatasi
alcalina normalmente variano
• fra 110 e 700 UI/l nei bambini fino a un anno,
• fra 110 e 550 UI/l da 1 anno a 10 anni,
• fra 130 e 700 UI/l da 10 a 15 anni,
• fra 50 e 220 UI/l negli adulti.
Metodi Enzimatici di Analisi
Gli enzimi vengono usati spesso per identificare e/o per quantificare sostanze chimiche
specifiche in soluzione.
I vantaggi sono derivati dal fatto che le reazioni enzimatiche sono veloci e molto specifiche
per la natura dei substrati e che, anche in condizioni molto blande, catalizzano reazioni che
raramente procedono a velocità significative. La specificità degli enzimi può superare la
necessità di rimuovere materiali interferenti dai campioni.
ESEMPIO:
GLUCOSIO – metodo GOD-POD
Saggi di Attività Enzimatica
È possibile determinare la quantità di enzimi particolari in fluidi biologici misurandone
l’attività con substrati specifici.
Per queste determinazioni si misura la velocità di conversione di un particolare substrato in
prodotto invece del grado a cui procede la reazione.
La cinetica della maggior parte delle reazioni enzimatiche è descritta dalla
equazione di
Michaelis-Menten:
La velocità di una reazione enzimatica aumenta con l’aumentare della [S] fino a
raggiungere un limite oltre il quale non aumenta più (saturazione = tutto “E” è
legato a “S” sottoforma di complesso ES) ma resta costante a meno che non si
aumenta [E]
Per valutare l’attività enzimatica, viene impiegata una concentrazione di
substrato [S] >> KM in modo che la V0 misurata corrisponda con buona
approssimazione alla Vmax:
Queste condizioni sperimentali sono note come cinetica di ordine zero: non c’è alcuna
dipendenza dalla concentrazione del substrato, la velocità osservata è proporzionale alla
concentrazione di enzima.
Unità di attività enzimatica e dosaggio degli Enzimi
Catal (kat): è la quantità di enzima che converte 1 mole di reagente nel prodotto
in 1 secondo nelle condizioni di reazione standard (ottimali).
L’Unità internazionale (U o UI): corrisponde alla quantità di enzima che converte 1
mole di reagente nel prodotto in 1 minuto. Poiché 1 mole /min = 1.67 10-8
moli/s quindi U = 1.67 10-8 kat.
La concentrazione enzimatica è espressa come UI/L o sottomultipli UI/mL (in
alcuni casi anche UI/mg).
Fattori che influenzano le reazioni
catalizzate dagli enzimi
Inibitori
Molti enzimi sono inibiti da varie sostanze, pertanto bisogna tenere conto di questi fattori
e usare controlli appropriati. Per es., agenti chelanti, come citrato e altri composti capaci
di formare complessi bidentati con metalli sono spesso inibitori potenti di alcuni enzimi
metallo-dipendenti come le chinasi.
pH
Temperatura
Cofattori (co-enzimi e cofattori metallici)
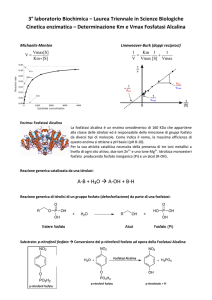
ESERCITAZIONE:
Misurazione sperimentale dei
parametri cinetici della fosfatasi
alcalina
Misure sperimentali e analisi dei dati cinetici
Per misurare la velocità di reazione abbiamo bisogno di un sistema per seguire la
formazione del prodotto o il consumo di substrato.
Via via che il substrato viene consumato la velocità diminuisce fino a quando alla fine
viene raggiunto l’equilibrio.
Di regola, si preferisce predisporre una serie di esperimenti tutti alla stessa
concentrazione di enzima, ma a diverse concentrazioni di substrato e misurare la
velocità iniziale (V0).
Saggio Spettrofotometrico
Spesso si usano metodi spettrofotometrici per monitorare le reazioni enzimatiche. Questi
possono essere molto convenienti se il substrato o il prodotto contengono un gruppo
cromoforo (o fluoroforo) distinto.
Assorbimento della radiazione UV/visibile dovuto
a transizioni energetiche degli elettroni degli
strati esterni delle molecole. Quando la luce
colpisce una molecola essa può essere trasmessa
(nessuna interazione) o assorbita.
Il livello di assorbimento della radiazione che attraversa un campione di sostanza in
soluzione viene misurato da uno strumento noto come spettrofotometro.
Legge di Lambert e Beer
L’assorbimento di radiazione luminosa da parte di una sostanza in soluzione viene
descritto quantitativamente con la legge di Lambert e Beer, l’equazione
fondamentale della spettrofotometria.
A= Assorbanza (o densità ottica); è un numero
adimensionale, il cui valore varia linearmente con la
concentrazione della soluzione.
ε=Coefficiente di estinzione molare (mM-1xcm-1); la
densità ottica di una soluzione a concentrazione unitaria
e misurata in un cammino ottico lungo 1 cm. È una
costante specifica di ogni sostanza a una data lunghezza
d’onda.
d=Cammino ottico della soluzione (cm).
C=Concentrazione della soluzione della sostanza (mM)
Reazione usata per la misura dell’attività
enzimatica della fosfatasi alcalina
PNPP
PNP
pH = 9
2 mM Mg2+
La fosfatasi alcalina è un enzima Mg-dipendente che catalizza l’idrolisi di tutti i
fosfomonoesteri. Si esegue il saggio enzimatico con un composto non naturale
sintetizzato chimicamente: il p-nitrofenilfosfato (PNPP) che viene idrolizzato a pnitrofenolo (PNP) e fosfato (Pi). La forma ionica del PNP è colorata (massimo di
assorbimento a 405 nm) quindi la reazione può essere misurata
spettrofotometricamente.
Poiché la variazione di [S] rispetto a t è pressoché lineare nelle fasi iniziali è possibile
eseguire analisi accurate di V in funzione di [S].
Una volta ottenuti i dati riguardo l’andamento di V in funzione di [S] come è possibile
determinare KM e kcat? Comunemente viene usato il grafico dei doppi reciproci o di
Lineweaver-Burk che è un riarrangiamento dell’equazione di Michaelis-Menten:
1/V = (KM+[S])/(Vmax[S])=KM/(Vmax[S])+[S] /(Vmax[S])
Ovvero:
1/V = KM/(Vmax[S])+1 /Vmax
Quando 1/[S] = 0 significa che [S] è infinitamente grande e la velocità di reazione è al suo valore massimo.
Si noti che avendo Vmax e [E]t si può calcolare kcat, sapendo che Vmax = kcat[E]t.
Per ottenere il valore di Km estrapoliamo il grafico di Lineweaver-Burk a un punto ipotetico in cui 1/V=0.