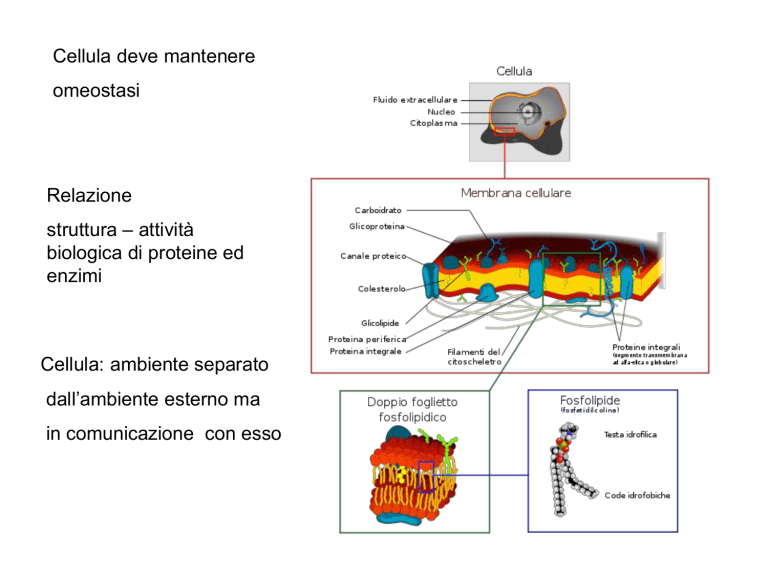
Cellula deve mantenere
omeostasi
Relazione
struttura – attività
biologica di proteine ed
enzimi
Cellula: ambiente separato
dall’ambiente esterno ma
in comunicazione con esso
Elementi essenziali
H
He
Li
Be
B
C
N
O
F
Ne
Na Mg
Al
Si
P
S
Cl
Ar
K
Ca
Sc
Ti
V
Cr Mn Fe
Rb
Sr
Y
Zr
Nb Mo
Cs
Ba
La
Hf
Ta
W
Co
Ni
Cu
Zn
Ga
Ge
As
Se
Br
Kr
Tc
Ru Rh
Pd
Ag
Cd
In
Sn
Sb
Te
I
Xe
Re
Os
Pt
Au Hg
Tl
Pb
Bi
Po
At
Rn
Ir
La loro assenza non consente una normale attività cellulare
La concentrazione di un elemento essenziale è un parametro importante
positiva
Sintomi da
deficienza
Stato di “salute”
Effetti tossici
Risposta
fisiologica
negativa
morte
morte
Concentrazione dell’elemento essenziale
Tabella 1
Elemento deficitario
Tipici sintomi da deficit
Ca
Ritardo crescita scheletrica
Mg
Crampi muscolari
Fe
Anemia
F
Carie dentale
I
Disfunzioni della tiroide
Mn
Infertilità
Zn
Ritardo maturazione sessuale
Funzioni biologiche svolte dagli elementi inorganici.
funzione strutturale (es. Ca2+ e Mg2+ per il polianione DNA)
portatori di carica per il trasferimento veloce di informazioni (es.
Na+, K+, per gli impulsi elettrici nei nervi, Ca2+ per la contrazione
muscolare)
formazione, metabolismo e degradazione di composti organici.
Queste funzioni richiedono catalisi acido/base secondo Lewis (es.
Zn2+)
processi di trasferimento elettronico. Questa funzione richiede
elementi con attività redox (es. FeII/FeIII/FeIV, CuI/CuII, CoI/CoII)
La reazione tra uno ione metallico e una o più molecole di legante dà un
complesso.
[Co(NH3)6]3+ ione Co3+ è circondato da 6 molecole di NH3
La reazione di formazione di un complesso è una reazione tra un acido di
Lewis (lo ione metallico centrale) e una base di Lewis (il legante). L’atomo
del legante che forma il legame con lo ione metallico si chiama atomo
donatore, mentre lo ione metallico è l’atomo accettore
I complessi possono essere carichi o neutri:
Es. [Cu(NH3)4]2+, Ni(CO)4, [Fe(CN)6]3i leganti si distinguono in monodentati e polidentati
Il numero di coordinazione dello ione è il numero di atomi del/dei
leganti che si coordinano al centro metallico. Esso non sempre
coincide al numero di molecole di legante in un complesso. Es.
[Cu(NH3)4]2+, Ca(EDTA)2-. Dipende dalle dimensioni dello ione
metallico, dall’ingombro dei leganti e dalle interazioni elettroniche tra i
due.
Tabella 2: leganti monodentati
formula
Nome come
legante
Molecole
neutre
formula
Nome come
legante
Anioni
formula
Nome come
legante
Anioni
H2O
aquo
F-
Fluoro
SO42-
Solfato
NH3
ammino
Cl-
Cloro
NO2-
Nitro (atomo
N lega)
CO
carbonile
Br-
Bromo
ONO-
Nitrito
(atomo O
lega)
NO
nitrosile
I-
Iodo
SCN-
Tiocianato
(atomo S
lega)
C5H5N
piridina
O2-
Osso
NCS-
Isotiocianato
(atomo N
lega)
OH-
Idrossi
CN-
ciano
leganti multidentati
NH2
H2N
N
N
HN
NH
N
N
Numero di coordinazione 4:
Geometria tetraedrica: favorita
se atomo centrale è piccolo o
se i leganti sono grandi
Geometria piano quadrata: si
osserva per i metalli con
configurazione d8 (es cis
platino)
Numero di coordinazione 5:
Poco comune, piramide a
base quadrata (eme + istidina)
o bipiramide a base
triangolare
Numero di coordinazione 6:
Geometria ottaedrica: molto
diffusa, spesso è il punto di
partenza per geometrie di
simmetria inferiore
Nei complessi ci sono vari tipi di isomerie
[PtCl2(NH3)2]
Esistono due isomeri di tipo geometrico
NH3
cis
Cl
trans
Teoria del campo cristallino
Descrive i composti di coordinazione, ne spiega le proprietà
spettroscopiche (es. il colore) e quelle magnetiche
La teoria prevede che l’interazione tra metallo e leganti sia
puramente elettrostatica
Metallo è costituito da un
nucleo carico positivamente
circondato da elettroni degli
orbitali d
Leganti che circondano lo
ione metallico sono visti come
cariche negative puntiformi
Quando i leganti si avvicinano allo ione metallico
interagiscono con gli elettroni d del metallo
fra gli assi cartesiani a 45°
lungo gli assi cartesiani
Il baricentro resta inalterato
e
n
e
r
g
i
a
dx2-y2 dz2
eg
Do
dxy dxz dyz dx2-y2 dz2
Ione metallico libero
Ione metallico
in un campo
cristallino
sferico
dxy dxz dyz
t2g
Ione metallico in un
campo cristallino
ottaedrico
DO dipende dalla forza del legante:
Legante a campo
debole
e
n
e
r
g
i
a
Legante a campo
forte
eg
dx2-y2 dz2
dx2-y2 dz2
eg
Do
Do
t2g
dxy dxz dyz
dxy dxz dyz
t2g
I- < Br- < SCN- < Cl- < F- < OH- < H2O < NH3 < en < phen< CN-< CO
Forza del legante
Il valore di Do dipende anche dall’identità dello ione metallico
Mn2+< Ni2+< Co2+< Fe2+< V2+< Fe3+< Co3+< Mo3+< Rh3+< Ru3+< Pd4+< Ir3+
Do :
aumenta con lo stato di ossidazione del metallo (es. Fe e Co). Fe3+ è più
piccolo e le distanze metallo-legante sono minori e quindi le interazioni
sono più forti
aumenta scendendo lungo un gruppo (es Co, Rh, Ir). A parità di carica, le
dimensioni dei 4d e dei 5 d sono maggiori di quelle dei 3d e quindi anche
le interazioni con i leganti sono maggiori.
Configurazioni elettroniche di un complesso allo stato
fondamentale non è più così ovvia
Ti3+
Ti2+
V2+
Cr2+
Fe3+
Fe2+
Co2+
Ni2+
Cu2+
Zn2+
d7
d8
d9
d10
Alto spin
d1
d2
d3
d4
d5
d6
Basso spin
Configurazione d4
[Cr(H2O)6]2+
[Cr(CN)6]4-
D O< P
DO > P
S=2
S=1
Ione Fe2+: configurazione d6
Do basso
Do elevato
Alto spin
Basso spin
S=2
S=0
Uno ione metallico di transizione non complessato ha orbitali d degeneri.
In un complesso gli orbitali d sono separati in energia e sono possibili transizioni d-d a
seguito dell’assorbimento di energia pari a Do.
eg
e
n
e
r
g
i
a
dx2-y2 dz2
dx2-y2 dz2
eg
Do
dxy dxz dyz
t2g
dxy dxz dyz
Le energie richieste cadono nella
regione
del visibile e i complessi dei metalli di
transizione sono colorati.
Do= E = hn = hc/l
t2g
Complessi a geometria tetraedrica
Poiché i leganti
sono solo 4 e
nessuno di loro
punta
direttamente sugli
orbitali d
D T < DO
I complessi
tetraedrici sono ad
alto spin
Geometria piano quadrata
Lo splitting degli orbitali
d vede il dx2-y2 più in alto
in energia rispetto agli
altri. Ciò favorisce
complessi di metalli d8 a
basso spin o di metalli
di 4a o 5a serie di
transizione (es. cisplatino)
LEGANTI DI INTERESSE BIOLOGICO
peptidi e/o proteine attraverso residui aminoacidici
leganti chelanti macrociclici
basi azotate degli acidi nucleici
1) residui aminoacidici di proteine
Aminoacid
R
Aminoacid
N
histidine
CH2
R
tyrosine
CH2
aspartate
CH2COO
glutamate
CH2CH2COO
OH
N
H
methionine
CH2CH2SCH3
cysteine
CH2SH
-
-
I complessi di coordinazione tra ioni metallici e residui
aminoacidici presenti nei sistemi biologici possono presentare
coordinazione completa o incompleta attorno allo ione metallico
in relazione all’attività biologica (es. se il substrato si deve
legare al metallo, se deve avvenire solo un trasferimento
elettronico…ecc.)
Con ioni tipo Fe2+ le proteine formano complessi stabili
termodinamicamente ma labili dal punto di vista cinetico
La stabilità cinetica è garantita da un’altra classe di leganti
2a) leganti macrociclici tetradentati
Tutti C sp2
Orbitale p
non ibrido
per
coniugazione
doppi legami
planare
Manca
un ponte
metinico
N H
H
N
N
N H
N
N
H
N
N
sp3
porphyrin
N
N
chlorin
(2,3 dihydroporphyrin)
N
N
M
NH
N
corrin
N
N
metalloporphyrin complex
Eme, clorofilla, cobalamine
PRINCIPALI PROPRIETA’ DEI LEGANTI TETRAPIRROLICI
anello planare, nessuno stress geometrico (lunghezze ed
angoli di legame)
assicurano stabilità cinetica al complesso chelato
data la rigidità dell’anello sono selettivi sulle dimensioni
dello ione e accolgono ioni metallici di raggio 60-70 pm. Fe2+
basso spin ha raggio di 61 pm, Fe2+ alto spin ha raggio di 78
pm.
il sistema coniugato p è responsabile del colore intenso di
questi leganti e dei relativi complessi. Sono i pigmenti della
vita.
il metallo tetracoordinato può fare altri due legami
sfruttando le posizioni assiali (es. eme dell’emoglobina)
X
N
N
M
N
N
Y
2b) Ionofori, leganti macrociclici multidentati
good for coordination of Na+,
K+, Mg2+, Ca2+
Multiple heteroatoms are
strategically positioned for
bonding metal ions
ring size is tailored to fit metal
ionic radius
Dissociation is possible but
very unlikely
Inner cavity is polar, outside is
lipophile. So these complexes
can be transported through
biological membranes.
Complessi
macrociclici
tridimensionali
Etere corona che coordina uno ione K+
EFFETTO CHELATO
La sostituzione di leganti monodentati da parte di leganti chelanti è
accompagnata da un forte guadagno di stabilità termodinamica
[Co(NH3)6]3+ + 3en
K=
[Co(en)3]3+ + 6 NH3
[[Co(en)3]3+] [NH3]6
[[Co(NH3)6]3+] [en]3
DG° = - RT lnK
DG° = DH° -TDS°
Reazione con legante chelante
[Cd(H2O)6]2+ + en
DH° = -29.4 kJmol-1
[Cd(en)(H2O)4]2+ + 2 H2O
DS° = +13.0 JK-1mol-1
DG favorevole Kf elevata
Reazione con legante NON chelante
[Cd(H2O)6]2+ + 2NH3
DH° = -29.8 kJmol-1
[Cd(NH3)2(H2O)4]2+ + 2 H2O
DS° = -5.2 JK-1mol-1
DG meno favorevole, Kf più bassa
DG° = - RT lnK
DG° = DH° -TDS°
Il vantaggio entropico è tanto maggiore quanto maggiori sono le
proprietà chelanti del legante
3) Basi azotate
amino
amido
NH2
N
N
imine
N
HN
N
N
NH2
O
R
N
O
R
adenine
guanine
O
cytosine
R' = CH3 thymine
R' = H uracil
HO
O
N
R
R
hydroxo
HN
N
N
NH
NH2
N
N
R
R
R = ribose or deoxyribose
NH
R'
HN
N
N
N
H2N
O
O
N
R
oxo
Coordinano ioni metallici utili a neutralizzare la carica negativa del DNA.
Offrono diversi siti per la coordinazione.
CONCETTO HARD-SOFT
Metalli (acidi Lewis)
Hard
H+
Na+
K+
Mn2+
Al3+
Fe3+
Borderline
Fe2+
Ni2+
Co2+
Cu2+
Soft
Cu+
Hg2+
Pt2+
Cd2+
Es. criptati e ferro-porfirine
Cr3+
Co3+
Mg2+
Leganti (basi Lewis)
Ca2+
CO32RNH2
PO43-
Borderline
NO2SO32Imidazole
Zn2+
Pt4+
Pb2+
Hard
H2O
NO3ROH
Au+
Soft
R2S
RNC
RSCN-
NH3
OHCH3CO2ROClBr-
R3P
SCN-
RSH
CO
“un metallo hard lega
facilmente ed in modo stabile un legante hard
un metallo soft lega
facilmente ed in modo stabile un legante soft”
Metallotioneine
Basano la loro attività biologica esclusivamente
sul concetto hard-soft
30-35% of aminoacid are
cysteins with soft –SH
groups
repetitive distribution of
Cys-X-Cys etc…
coordination of soft heavy
metal ions such as Cd2+,
Hg2+, Pb2+, Zn2+.
biological function of
metallothioneins is to protect
cells from toxic heavy metals












