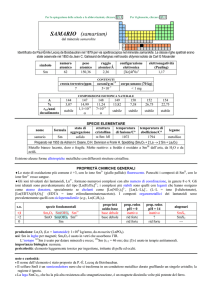
Sequestrazione di ioni metallici (Versione italiana)
Il termine “sequestrazione” fu usato per la prima volta da R.E. Hall [1] in un brevetto relativo ad alcune
proprietà dei fosfati. Con l’introduzione degli acidi ammino carbossilici, in particolare l’acido etilene
diammino tetra carbossilico (EDTA), il termine è stato sempre più associato alle proprietà dei composti
aventi azione simile a quelle descritte da Hall. La sequestrazione è la soppressione di una proprietà o di una
reazione di un metallo senza che avvenga la rimozione del metallo dal sistema o dalla fase in cui si trova
attraverso processi di precipitazione o di estrazione con solvente o mediante l’uso di tecnologie come lo
scambio ionico o l’uso di resine chelanti. Si può affermare che la sequestrazione consiste nella formazione
di uno stato di coordinazione dello ione metallico più forte di qualunque altra coordinazione dello stato
precedente. Dunque, si può assumere che la sequestrazione di uno ione metallico è un processo chimico
che avviene in soluzione nel quale lo ione metallico rimane all’interno della soluzione stessa ma con una
concentrazione libera notevolmente ridotta, tanto più quanto maggiore è la forza dell’agente sequestrante,
cioè quanto più stabile è la specie complessa formata dallo ione metallico con il legante aggiunto
dall’esterno o naturalmente presente in soluzione (come, ad esempio, le sostanze umiche nelle acque
naturali). La riduzione della concentrazione dello ione metallo libero influenza fortemente la mobilità, la
biodisponibilità e la tossicità degli ioni metallici nei sistemi naturali, incluso il corpo umano. Sulla base delle
considerazioni fatte, si deduce che è di grande importanza conoscere il comportamento acido-base degli
ioni metallici in soluzione e in particolare in presenza di leganti di forza differente: questo significa
conoscere (o determinare sperimentalmente) le costanti di formazione delle specie idrolitiche dello ione
metallico e di tutte le possibili specie complesse che esso è in grado di formare con le differenti classi di
leganti, al fine di avere un quadro completo della stabilità dei sistemi. Dopo avere individuato la specie
metallo-legante più stabile in soluzione, si pone la domanda: quale è la concentrazione di legante
necessaria per sequestrare lo ione metallico ? Per risolvere la questione il nostro gruppo di ricerca ha
utilizzato la seguente equazione sigmoidale tipo Boltzman
x
1
1 10
( pL pL0.5 )
dove:
pL = –log [L] (concentrazione totale di legante);
pL0.5 = -log[L] necessaria a sequestrare il 50% dello ione metallico presente in soluzione;
x = frazione dello ione metallico complessato dal legante che è data da:
x
[M]
tot
[M] free [M] other
[M]
tot
con [M]tot = concentrazione analitica dello ione metallico; [Me]free = concentrazione dello ione metallico
libero; [M]other = sommatoria delle specie formate dallo ione metallico con altri leganti presenti in soluzione
(ad es., l’anione del mezzo ionico o lo ione idrossile)
[1]
Smith R.L., Marriott R.H., Aiken J.K. Peck D.R:, Chalk A.J. and Smith J.F. (1956). Letters to the Editor on the
meaning of sequestration. Chem. & Ind., 320, 462-463
Alcuni recenti articoli pubblicati sulla tematica “Metal Sequestration”
1) A. Gianguzza, D. Piazzese et al. Quantitative parameters for the sequestering capacity of polyacrylates
towards alcaline earth metal ions. Talanta, 61, (2003), pp. 181-194.
2) A. Gianguzza, D. Piazzese et al. Sequestration of biogenic amines by alginic and fulvic acids. Biophysical
Chem., 122, (2006), 221-231
3) A. Gianguzza. A. Pettignano et al. Sequestration of organometallic compounds by natural organic
matter. Binding of trimethyltin(IV) by fulvic and alginic acids. Appl. Organomet. Chem., 20, (2006), 706717.
4) A. Gianguzza, A. Pettignano et al. Sequestering ability of polyaminopolycarboxylic ligands towards
dioxouranium(VI) cation. J. Alloys and Compounds, 424, (2006), 93-104.
5) A. Gianguzza, A. Pettignano et al. Sequestration of organometallic compounds by synthetic and
naturally occurring polycarboxylate ligands. Binding of monomethylmercury(II) by polyacrylic and
alginic acids. Chem. Spec. Bioavailab., 19(3), (2007), 131-142.
6) A. Gianguzza, A. Pettignano et al. Interaction of methyltin(IV) compounds with carboxylate ligands. Part
2: formation, thermodynamic parameters, predictive relationships and sequestering ability. Appl.
Organomet. Chem., 22, (2008) 30-38.
7) A. Gianguzza, A. Pettignano et al. Palladium(II) sequestration by phytate in aqueous solution –
speciation analysis and ionic medium effects. Environ. Chem. 2010, 7, 259–267.
8) A. Gianguzza, A. Pettignano, D. Piazzese et al.Uranium(VI) sequestration by polyacrylic and fulvic acids
in aqueous solution. J. Radioanal. Nucl. Chem., (2011) 289:689–697.
9) S. Cataldo, A. Gianguzza, A. Pettignano et al. Sequestration of (CH3)Hg+ by amino‐polycarboxylic
chelating agents. J. Molec. Liquids, 172 (2012) 46–52.
10) A. Gianguzza, A. Pettignano, D. Piazzese et al. Sequestering ability of some chelating agents towards
methylmercury(II). Anal. Bioanal. Chem., (2013) 405:881–893.