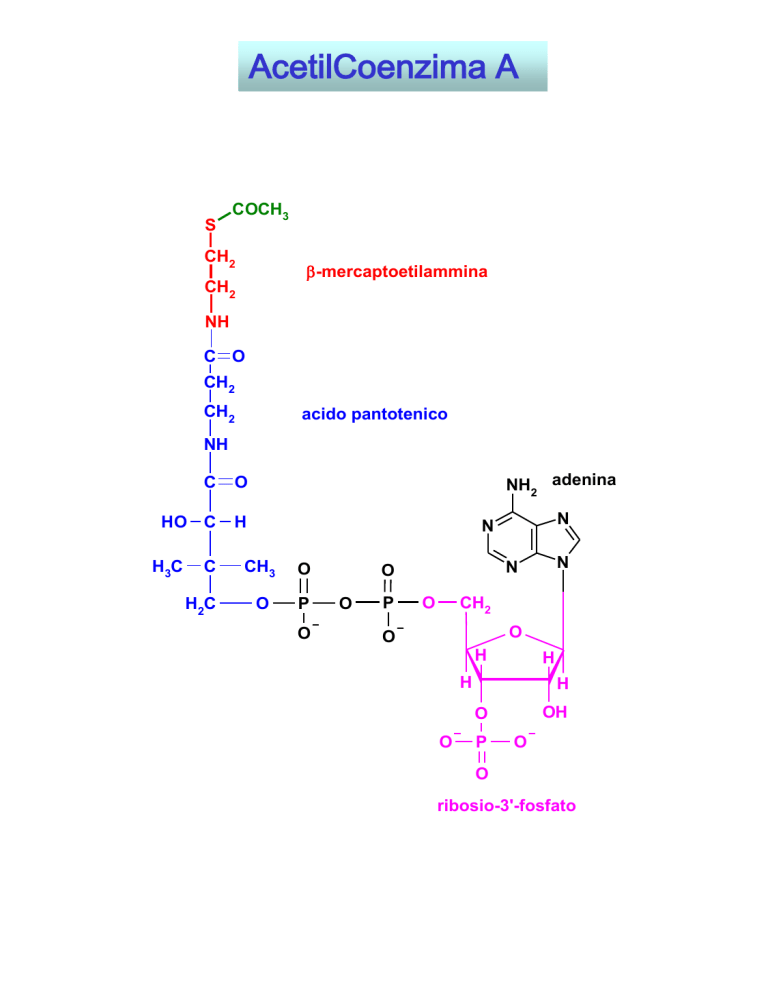
AcetilCoenzima A
S
COCH3
CH2
-mercaptoetilammina
CH2
NH
C O
CH2
CH2
acido pantotenico
NH
C
O
HO C
H
H3C
C
H2C
NH2 adenina
N
N
CH3
O
O
P
O
O
P
N
N
O
O
CH2
O
O
H
H
H
H
OH
O
O
P
O
O
ribosio-3'-fosfato
Metaboliti dell’AcetilCoA
Acidi Grassi
Carboidrati
Amminoacidi
AcetilCoA
MalonilCoA
AcetoacetilCoA
Acidi Grassi
Derivati degli
acidi grassi
(Prostaglandine
Feromoni
Poliacetileni
Acidi insaturi…)
Acetogenine
lineari
Polichetidi
Acido
Mevalonico
Poliisoprenoidi
(Terpenoidi
Steroidi
Carotenoidi)
(Fenoli, Chinoni
Benzofenoni
Xantoni
Macrolidi
Tetracicline
Aflatossine
Flavonoidi
Acetogenine
cicliche
Biosintesi degli acidi grassi
CH3COSCoA + HSACP
CH3COSACP + HSCoA
Acetil-ACP
CO2
-O CCH COSCoA
2
2
-O CCH COSACP
2
2
+ HSACP
+ HSCoA
Malonil-ACP
-O CCH COSACP
2
2
CH3-C O
-CO2
H3C
CH2COSACP
O
SACP
H3C
Condensazione
di Claisen
SACP
H
NADPH
CH3COCH2COSACP
Acetoacetil-ACP
-HSACP
H3C
-H2O
OH
R
CH2COSACP
-Idrossibutirril-ACP
I Stadio
Riduzione
Eliminazione
NADPH
CH3CH2CH2COSACP
COSACP
E-crotonil-ACP
II Stadio
Riduzione
ACP: Acyl Carrier Protein
Iterati stadi
di allungamento della catena
Butirril-ACP
MalonilCoA
RCH2CH2CH2COSACP
HSCoA
H 2O
RCH2CH2CH2COSCoA
RCH2CH2CH2COOH
Acido grasso libero a numero
pari di atomi di carbonio
Se si usa acido acetico marcato su C1 o C2
*
n CH3 COOH
*
*
*
CH3CH2 CH2 CH2...........COOH
Formazione del MalonilCoA
O
HO
O-
+
ATP
O
HN
NH
H
H
(CH2)4 COOH
S
O
O
HO C O P O O-
+
H
Biotina
O
O
HO
H
+
H
(CH2)4 COOH
SCoA
O
Biotina
NH
N
H
S
H
MalonilCoA
N1-carbossibiotina
H
HO2C-CH2-COSCoA
H
AcetilCoA
La reazione complessiva:
AcetilCoA +
HCO3- +
H+ +
AcetilCoA carbossilasi
ATP
MalonilCoA+ADP+Pi
L’enzima: AcetilCoA Carbossilasi
+citrato
monomero
(inattivo)
dimero
-citrato
(attivo)
L’enzima: acido grasso sintetasi
SH
GRUPPI PROSTETICI:
Cisteina (Cys).
Fosfopanteteina (equivalente
in struttura a parte del coenzima
A, Pant-SH) è legata attraverso
un residuo fosfoestereo al
gruppo ossidrilico di una serina
del dominio della ACP. Il lungo
braccio flessibile della
fosfopanteteina permette di
muovere il residuo tiolico da un
sito attivo ad un altro nel
complesso enzimatico.
-mercapto
etilammina
CH2
CH2
NH
C O
pantotenato
CH2
NH
C
O
HO C
H
H3C
C
H2C
I substrati malonato ed
acetato partecipano alla
reazione enzimatica in forma
di derivati tioesterei del
coenzima A .
I residui tiolici della Cys e PantSH formano legami tioesterei con
i gruppi carbossilici di acetato,
malonato e con l’acido grasso in
fase di accrescimento.
4'-fosfopanteteina
CH2
CH3
O
O
P
O
C
H2
O
Serina posizione 36
O
Cisteina-SH
+
HO
C
R
O
Cisteina-S
C
R
+
O
H
C
H2O
NH
L’enzima : acido grasso sintetasi
Pant-SH
HS-Cys
Cys-SH
HS-Pant
Acido grasso sintetasi dimero
complesso dell’Acido Grasso Sintetasi è un dimero.
Le due porzioni identiche dell’enzima sono allineate in
modo antiparallelo.
•Alla fine di ogni ciclo di reazioni, la catena dell’acido
grasso in crescita è trasferito dalla fosfopanteteina di
una subunità al residuo di cisteina dell’altra subunità
del dimero.
• L’arrangiamento antiparallelo favorisce il trasferimento
tra le subunità. La distanza tra i residui tiolici di cisteina
e fosfopanteteina tra le due subunità è minore di quella
tra tali residui all’interno della stessa subunità.
• Il
La reazione enzimatica
Stadi 1-3
acetil -S-CoA
Pant
Cys
SH
SH
1
HS-CoA
malonil -S-CoA
Pant
Cys
SH
S
C
CH3
1 Transacilasi
2 Malonil-CoA-ACP Transacilasi
3 Malonil ACP Transferasi
2
O
HS-CoA
CO2
Pant
Cys
S
S
C
O
CH2
COO-
C
3
O
CH3
Pant
Cys
S
SH
C
O
CH2
C
CH3
Si ha condensazione di Claisen tra una unità di malonile
legata al residuo di Pant-SH di una subunità del dimero con
una unità di acetato legata ad un residuo di Cys dell’altra
subunità con formazione di acetoacetil legato all’unità di
Pant-SH
O
La reazione enzimatica
Stadi 4-6
NADPH
Pant
52 S
54 C
SH
19
O
CH2
56 C
CH3
4
Cys
NADP+
H2O
Pant
4
35 S
37 C
Cys
SH
60
O
CH2
O
HC
39
Pant
5
62 S
64 C
CH3
Cys
SH
78
O
CH
OH
NADP+
NADPH
66 HC
CH3
Pant
6
70 S
72 C
Cys
SH
49
O
CH2
74 CH2
CH3
-Chetoacil-ACP Reduttasi
5 -Idrossiacil-ACP Deidratasi
6 Enoil-ACP Reduttasi
•Il -dichetone è ridotto ad alcol mediante trasferimento elettronico
da NADPH.
•La disidratazione porta ad un doppio legame con configurazione
trans.
•La riduzione del doppio legame con NADPH dà luogo alla catena
idrocarburica satura dell’acido grasso.
La reazione enzimatica
Stadio 7 e successivi
Malonil-S-CoA
Pant
Cys
S
SH
C
O
7
Pant
Cys
SH
S
C
2
O
CH2
CH2
CH2
CH2
CH3
CH3
HS-CoA
Pant
Cys
S
S
C
O
CH2
COO -
C
O
CH2
CH2
CH3
7 ACP aciltransferasi
2 Malonil-CoA-ACP Transacilasi (si ripete lo stadio 2)
L’acido grasso è trasferito dal residuo di Pant-SH alla Cys
ed il ciclo ricomincia per reazione con un’ altra unità di
malonil-CoA
Acidi grassi da fonti naturali: alcuni esempi
Struttura
Nome
CH3 (CH2)8 COOH
10 : 0
Caprico
CH3 (CH2)10 COOH
12 : 0
Laurico
CH3 (CH2)12 COOH
14 : 0
Miristico
CH3 (CH2)14 COOH
16 : 0
Palmitico
CH3 (CH2)16 COOH
18 : 0
Stearico
CH3 (CH2)7 CH = CH (CH2)7 COOH
18 : 1 (9Z)
CH3 (CH2)4 (CH = CH CH2)2 (CH2)6 COOH
18 : 2 (9Z, 12Z)
CH3 (CH2) (CH = CH CH2)3 (CH2)6 COOH
18 : 3 (9Z, 12Z, 15Z)
CH3 (CH2)4 (CH = CH CH2)4 (CH2)2 COOH
20 : 4 (5Z, 8Z, 11Z, 14Z)
8
11
5
14
COOH
Oleico
Linoleico
Linolenico
Arachidonico
I TRIGLICERIDI
OH
O
OP
Diidrossiacetone fosfato
Glicerolo 3-P deidrogenasi
R1COSCoA
OH
R2COSCoA
OCOR1
HO
HO
OP Glicerolo fosfato acil trasferasi
Glicerolo 3-P
OP
Glicerolo fosfato acil trasferasi
1-acilglicerolo 3-P
(Acido lisofosfatidico)
OCOR1
R2OCO
OP
OCOR1
H2O
Fosfatidico fosfatasi
1,2-diacilglicerolo 3-P
(Acido fosfatidico)
R2OCO
OH
1,2-diaciglicerolo
Diacilglicerolo acil trasferasi
R3COSCoA
OCOR1
R2OCO
OCOR3
triacilglicerolo
(trigliceride)
I FOSFOLIPIDI
R2COO
OCOR'
O
+
CH2CH2NMe3
R3 =
O P OR'''
Fosfatidilcolina
+
CH2CH2NH3
OH
Fosfatidiletanolamina
CH2 CHCO2H
Fosfatidilserina
NH2
HO
Fosfatidil-mio-inositolo
OH
OH
OH
OH
MeCOO
OR
O
+
O P OCH2CH2NMe3
per es. R = (CH2)15CH3
OH
Fattore di attivazione piastrinica
(PAF)
Attiva le piastrine; è un cofattore
nei processi infiammatori, nella
risposta allergica e nelle trombosi
Biosintesi degli acidi grassi insaturi
9
COOH
10
O2, FAD, NADPH
9 desaturasi
in eucarioti
. 9 o 10
O2 [H]
OOH
[H]
OH
- H2O
9
COOH
Acido Oleico
12
9
COOH
Acido Linoleico
Relazioni Biogenetiche tra Acidi Grassi Insaturi
CO - SR
Acido stearico
18 : 0
R = CoA animali/fumghi
R = ACP piante
desaturazione verso il
terminale metilico
piante
funghi
CO-SR
CO-SR
Acido Oleico
18 : 1 (9Z)
animali
piante
funghi
CO-SR
Acido -Linolenico
18 : 3 (9Z,12Z, 15Z)
Acido Linoleico
18 : 2 (9Z,12Z)
desaturazione verso il
terminale carbossilico
CO - SR
18 : 2 (6Z,9Z)
animali
animali
Acidi grassi
essenziali EFA
CO-SR
CO-SR
Acido -Linolenico
18 : 3 (6Z,9Z,12Z)
Acido stearidonico
18 : 4 (6Z,9Z,12Z,15Z)
+ C2 (malonato)
+ C2 (malonato)
CO-SR
CO-SR
Acido diomo--linolenico
20 : 3 (8Z,11Z,14Z)
Il nome è quello
dell'acido grasso
libero, le
strutture mostrano i
rispettivi tioesteri
20 : 4 (8Z,11Z,14Z,17Z)
CO-SR
CO-SR
Acido arachidonico
Acido eicosapentaenoico (EPA)
20 : 4 (5Z, 8Z,11Z,14Z)
20 : 5 (5Z,8Z,11Z,14Z,17Z)
+ C2 (malonato)
CO-SR
Acido docosaesanoico (DHA)
22 : 6 (4Z,7Z,10Z,13Z,16Z, 19Z)
CO-SR
Acido docosapentaenoico (DPA)
22 : 5 (7Z,10Z,13Z,16Z,19Z)
Acidi Grassi Acetilenici
CO2H
acido oleico 18:1 (9c)
CO2H
acido linoleico 18:2 (9c,12c)
In piante
della famiglia
delle
Compositae
ed
Umbelliferae
CO2H
acido crepeninico 18:2 (9c,12a)
CO2H
acido deidrocrepeninico 18:3 (9c,12a,14c)
CO2H
18:3 (9c,12a,14a)
CO2H
18:4 (9c,12a,14a,16a)
-ossidazioni
H+
CO2H
acido deidromatricaria 10:4 (2t,4a,6a,8a)
H
isomerizzazione
allilica
Metaboliti acetilenici delle Umbellifere
OH
OH
cicutotossina
Nella cicuta acquatica
(Cicuta virosa)
Nell’ Oenanthe
crocata
OH
OH
enantotossina
Estremamente tossici per i mammiferi. L’ingestione
delle radici provoca vomito e convulsioni.
Frequentemente l’avvelenamento è fatale
Acidi Grassi Ramificati
Ad
H3C S +
R
SAM
O
SCoA
oleil-CoA
H
H2C
+
O
SCoA
-H+
intermedio carbocationico
NADPH
CO2H
acido diidrosterculico
CO2H
ossidazione
Acido tuberculostearico
CO2H
Acido sterculico
-ossidazione
Nell’olio di semi della
Sterculia foetida
Inibitore della 9
desaturasi può
provocare alterazione
permeabilità membrane
negli esseri umani.
CO2H
Acido malvalico
Metabolismo ossidativo
dell’acido arachidonico
Acido arachidonico
Cicloossigenasi
O
Lipoossigenasi
COOH
OOH
O
COOH
OR
R = OH : PGG2
R= H
5-HPETE
: PGH2
Prostaglandine
Tromboxani,
Prostacicline
Acidi grassi
ossidrilati
Leucotrieni
Prostaglandine
• Scoperte nel 1930 da Von Euler nel liquido seminale,
sono state rinvenute successivamente in vari organi
tra cui le vescicole seminali, l’utero e i reni. Una
fonte molto ricca di prostaglandine è costituita dalla
Plexaura Homomalla, un corallo del Mar dei
Caraibi.
• L’isolamento e la caratterizzazione chimica
risalgono agli anni ’60 e sono dovuti al gruppo di
Bergstrom.
• Sono attive in quantità estremamente ridotte,
regolano la pressione arteriosa, stimolano la
contrazione della muscolatura liscia, la secrezione
gastrica e inibiscono l’aggregazione piastrinica.
Prostacicline
• Il più potente inibitore naturale della aggregazione
piastrinica, vasodilatatore.
Tromboxani
• Esercitano effetto vasocostrittore su tutti i distretti
vascolari, da quello coronarico a quello cerebrale
• Possono essere potenti aggreganti piastrinici
Origine delle diverse prostaglandine
da acidi grassi poliinsaturi
8
COOH
COOH
COOH
Acido 8, 11, 14 -eicosatrienoico
O
9
Acido 5, 8, 11, 14 -eicosatetraenoico
(acido arachidonico)
O
O
COOH
8
HO
OH
PGE1
Acido 5,8,11,14,17
Eicosapentenoico
COOH
HO
OH
COOH
HO
PGE2
OH
PGE3
COOH
Acido prostanoico
•Anello ciclopentanico
•Catena laterale C-7 con funzione carbossilica
•Catena laterale C-8 con terminale metilico
Nomenclatura semisistematica prostaglandine
Configurazione al C-9
sotto il piano nelle PG
naturali
PGF2
Prostaglandina
Sostituenti
sull’anello a 5
termini
O
Numero doppi
legami catene
laterali
O
O
R
HO
R
R'
R
R'
A
R'
B
R
R'
R'
O D
C
OH
O
R
HO
E
OH
R
R
CO2H
R'
HO
R'
HO
F
F
R1
O
O
PGG
O
OH
O
R1
O
R2
O
PGH
HO
R2
R1
CO2H
serie 1
OH
serie 2
CO2H
serie 3
CO2H
OH
OH
R
2
PGI
Biosintesi delle prostaglandine
O.
.
O
COOH
COOH
.
O
H
O
.
O
Acido arachidonico
O
COOH
O
[H]
.
O
COOH
O
O
OOH
O
O
.
PGG2
perossidasi
O
COOH
O
O
OH
COOH
PGH2
HO
.
.
O
COOH
.
OH
PGE2
.
+H , -H
HO
O
COOH
OH
.
+2H
O
HO
COOH
HO
OH
PGF2a
OH
PGD2
Biosintesi di trombossani e prostacicline
.
O
COOH
O
COOH
.
O
O
OOH
OH
PGH2
[H]
.
O
COOH
.
O
O
.
H
O
OH
COOH
[H]
H
.
O
COOH
O
O
HO
Tromboxano A2
Provoca aggregazione
determinando un aumento di
ioni calcio nel citoplasma. Si
ha una deformazione delle
piastrine e quindi si ha
l’aggregazione.
Riduce le concentrazioni di
ioni calcio e inibisce
l’aggregazione piastrinica
HO
OH
COOH
L’idrolisi
dell’enoletere
inattiva la
molecola
O
HO
OH
Prostaciclina, PGI2
Biosintesi di leucotrieni
O
O OH
O
CO2H
CO2H
H
H
Acido arachidonico
idroperossido
-H2O
H2O :
HO
O
CO2H
CO2H
OH
LTA4
LTB4
OH
CO2H
Glutatione
(-glutammilcisteinilglicina)
OH
CO2H
-Glu
S
S
LTD4
H
N
H2N
O
CO2H
O
HO2C
N
H
NH2
-Gly
Glu
OH
CO2H
H
N
O
Cys Gly
LTC4
S
LTE4
H2N
CO2H
Sono coinvolti nella risposta allergica e nei processi
infiammatori. Miscele di leucotrieni (LTC4, LTD4, e LTE4)
costituiscono le sostanze a lenta reazione (SRSA)
dell’anafilassi responsabili delle reazioni di ipersensibilità.
I leucotrieni contenenti cisteina sono broncocostrittori e
vasocostrittori. LTB4 interviene nell’artrite e nella psoriasi.
CO2H