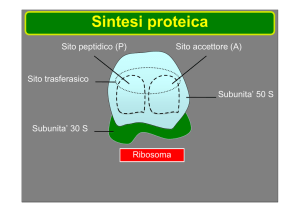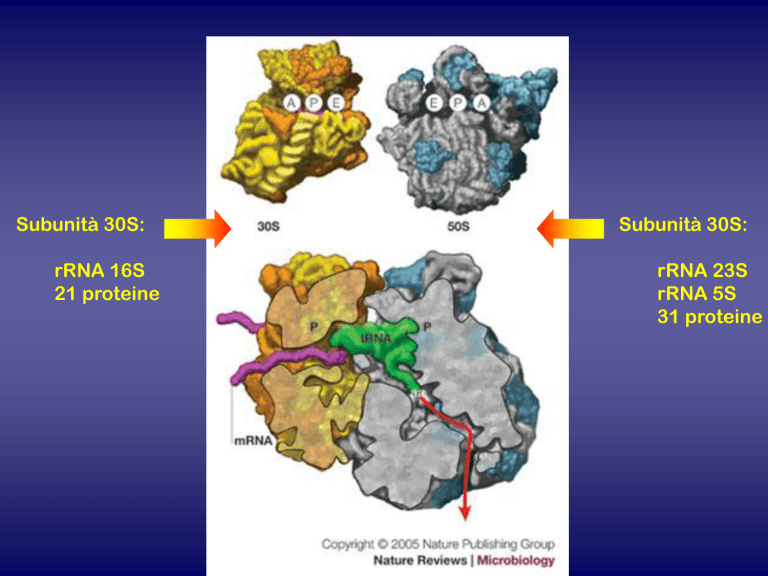
Subunità 30S:
rRNA 16S
21 proteine
Subunità 30S:
rRNA 23S
rRNA 5S
31 proteine
Struttura degli aminoglicosidi
Aminociclitolo
Meccanismo d’azione degli aminoglicosidi
Ipotesi sull’azione battericida degli aminoglicosidi
RESISTENZA
LysAsn
Streptomycin
Proteina S12
SUBUNITÀ 30S
LysGln
DIPENDENZA
Meccanismi di resistenza agli aminoglicosidi
1- Alterazioni del trasporto di membrana
2 – Alterazione dei siti di legame ribosomiali
3 – Inattivazione enzimatica
Inattivazione enzimatica degli aminoglicosidi
CELLULE TUBULARI PROSSIMALI DI RATTO
trattato con gentamicina (10 mg/kg/g x 7 gg)
SEQUENZA DEGLI EVENTI
Incorporazione degli AG (mediante pinocitosi) da parte
delle cellule epiteliali del tubulo prossimale
Trasporto e accumulo degli AG nei lisosomi, e sviluppo
di fosfolipidosi lisosomiale
Rottura (?) dei lisosomi, necrosi cellulare e
fosfolipiduria
Necrosi tubulare/rigenerazione tubulare
Necrosi tubulare acuta
Insufficienza renale
APOPTOSI IN CELLULE TUBULARI PROSSIMALI
trattate con gentamicina (10 mg/kg/g x 10 gg)
NEFROTOSSICITA’ DA AMINOGLICOSIDI
Incidenza 0-50%
in dipendenza da:
fattori legati al paziente
fattori legati al farmaco
schema di somministrazione
trattamenti concomitanti
GENTAMICINA
NETILMICINA
AMIKACINA
Effetti collaterali degli aminoglicosidi
1- Nefrotossicità
2 - Ototossicità
3 - Blocco neuromuscolare
4 - reazioni allergiche
Struttura delle tetracicline
I GENERAZIONE
II GENERAZIONE
Meccanismo d’azione delle tetracicline
Meccanismi di resistenza alle tetracicline
1. Diminuzione dei livelli intracellulari di TC
Ingresso
Acquisizione di sistemi di estrusione
2. Diminuzione dell’accesso delle TC ai siti di legame
ribosomiali
3. Inattivazione delle TC
Resistenza alle tetracicline
Geni tet (27)
Tet (X) 17
8
Tet (U)
Geni otr (3)
Otr (A) Otr (B)
?
Gene tcr3(1)
Otr (C)
?
Ribosomal protection proteins
Proteine di trasporto
Enzima inattivante le TC
Struttura delle glicilcicline
Effetti collaterali delle tetracicline
Effetti GI
•
Irritazione GI
•
Superinfezioni
colite pseudomembranosa da C. difficile
Effetti collaterali delle tetracicline
Fotosensibilizzazione
Effetti GI
•
sintesi proteica ed effetto catabolico
•
Diabete insipido nefrogenico da
demeclociclina
•
Effetto tossico diretto da TC parzialmente
Epatotossicità
Nefrotossicità
Effetti collaterali delle tetracicline
Fotosensibilizzazione
Effetti GI
Epatotossicità
Effetto in
gestazione
Nefrotossicità
Effetto sui denti
Meccanismo d’azione del cloramfenicol
Resistenza
acetilazione da parte della cloramfenicolo-acetiltransferasi
Effetti tossici e collaterali del cloramfenicolo
Tossicità ematologica
Sindrome del bambino grigio:
dovuta a scarsa capacità di glicurono-coniugazione
nel neonato e escrezione renale inadeguata
Encefalopatia; cardiomiopatia:
dovute a inibizione della sintesi proteica mitocondriale
Inibizione degli enzimi farmaco-metabolizzanti epatici
Struttura dei macrolidi
ERITROMICINA
AZITROMICINA
CLARITROMICINA
DIRITROMICINA
Meccanismo d’azione dei macrolidi
Meccanismi di resistenza ai macrolidi
1. Estrusione attraverso meccanismi attivi di pompa
2. Produzione di metilasi che modifica il bersaglio
ribosomiale (geni Erm fenotipo MLSB)
3. Alterazioni cromosomiche modificazioni proteine
ribosomiali
4. Inattivazione per idrolisi
Struttura dei ketolidi
Vantaggi dei ketolidi rispetto ai macrolidi
1. affinità del legame al ribosoma (legame a due
diversi domini del rRNA 23S)
potenza
durata effetto post-antibiotico
2. mancata interazione con i sistemi di efflusso
3. mancata induzione di geni Erm
Struttura degli oxazolidinoni
Antibiotici attivi sulla sintesi proteica
I. ANTIBIOTICI ATTIVI SUI RIBOSOMI
1)
•
•
ANTIBIOTICI CHE LEGANO LA SUBUNITÀ 30S
Aminoglicosidi
Tetracicline
2)
•
•
•
•
•
•
ANTIBIOTICI CHE LEGANO LA SUBUNITÀ 50S
Cloramfenicolo
Macrolidi
Lincosamidi
Streptogramine
Pleuromutiline
Oxazolidinoni
II. ANTIBIOTICI CHE NON SI LEGANO AI RIBOSOMI
•
•
•
Acido fusidico
Puromicina
Mupirocina
Meccanismo d’azione dell’acido fusidico
Ile-tRNA
70S
initiation
complex
Mupirocin
Fusidic acid
Criteri per la selezione di nuovi bersagli per lo
sviluppo di farmaci antibatterici nell’era genomica.
1. Il bersaglio deve svolgere un ruolo essenziale
2. Identificazione del/i gene/i corrispondenti in un ampio
spettro di organismi procarioti
3. Assenza di omologhi funzionali umani
4. Carattere innovativo del bersaglio e/o del meccanismo
dell’azione antibatterica
5. Bassa frequenza di resistenza