Chimica Organica
Prof.ssa Alessandra Napolitano
[email protected]
• CHIMICA ORGANICA
• CHIMICA ORGANICA DEI SISTEMI BIOLOGICI
5 crediti
2 crediti
• LABORATORIO DI CHIMICA ORGANICA
1 credito
•Le esercitazioni di laboratorio e le lezioni in aula di spiegazione delle
esercitazioni sono obbligatorie e saranno tenute durante il corso. E’
necessario iscriversi al laboratorio.
Sito web www.docenti.unina.it
1
Libri di testo consigliati:
•W. Brown T. Poon
INTRODUZIONE ALLA CHIMICA ORGANICA
Edises
•T.W.G. Solomons
FONDAMENTI DI CHIMICA ORGANICA
Zanichelli
•P.Y. Bruice
CHIMICA ORGANICA
Edises
2
PERCHE' il CARBONIO ?
Il carbonio forma solo legami covalenti
Chimica organica
chimica del legame covalente del carbonio
il carbonio è l'unico elemento capace di dare strutture pluriatomiche stabili
nell'atmosfera terrestre
C C C C
C
C C C C
C C C C
C
C
C
C
C
C C C
C C C
C
C C
C C C C C C
anche il silicio sarebbe capace di dare strutture pluriatomiche ma nell'atmosfera
terrestre il legame Si-Si si ossida per dare i silicati caratterizzati dai legami
O
O
O
Si
Si
Si
O
O
O
Il legame covalente caratterizza le molecole ed essendo direzionale impone
determinate geometrie molecolari che comportano definite forme tridimensionali.
Il legame covalente, la formazione di macrostrutture e la forma spaziale
delle molecole sono essenziali per la vita
3
LE DATE DELLA CHIMICA ORGANICA
1769: Isolamento dei primi prodotti organici da fonti naturali (Scheele)
1784: Analisi elementare (Lavoisier) : tutti i materiali organici contenevano carbonio in
combinazione con altri elementi
1807: Definizione di sostanze organiche (Berzelius)
1828: Sintesi dell'urea dal cianato di ammonio (Wölher): cade la teoria della vis vitalis.
Data di inizio della Chimica Organica
O
NH4+CNOH2N
NH2
O
1847: Sintesi dell’Acido Acetico da materiali inorganici (Kolbe)
HO
1895: Sintesi dell’Aspirina (Acido Acetilsalicilico)
H3C
OH
O
CH3
O
O
1923: H2O, CO2, N2, CH4, NH3 (A.J. Oparin, L'Origine della Vita sulla Terra) : un
"brodo primordiale" di molecole organiche si sarebbe creato in un'atmosfera
povera di ossigeno per azione della luce solare.
1953: scariche elettriche ad un cocktail di acqua, metano, idrogeno ed ammoniaca
4
producono un miscuglio di amminoacidi (Stanley L. Miller) ,
ATOMI e MOLECOLE
a) modello atomico di Rutherford
b) gli orbitali atomici
c) descrizione della configurazione elettronica degli atomi
d) perchè gli atomi reagiscono?
e) in quale modo reagiscono gli atomi?
f) valenza
g) strutture di Lewis
h) risonanza
h) orbitali molecolari
i) ibridazione
5
Modelli atomici:
Thomson: l'atomo è costituito da una sfera omogenea
carica di elettricitá positiva in cui gli elettroni sono
distribuiti in maniera uniforme e senza una disposizione
spaziale particolare.
Rutherford: la massa e la carica positiva sono
concentrate in una parte molto piccola dell'atomo
chiamata nucleo, e gli elettroni si trovano nella zona
periferica, a grande distanza dal nucleo.
Bohr: Nell'atomo gli elettroni ruotano intorno al
nucleo su orbite circolari. Ognuna di queste orbite
ha un raggio ben determinato.
Il momento angolare degli elettroni é quantizzato.
Esso puó assumere soltanto certi valori (valori
permessi), ma non puó assumere i valori intermedi
fra quelli permessi.
Basati sulla teoria di Planck della quantizzazione
dell’energia
6
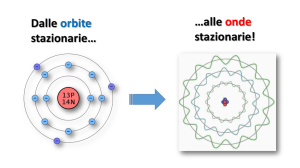
Teoria atomica moderna
Principio di indeterminazione di Heisenberg
« non è possibile conoscere simultaneamente posizione e quantità di moto di un dato
oggetto con precisione arbitraria »
Non è possibile considerare l’elettrone solo come una particella classica, dal
momento che esso si comporta anche come un’onda. Pertanto il moto degli
elettroni può essere rappresentato con delle funzioni d’onda.
Orbitali: le funzioni che si ottengono come soluzione dell'equazione d’onda di
Schroedinger; sono visualizzabili come regioni dello spazio intorno al nucleo,
nelle quali é possibile trovare l'elettrone.
7
Orbitali atomici
Una regione di spazio attorno ad un nucleo atomico in cui la
probabilità di trovare un elettrone è massima (di solito superiore
ad un limite convenzionalmente fissato nel 90%) è usata per
rappresentare graficamente un orbitale atomico di quell‘elettrone.
Gli orbitali atomici sono descritti dai numeri quantici
Numeri quantici
Il numero quantico principale
n, che può assumere valori
interi non inferiori a 1,
definisce il livello dell'energia,
l'estensione dell'orbitale ed il
numero totale di nodi.
I livelli principali di energia
sono detti GUSCI.
simbolo
nome
n
numero quantico principale (quanto principale) o di Bohr
l
numero quantico azimutale (quanto azimutale)
ml
numero quantico magnetico (quanto magnetico)
ms
numero quantico di spin (quanto di spin)
Il numero quantico azimutale (o numero quantico angolare) l, che può assumere valori interi
positivi compresi tra 0 ed n-1, a cui è legato il numero di nodi non sferici e, indirettamente, la
simmetria dell'orbitale;
Il numero quantico magnetico ml, che può assumere valori interi compresi tra +l e -l, a cui
sono legati il tipo di nodo - planare o conico - la sua orientazione nello spazio e la molteplicità
degli orbitali. Numero quantico di spin ms relativo al senso di rotazione (spin) dell’elettrone ed
all’orientazione del campo magnetico generato.
valori
8
Tutti gli orbitali di tipo s
hanno simmetria sferica e
la loro funzione d'onda è
sempre positiva; per
ottenere la forma
tridimensionale dell'orbitale
basta pensare ad una
rotazione di 180° attorno ad
un asse qualsiasi.
Le dimensioni aumentano
all'aumentare del numero
quantico n.
Orbitali di tipo p: la simmetria è
assiale; un orbitale p ha un piano
nodale perpendicolare al suo asse.
L'orbitale tridimensionale si può
generare per rotazione attorno al suo
asse di simmetria.
Anche nel caso degli orbitali p le
dimensioni aumentano all'aumentare
del numero quantico n
9
CONFIGURAZIONE ELETTRONICA DI UN ATOMO: descrizione degli orbitali
occupati dagli elettroni.
1) PRINCIPIO DELL’AUFBAU: l’ordine degli orbitali dipende dalla loro energia
2) PRINCIPIO DI ESCLUSIONE DI PAULI: max. 2 elettroni per orbitale con spin
opposti (si indicano con frecce con orientazione opposta)
3) REGOLA DI HUND (o di massima molteplicità): se sono disponibili orbitali
equivalenti, un solo elettrone viene aggiunto a ciascuno di tali orbitali, prima di
aggiungere un secondo elettrone ad uno qualsiasi di essi.
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 4f
energia
Ogni guscio può contenere fino a 2n2 elettroni dove n è
il numero del guscio
10
11
Gruppi
Periodi
12
IN QUALE MODO REAGISCONO GLI ATOMI?
LEGAME IONICO= cessione di elettroni dall'atomo con basso P.I a quello con alta A.E. con
conseguente formazione di ioni, rispettivamente positivo e negativo, e quindi attrazione.
+
Il legame ionico non è
Na
+
Cl
direzionale e non dà
origine a molecole,
ma a solidi ionici
+
Na
Cl
-
+
= ClNe
= Na+
Ar
13
IN QUALE MODO REAGISCONO GLI ATOMI?
LEGAME COVALENTE = Messa in compartecipazione di un elettrone da parte
di ciascuno atomo impegnato nel legame. Gli elettroni devono avere spin opposti
in modo da formare un doppietto elettronico di legame
Cl
+ Cl
Cl Cl
Il legame covalente, a differenza di quello ionico, è direzionale induce quindi una
certa geometria molecolare e caratterizza le molecole.
14
Elettronegatività e classificazione dei legami chimici
15