01/10/2015
ATOMI E PARTICELLE
SUBATOMICHE
ELETTRICITÀ DELL’ATOMO
ESISTONO
DUE
TIPI
DI
CARICHE
ELETTRICHE,
DENOMINATE
CONVENZIONALMENTE
NEGATIVA
E
POSITIVA
CARICHE DI SEGNO UGUALE SI RESPINGONO, MENTRE
CARICHE DI SEGNO OPPOSTO SI ATTRAGGONO
LE CARICHE ELETTRICHE POSSONO PASSARE DA UN
CORPO AD UN ALTRO
UN CORPO È ELETTRICAMENTE NEUTRO QUANDO
POSSIEDE UGUAL NUMERO DI CARICHE POSITIVE E
NEGATIVE
L’ELETTRONE
W. CROOKES (1832-1919)
CATODO
ANODO
-
+
MASSA = 9,1110-31kg
CARICA = -1,60 10-19C
1
01/10/2015
IL PROTONE
GOLDSTEIN VERIFICA L’ESISTENZA DELLE CARICHE
POSITIVE
CATODO
RILEVATORE
ANODO
-
+
MASSA PROTONE 1,6726 • 10-27kg
MASSA PROTONE = 1836 MASSA ELETTRONE!
CARICA PROTONE = 1,60 10-19C
IL NEUTRONE
VALORE DELLA MASSA DI UN ATOMO ESPRESSO È
MAGGIORE DELLA SOMMA DELLE MASSE DEI PROTONI
E DELL’ELETTRONE
ATOMO DI OSSIGENO HA MASSA 16, 17, 18 uma
J. CHADWICK (1932) SCOPRE IL NEUTRONE:
PARTICELLA PRIVA DI CARICA E MASSA PARI AD
1,6710-27kg (1 uma)
NUMERO ATOMICO
NUMERO DI MASSA
ATOMI DELLO STESSO ELEMENTO, IN CONDIZIONI NORMALI,
POSSIEDONO LO STESSO NUMERO DI PROTONI E DI
ELETTRONI
NUMERO ATOMICO (Z)=NUMERO DI PROTONI PRESENTI NEL
NUCLEO DI UN ATOMO
NUMERO DI MASSA (A)=NUMERO DI PROTONI+NUMERO DI
NEUTRONI
A
Z
X
2
01/10/2015
GLI ISOTOPI
ISOTOPI=ATOMI DEL MEDESIMO ELEMENTO CHE
POSSIEDONO STESSO NUMERO DI ELETTRONI E
PROTONI, MA DIFFERENTE NUMERO DI NEUTRONI
UNITÀ DI MASSA ATOMICA
(uma)
1uma
1
M 12C
12
MASSA PROTONE = 1 uma
MASSA ELETTRONE = 1/1836 uma
MASSA NEUTRONE = 1 uma
MODELLI FINO A RUTHERFORD-BOHR
3
01/10/2015
RADIAZIONI ELETTROMAGNETICHE
RADIAZIONI ELETTROMAGNETICHE
SPETTRO ELETTROMAGNETICO
4
01/10/2015
RADIAZIONI ELETTROMAGNETICHE
ENERGIA DI UNA ONDA LUMINOSA
QUANTIZZAZIONE ENERGIA
5
01/10/2015
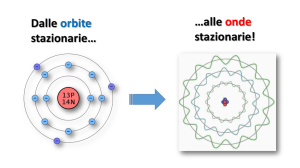
ONDA-PARTICELLA
L. DE BROGLIE (1924)
hν E
ν
c
λ
h
λ
mv
h
mv
λ
MOMENTO DI UN FOTONE
MOMENTO DI UNA PARTICELLA
PRINCIPIO DI INDETERMINAZIONE
Principio di indeterminazione di Heisenberg
• Si consideri una vettura (1000 kg) che si muove a 30 m/s
(circa 110 km/h) e assumendo un errore sulle misure di
1/106:
• p = m x v = 1000 x 3.10-5 ms-1 = 3.10-2 ms• da cui x = 1.76 10-33 m!!
6
01/10/2015
Principio di indeterminazione di Heisenberg
• Si consideri un elettrone (10-31 kg) che si muova anch’esso
a 30 m/s (circa 110 km/h) e assumendo un errore sulle
misure di 1/106:
• p = m x v = 10-31 x 3.10-5 ms-1 = 3.10-36 ms-1
• da cui x = 1.76 101 m !!
Accertata l’impossibilità di determinare
sperimentalmente le proprietà dell’elettrone, si è
deciso di determinare la
• PROBABILITA’
di trovare un elettrone in una area definita intorno al
nucleo.
L’elettrone viene trattato come un’onda di materia
EQUAZIONE DI SCHROEDINGER
Ad ogni elettrone corrisponde una funzione d’onda che
dipende dal suo livello energetico.
(2X ,Y , Z ) dv
Probabilità di trovare l’elettrone nel volume dv
NUMERI QUANTICI
Il numero quantico principale
n
(enne)
riguarda
la
quantizzazione
della
energia
totale Etot (corrisponde cioè ai
livelli di energia indicati nello
schema energetico del modello) e
può assumere i valori n=0,1,2,...
Il numero quantico secondario
o azimutale l (elle) è relativo al
momento
angolare
e può
assumere valori condizionati dal
valore di n: l=0,1,2,...,(n-1)
7
01/10/2015
NUMERO QUANTICO MAGNETICO
Il numero quantico magnetico m (emme) è
relativo alla quantizzazione "spaziale" del
momento angolare, che può assumere, cioè, solo
certe orientazioni rispetto ad una definita
direzione; la direzione viene definita solo in
presenza di un campo elettrico o magnetico che
orienti il vettore.
Il campo può essere esterno, imposto da noi,
oppure dovuto alla vicinanza di altri atomi o
molecole.
m= -l, -l+1, ...-1, 0, 1, ...l-1, l
Orbitali Atomici
per l = 0
s
per l = 1
p
per l = 2
d
per l = 3
f
Potremo avere perciò, per esempio, gli orbitali
2p (con n=2 e l=1)
3s (con n=3 e l=0)
5f (con n=5 e l=3)
n
1
2
2
2
2
3
3
3
3
3
3
3
3
3
4
4
4
4
l
0
0
1
1
1
0
1
1
1
2
2
2
2
2
0
1
1
1
m
0
0
0
1
-1
0
0
1
-1
0
1
-1
2
-2
0
0
1
-1
simbolo: s
1s
2s
simbolo: p
simbolo: d
2pz
2px
2py
3s
3pz
3px
3py
3dz2
3dxz
3dyz
3dxy
3dx2-y2
4s
4pz
4px
4py
8
01/10/2015
ORBITALE s
ORBITALE s
ORBITALI px, py pz
9
01/10/2015
ORBITALI d
dz2
dx2-y2
dxz
dyz
dxy
NUMERO QUANTICO DI SPIN ms
ms= ± 1/2
La tendenza generale delle particelle è di
associarsi fra loro con spin antiparalleli:
AUFBAU E PERIODICITÀ
Principio di minima energia: ogni elettrone occupa
l'orbitale disponibile a energia più bassa.
Principio di Pauli: in un atomo non possono esistere 2
elettroni con i 4 numeri quantici eguali; perciò, nello
stesso orbitale, possono esserci 2 soli elettroni purché
con ms, momento di spin, diverso; gli spin dei due
elettroni devono essere perciò antiparalleli, dato che,
essendo nello stesso orbitale, gli elettroni hanno gli
altri 3 numeri quantici n, l, m, eguali.
Regola di Hund o della massima molteplicità: se due o
più elettroni occupano orbitali degeneri (cioè a eguale
energia), gli elettroni occupano il maggior numero
possibile di questi orbitali, e a spin paralleli .
10
01/10/2015
ENERGIA DEGLI ORBITALI
11
01/10/2015
Blocco
s
Blocco p
s
Blocco d
Blocco f
RAPPRESENTAZIONI
CROMO E RAME
SI DOVREBBE OTTENERE:
Cr
Cu
[Ar]3d44s2
[Ar]3d94s2
INVECE LE CONFIGURAZIONI REALI SONO:
Cr
Cu
[Ar]3d54s1
[Ar]3d104s1
12
01/10/2015
ENERGIA DI IONIZZAZIONE
AFFINITÀ ELETTRONICA
RAGGIO ATOMICO
ENERGIA DI IONIZZAZIONE, AFFINITÀ
ELETTRONICA
RAGGIO ATOMICO
ENERGIA DI IONIZZAZIONE, AFFINITÀ
ELETTRONICA
F = -328 kJ/mol; Be = 0; i non metalli formano anioni
molto più stabili dei metalli!
13
01/10/2015
FINE
RAGGIO ATOMICO
NATURA ELETTRICA DELLA MATERIA
A. VOLTA (1745-1827)
DIMOSTRA CHE DA REAZIONI CHIMICHE SI
OTTIENE CORRENTE ELETTRICA
W. NICHOLSON (1753-1815) A. CARLISLE (1768-1840)
DIMOSTRARONO CHE SI PUÒ PROVOCARE UNA
REAZIONE CHIMICA ATTRAVERSO IL PASSAGGIO
DI CORRENTE ELETTRICA
14
01/10/2015
CARATTERISTICHE DELL’ELETTRONE
•
L’EMISSIONE DI RAGGI CATODICI È UNA PROPRIETÀ DELLA MATERIA.
È INDIPENDENTE DAL MATERIALE CON CUI È COSTITUITO IL CATODO
E IL GAS CONTENUTO NEL TUBO
•
I RAGGI CATODICI HANNO NATURA CORPUSCOLARE
•
I RAGGI CATODICI HANNO UNA TRAIETTORIA LINEARE
•
LA TRAIETTORIA PUÒ ESSERE DEVIATA DALL’AZIONE DI UN CAMPO
ELETTRICO E/O MAGNETICO
MASSA = 9,1110-31kg
CARICA = -1,60 10-19C
CARATTERISTICHE DEL PROTONE
PARTICELLE CON CARICA POSITIVA
LA MASSA DIPENDE DAL GAS CONTENUTO NEL TUBO, SE IL
GAS È L’IDROGENO, LA MASSA ASSUME IL VALORE PIÙ
PICCOLO
MASSA = 1,6710-27kg
CARICA = +1,60 10-19C
RADIOATTIVITÀ NATURALE
H. BECQUEREL (1852-1909)
SCOPRE CHE L’ URANIO EMETTE SPONTANEAMENTE
RADIAZIONI
15
01/10/2015
TIPI DI RADIAZIONI
RAGGI a: HANNO UNA CARICA POSITIVA
DOPPIA RISPETTO A QUELLA DEL PROTONE,
E UNA MASSA DI CIRCA 7000 VOLTE
MAGGIORE DI QUELLA DELL’ELETTRONE
RAGGI b: SONO COSTITUITI DA ELETTRONI
RAGGI g: SONO RADIAZIONI
ELETTROMAGNETICHE, PRIVE DI CARICA
SPETTRI DI EMISSIONE
SPETTRO CONTINUO vs. SPETTRO IDROGENO
16
01/10/2015
ORBITALI dx2-y2 E dxy
17