Teoria Atomica Moderna
Chimica generale ed Inorganica: Chimica Generale
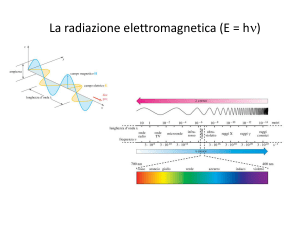
E mc 2
E h
mc 2 h
c
p
h
Essendo il momento p definito come
P=mc
Relazione di De Broglie
– Dualismo onda-particella
Teoria Atomica Moderna
Chimica generale ed Inorganica: Chimica Generale
Meccanica Ondulatoria – Equazione Schrödinger
H E
H
indica l’operatore Hamiltoniano, ossia un’insieme di operazioni matematiche che
rappresentano l’energia di un elettrone all’interno dell’atomo.
E
è l’energia attuale dell’elettrone.
Ψ
è la funzione d’onda, una funzione matematica che descrive la natura ondulatoria
dell’elettrone.
Ψ2
rappresenta un orbitale, una mappa di distribuzione di probabilità della posizione
dell’elettrone
L’Orbitale è individuato da tre numeri quantici interrelati: il
numero quantico principale, n;
numero quantico del momento angolare, l
numero quantico magnetico, ml.
n (energia) è il numero quantico principale
n=1, 2, 3, 4, …
L (forma) è il secondo numero quantico orbitale può assumere
valore 0 e ogni numero intero positivo non superiore a n
l= 0, 1, 2, 3, n-1
Il terzo numero quantico magnetico ml (orientazione) che può
assumere ogni valore intero sia positivo che negativo, tra –l ed l
ml = -l, -l+1, -l+2, … 0, 1, 2,…l -1, l
Atomo di Idrogeno
All’aumentare di n le
differenze energetiche tra i
livelli si assottigliano
La forma degli orbitali atomici
l =0 orbitale s
Ψ2 densità di probabilità
l =1 orbitale p
ml=-1, 0, 1
l =2 orbitale d
ml=-2,-1, 0, 1,2
l =3 orbitale f
ml=-3,-2,-1, 0, 1,2,3
Perché l’atomo si rappresenta sferico
Come gli elettroni occupano gli orbitali
L’Idrogeno ha un solo elettrone che si posizionerà
sull’orbitale vuoto a più bassa energia 1s
Configurazione elettronica 1s1
Teoria Atomica Moderna
Chimica generale ed Inorganica: Chimica Generale
Il quarto numero quantico
FIGURA 9-29 Lo spin elettronico visualizzato
Numeri quantici
n, l, m
Regole Auf-Bau
Principio di eclusione Pauli
Regola di Hund
E
Elettroni di core
Elettroni di valenza