Le basi del calcolo statistico
equilibrio statistico di N particelle su k stati possibili:
• descrizione del sistema: individuare gli stati possibili (microstati),
mediante i relativi numeri quantici
• calcolare l’energia Ei dell’i-esimo stato
• calcolare la degenerazione gi dell’i-esimo stato
• calcolare la probabilità di una certa partizione, cioè in quanti modi
si possono disporre Ni particelle sui k stati conservando l’energia totale a
disposizione (probabilità di una certa partizione di stati)
• ipotesi: tutti i microstati accessibili sono egualmente probabili
stat-1
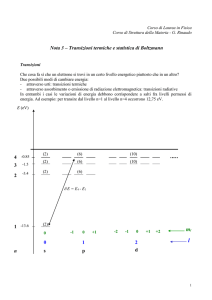
Microstati e macrostati
Esempio: microstati accessibili agli elettroni di atomi
di idrogeno per i primi 6 livelli energetici (macrostati)
pr2
L2
Ze 2
H (r , , )
(r , , ) E (r , , )
2m 2mr 2
r
(r , , ) R(r )Ylml ( , )
u (r ) ml
Yl ( , )
r
numeri quantici: ni, li, mi
E6=-0,38
E5=-0,54
E4=-0,85
6
5
4
N6 36
N5 25
N4 16
E3=-1,6
3
N3
9
E2=-3,4
2
N2
4
livello energetico: Ei
degenerazione : gi
numero di occupazione: Ni
E1=-13,6
eV
1
i
N1
4
4
4
4
4
4
4
4
4
4
4
4
4
4
4
4
3
3
3
3
3
3
3
2
2
2
2
2
1
1
1
0
+3
+2
+1
0
-1
-2
-3
+2
+1
0
-1
-2
+1
0
-1
0
3
3
3
3
3
3
3
3
3
2
2
2
2
2
1
1
1
0
+2
+1
0
-1
-2
+1
0
-1
0
2
2
2
2
1
1
1
0
+1
0
-1
0
1
1
0
0
gi
n
l
m
stat-2
Statistica di Boltzmann
Esempio:
probabilità della
Wi= numero di modi in cui si possono
partizione
disporre Ni particelle sul livello i
N1=4
N2=3
N ( N 1)( N 2)( N 3)
N!
W1
N3=5
4!
N1! ( N N1 )!
N4=3
N5=4
( N N1 )!
N2
W2
g2
N6=2
N 2!( N N1 N 2 )!
N
gi i
W N! i
N i!
si cerca il massimo di lnW con i vincoli
sul numero totale N di particelle e
l’energia totale E (massimo vincolato):
ln W ln N !
i Ni N
i Ni Ei E
E6=-0,38
E5=-0,54
E4=-0,85
6
5
4
N6 36
N5 25
N4 16
E3=-1,6
3
N3
9
E2=-3,4
2
N2
4
i Ni ln gi i ln Ni!
E1=-13,6
stat-3
eV
1
i
N1
4
4
4
4
4
4
4
4
4
4
4
4
4
4
4
4
3
3
3
3
3
3
3
2
2
2
2
2
1
1
1
0
+3
+2
+1
0
-1
-2
-3
+2
+1
0
-1
-2
+1
0
-1
0
3
3
3
3
3
3
3
3
3
2
2
2
2
2
1
1
1
0
+2
+1
0
-1
-2
+1
0
-1
0
2
2
2
2
1
1
1
0
+1
0
-1
0
1
1
0
0
gi
n
l
m
Statistica di Boltzmann
metodo dei “moltiplicatori di Lagrange”
d ln Wi
dN
dNi Ei
dNi 0
i
dNi
dNi
dNi
si richiede che sia nullo ogni termine
della sommatoria
i
d ln Wi
1
ln g i (ln N i N i
1)
dN i
Ni
ln g i ln N i Ei 0 ; ln
N i Cgi e
gi
fattore di
“spazio delle fasi”
Ei
formula di Stirling:
lnx! = x lnx - x
Ni
E i
gi
ha le dimensioni dell’inverso
di una energia =1/ kBT
kB=costante di Boltzmann,
T=temperatura assoluta
fBol (E,T) = e-E/kT
funzione di distribuzione
di Boltzmann
Ni Cgi f Bz ( E i , T )
stat-4
Esempio: distribuzione sui livelli energetici
di atomi di idrogeno a T=50000K
(temperatura di una stella?)
La distribuzione in energia di
elettroni di atomi di idrogeno
kBT = 8,6 10-5 eV K-1 5 104 K = 4,3 eV
i
gi
Ei
(eV)
fBlz(Ei,T)
(e-E/kT )
gi fBlz
g fBlz
45
40
1
1
-13,6
24
24
2
4
-3,4
2,2
9
fBz
35
5 104 K
30
25
3
9
-1,6
1,5
13
4
16
-0,85
1,2
19
20
15
10
5
25
-0,54
1,14
28
6
36
-0,38
1,09
39
5
0
-16
-12
-8
-4
0
E (eV)
Per avere la probabilità di occupazione dello stato occorre
dividere per la funzione di partizione Z (“Zustand Summe”):
g f (E ,T )
Pi i Bz i
Z
stat-5
La distribuzione in energia
di elettroni di atomi di idrogeno
a diverse temperature
25,00
ln(g fBlz)
6,5 103 K
20,00
15,00
T (K)
6500
10000
50000
kBT (eV)
fBz
10,00
0,55
0,85
4,25
5,00
scala logaritmica
0,00
-14
-10
-6
-2
E (eV)
25,00
25,00
ln(g fBlz)
ln(g fBlz)
5 104 K
20,00
15,00
15,00
10,00
10,00
fBz
fBz
5,00
5,00
0,00
0,00
-14
stat-6
104 K
20,00
-10
-6
E (eV)
-2
-14
-10
-6
E (eV)
-2