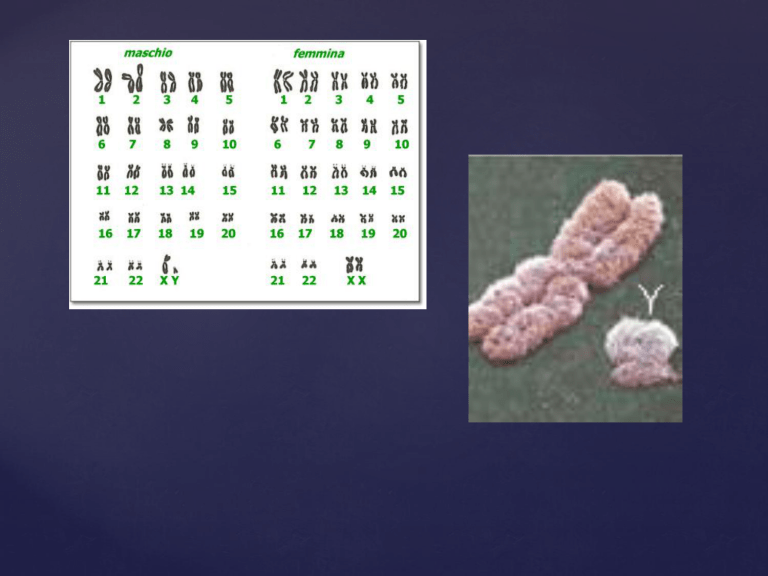
Esistono due zone di omologia X-Y poste alle due estremità dei cromosomi
vengono indicate con la sigla PAR (Pseudo Autosomal Region)
PAR1 (o primaria) estremità del braccio corto, è grande ca. 2.6 Mb
PAR2 (o secondaria) estremità del braccio lungo, è grande ca. 320 Kb
Queste due regioni, durante la meiosi maschile, si appaiano e vanno incontro
a ricombinazione
PAR1
PAR2
Perché si è ipotizzato l’esistenza
di un meccanismo di
compensazione del dosaggio
genico (o più precisamente
della differenza di dosaggio
genico)?
1) Per quale motivo le aneuploidie dei
cromosomi sessuali, a differenza di quelle
che coinvolgono gli autosomi, sono
compatibili con la vita, e, in alcuni casi, non
comportano fenotipi anormali?
47, XXX femmine normali, talvolta sterili
47, XXY (sindrome di Klinefelter) maschi sterili, talvolta con
lieve ritardo mentale
45, X0 (sindrome di Turner), statura inferiore alla media,
sterilità, altre anomalie di sviluppo generalmente non
gravi
48, XXXX o XXXY sintomatologia più grave delle precedenti, ma
comunque condizione compatibile con la vita
2) La quantità di prodotto genico di geni del
cromosoma X è uguale in maschi e femmine,
nonostante il fatto che i maschi abbiamo una
sola copia del gene e le femmine due
Esempio attività enzimatica della G6PD (Glucosio-6-Fosfato
Deidrogenasi)
Queste due osservazioni trova una spiegazione immediata
se ipotizziamo che nelle cellule somatiche venga
mantenuto attivo un solo cromosoma X a prescindere da
quanti siano i cromosomi X presenti
Nei mammiferi, a differenza che in altri organismi (es.
Drosophila), la compensazione del dosaggio genico è
raggiunta attraverso l’inattivazione di un cromosoma X
nelle cellule somatiche che ne contengono due (o più)
Tutte le cellule somatiche mantengono attivo un solo
cromosoma X, questo spiega come mai l’auneuploidia
(cromosomi in eccesso o in difetto) per il cromosoma X
sia compatibile con la vita (e talvolta comporti un
fenotipo pressoché normale)
Agli inizi degli anni ’60 Mary Lyon ed Ernest
Beutler sono arrivati in modo indipendente a
dimostrare l’esistenza dell’inattivazione del
cromosoma X
Beutler
studio del gene Gd nella specie
umana
Lyon
studio di un gene che controlla il
colore del pelo nel topo
L’inattivazione è:
casuale (in media il 50% delle cellule inattiva l’X
ereditato dal padre e il 50% quello ereditato dalla
madre)
mantenuta clonalmente (le cellule figlie
mantengono lo stesso pattern di inattivazione della
cellula madre)
avviene in una fase precoce dello sviluppo
embrionale
Caratteristiche del cromosoma X
trascrizionalmente inattivo:
mantiene attive alcune regioni (le due PAR ed
altri geni interspersi in regioni inattive)
assume un aspetto eterocromatico in interfase
(corpo di Barr)
acquista le caratteristiche del DNA inattivo
(metilazione dei residui di Citosina,
ipoacetilazione degli istoni, replicazione del
DNA nella tarda fase S)
Nelle cellule somatiche di mammifero, sono visibili , in
interfase 0, 1, 2 o 3 corpi di Barr, il loro numero è
correlato al numero di cromosomi X presenti nella
cellula
Corpo di Barr struttura
eterocromatica visibile in
interfase addossato alla
parete interna della
membrana nucleare
Il corpo di Barr scoperto
alla fine degli anni ’40
quando è stata scoperta
l’inattivazione del cromosoma
X, si è ipotizzato che potesse
essere l’espressione
morfologica dell’X inattivo
Nucleo di una
cellula in interfase
con 1 corpo di
Barr
Nucleo di una
cellula in interfase
con 3 corpi di Barr
Come avviene l’inattivazione?
Processo multi-step:
1) ‘conteggio’ dei cromosomi X presenti nella cellula (anche
rispetto agli autosomi);
2) ‘scelta’ del(dei) cromosoma(i) X da inattivare, uno per ogni
assetto diploide;
3) inizio dell’inattivazione;
4) sua diffusione alla quasi totalità del cromosoma;
5) mantenimento dello stato inattivo
Tutte queste funzioni sono mediate da sequenze di DNA
che si trovano nella regione Xq13 e da loci autosomici
l’inattivazione non è sequenza-specifica (sequenze autosomiche
traslocate sull’X vengono inattivate)
La regione Xq13 contiene quindi l’X-Inactivation
Center (XIC), è possibile suddividerla in
sottoregioni ciascuna delle quali coinvolta in un
singolo step del processo
inizio anni ’90 identificazione del primo gene
coinvolto nell’inattivazione
XIST X Inactive Specific Transcript
è l’unico gene espresso solo dal cromosoma X
inattivo
codifica un RNA senza ORF di ca. 17 Kb che
sembra rivestire il cromosoma X inattivo
Attualmente sono stati identificati diversi
altri geni necessari per l’inattivazione del
cromosoma X, ma le basi molecolari di
questo meccanismo non sono ancora
completamente note
L’inattivazione è sempre casuale?
NO si osserva deviazione dalla casualità quando uno
dei cromosomi X della cellula porta una copia del
gene XIST (necessario per dare inizio
all’inattivazione) non funzionante
o quando si ha una traslocazione bilanciata Xautosoma. In questo caso l’inattivazione è in
origine casuale, ma le cellule che inattivano l’X
coinvolto nella traslocazione inattiveranno anche
geni autosomali e questo le renderà selettivamente
svantaggiate rispetto alle altre cellule
Pattern di inattivazione nelle cellule della linea germinale:
entrambi i cromosomi X degli oogoni sono attivi, l’unico
cromosoma X degli spermatogoni è inattivo
L’inattivazione del cromosoma X è
responsabile della grande variabilità
clinica delle malattie dovute a geni che
mappano su questo cromosoma la
gravità del fenotipo clinico dipenderà
dalla proporzione di cellule che hanno
mantenuto attivo il cromosoma X con
l’allele mutante
Imprinting genetico
Espressione differenziale di materiale
genetico a seconda che esso sia stato
trasmesso dal padre o dalla madre. I geni
soggetti a imprinting sono presenti in
duplice copia, ma di essi viene espressa una
sola copia
Espressione monoallelica di geni
biallelici
Concetto contrario alle leggi di Mendel
secondo le quali l’origine materna o
paterna di un’informazione non ne influenza
l’espressione (equivalenza degli incroci
reciproci)
Geni ‘imprintati’ nel padre sono silenziati
durante la spermatogenesi la copia
fornita dal padre non viene espressa,
rimane attiva solo quella fornita dalla
madre
Geni ‘imprintati’ nella madre sono silenziati
durante la oogenesi la copia fornita dalla
madre non viene espressa, rimane attiva solo
quella fornita dal padre
pedigree di una malattia dovuta ad un gene soggetto a
imprinting silenziato durante la oogenesi (è attiva solo la
copia fornita dal padre)
il rapporto maschi : femmine tra gli affetti è 1:1, una
femmina malata non trasmette MAI la malattia, che può
ricomparire però nei suoi nipoti (figli dei suoi figli maschi)
PROVE DELL’ESISTENZA DELL’IMPRINTING
esperimenti di trapianti di pronuclei nel topo: creazione di
zigoti androgenetici e ginogenetici
zigoti ginogenetici
2n cromosomi TUTTI di
derivazione femminile
embrioni abortivi – strutture
extraembrionarie pressoché assenti,
embrione quasi normale
zigoti androgenetici
2n cromosomi TUTTI di
derivazione maschile
CONTROLLI
zigoti normali ottenuti
con trasferimento di
pronuclei
2n cromosomi, n forniti da
un maschio e n da una
femmina
embrioni abortivi – iperplasia del
trofoblasto, embrione pressoché assente
embrioni normali – la manipolazione di per
sé non impedisce il normale sviluppo
PROVE DELL’ESISTENZA DELL’IMPRINTING
NELL’UOMO
Esistono due patologie umane paragonabili agli zigoti
ginogenetici e androgenetici:
teratomi, 2n cromosomi forniti SOLO dalla madre
mole idatiforme, 2n cromosomi forniti SOLO dal padre
I triploidi (3n cromosomi = 69) sono tutti abortivi, ma il
fenotipo dei 2nP1nM è diverso da quello dei 2nM1nP, nei
primi si osserva un’iperplasia delle strutture
extraembrionarie e assenza dell’embrione vero e proprio,
viceversa, nei secondi si hanno strutture extraembrionarie
quasi assenti e embrione pressoché normale
Alcune disomie cromosomiche uniparentali (UPD)
(entrambi i cromosomi di una coppia forniti dallo stesso
genitore) hanno effetti fenotipici diversi dettati dal sesso
del genitore che ha fornito la coppia di cromosomi
Si stima che nell’uomo i geni soggetti a
imprinting siano dell’ordine di 200, si trovano
sulle seguenti regioni cromosomiche:
6, 7q, 11p, 14q, 15q11-q13, 20
molto spesso i geni soggetti a imprinting
sono riuniti in cluster contenenti geni
‘imprintati’ nella madre e geni ‘imprintati’ nel
padre
i due cluster omologhi mostrano
metilazione differenziale (ma non sempre la
metilazione è a carico dell’allele non espresso)
nei cluster sono in genere presenti sia geni
strutturali (il loro prodotto finale è una
catena polipeptidica) sia geni che producono
RNA non codificanti
L’imprinting deve essere risettato ad ogni generazione
Sindrome di Beckwith-Wiedemann (BWS) (1)
Malattia dovuta a un gene soggetto a imprinting nella
madre (è attiva solo la copia fornita dal padre) causata da
acquisizione di funzione. Il gene mappa in 11p15
P
M
P
M
P
M
Nei soggetti normali è espressa solo la
copia paterna
La duplicazione sul
cromosoma paterno ha
come conseguenza un
raddoppiamento del
prodotto genico ed
insorgenza della malattia
La duplicazione sul
cromosoma materno è
senza conseguenze perché
la copia sovrannumeraria
non viene espressa
Sindrome di Beckwith-Wiedemann (BWS) (2)
Una mutazione nel centro di imprinting
impedisce il silenziamento del gene in cis
P
M
P
M
La mutazione è sul cromosoma
paterno non si hanno conseguenze
fenotipiche perché la copia che non
può essere spenta è comunque
destinata ad essere espressa
La mutazione è sul cromosoma
materno l’individuo è malato
perché ha due copie attive del gene
Sindrome di Prader-Willi (PWS) - malattia dovuta ad
assenza della funzione del ‘gene’ PWS (si tratta di vari
geni che per semplicità vengono qui considerati come un
unico gene), ‘gene’ soggetto ad imprinting nella madre
(è espressa solo la copia fornita dal padre) che
mappa in 15q11-13
Sindrome di Angelman (AS) - malattia dovuta ad assenza
della funzione del gene AS, gene soggetto ad
imprinting nel padre (è espressa solo la copia fornita
dalla madre) che mappa in 15q11-13, cioè nella
STESSA regione del ‘gene’ PWS
Entrambe le malattie possono essere dovute a:
1. delezione dell’intera regione cromosomica 15q11-13;
2. disomia uniparentale (UPD) (materna nella PWS,
paterna nella AS);
3. errore di imprinting;
4. solo per la sindrome di Angelman: mutazione nella
copia materna del gene AS
P
M
P
M
P
M
PWS
AS
Pattern di espressione nel
soggetto normale: sono
espressi il ‘gene’ PWS del
cromosoma paterno ed il
gene AS del cromosoma
materno
La delezione è sul
cromosoma Paterno
assenza della funzione del
‘gene’ PWS, si ha Sindrome di
Prader-Willi
La delezione è sul
cromosoma Materno
assenza della funzione del
gene AS, si ha Sindrome di
Angelman
P
PWS
AS
PWS
AS
P
M
M
P
PWS
AS
M
P
M
PWS
AS
Disomia Uniparentale (UPD)
Paterna assenza
funzionale del gene AS
Sindrome di Angelman
UPD Materna assenza
funzionale del ‘gene’ PWS
Sindrome di Prader-Willi
mutazione nel centro di imprinting
sul cromosoma P che non può
essere risettato e viene trasmesso
con un’impronta di tipo Materno
assenza funzionale del gene PWS
Sindrome di Prader-Willi
mutazione nel centro di imprinting
sul cromosoma M che non può
essere risettato e viene trasmesso
con un’impronta di tipo Paterno
assenza funzionale del gene AS
Sindrome di Angelman
UPD = UniParental Disomy = disomia
uniparentale entrambi gli omologhi di una
coppia vengono ereditati dallo stesso genitore
Non si ha un’alterazione quantitativa rispetto al
normale, ma per quel particolare cromosoma
l’informazione genetica proviene da un solo
genitore
Le UPD sono in genere dovute a recupero di una
trisomia (un embrione trisomico che in una fase
estremamente precoce dello sviluppo perde un
membro della tripletta di omologhi)