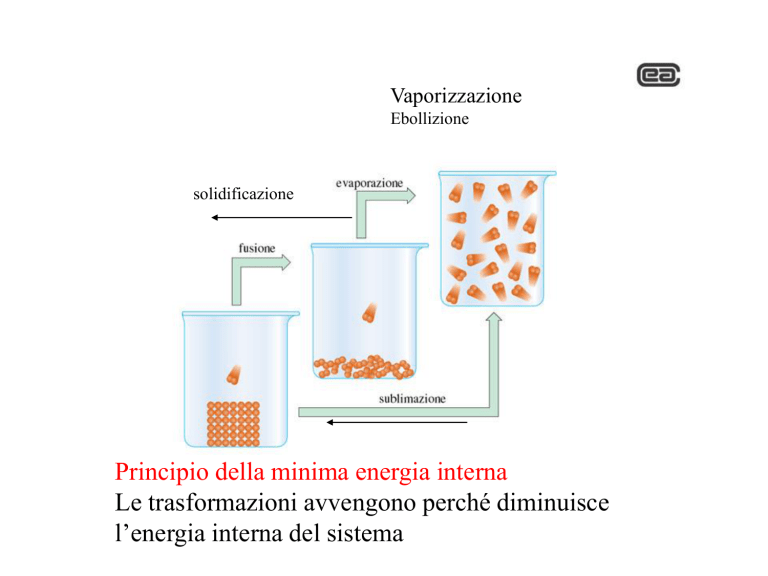
Vaporizzazione
Ebollizione
solidificazione
Principio della minima energia interna
Le trasformazioni avvengono perché diminuisce
l’energia interna del sistema
Se c’è variazione del prodotto PV si deve tener conto
anche di tale variazione
H = U + PV Entalpia
DH = DU + D(PV)
Le trasformazioni sono favorite da una
diminuzione dell’Entalpia del sistema
Commento sui passaggi di stato
S = k ln W
k: costante di Boltzmann
W: numero degli stati microscopici del sistema
L’entropia aumenta nell’ordine:
solido < liquido < gas
Solido perfetto
1 stato microscopico
Molto poco probabile
DEGRADAZIONE DELL’ENERGIA
conversione di energia da una forma ad un’altra
Fenomeni
ridistribuzione dell’energia
AB
Se avviene una trasformazione irreversibile l’energia subisce una
Degradazione
Pallina che scende su di un piano inclinato:
Il calore prodotto dagli attriti è una forma di energia degradata
rispetto all’energia potenziale e cinetica della sfera
Trasmissione di calore da un corpo caldo a un corpo freddo:
Il calore è una forma di energia tanto più degradata quanto più
bassa è la temperatura
Espansione gas ideale nel vuoto: L’energia si degrada
ENTROPIA (S)
Grandezza fisica legata al disordine
Nella trasformazione:
- energia cinetica calore
aumenta il disordine
- scambio di calore
aumenta il disordine
- espansione del gas
aumenta il disordine
aumento del disordine aumento di entropia
Tendenza dei sistemi a trasformarsi in stati di maggior disordine
Tendenza a passare dallo stato solido, al liquido, al gas
Questa tendenza si oppone a quella di raggiungere la minima entalpia
Si raggiunge, dopo un po’ di tempo,
G = H – TS
un equilibrio dinamico
Energia libera (di Gibbs)
P = (n/V) RT
DG = DH – TDS
tensione di vapore
All’equilibrio: DG = 0 DS = DH/T
(pressione del vapore saturo)
DG < 0 processo spontaneo
Termine entalpico DH Termine entropico TDS
DG = DH – TDS
All’equilibrio TDS= DH
All’aumentare di T deve aumentare DH
P = (n/V)RT
P
- Non dipende dallo spazio a disposizione del gas
- Non dipende dalla superficie
- Non dipende dalla quantità di liquido
H2O
CO2
-78.2 °C, 1 atm