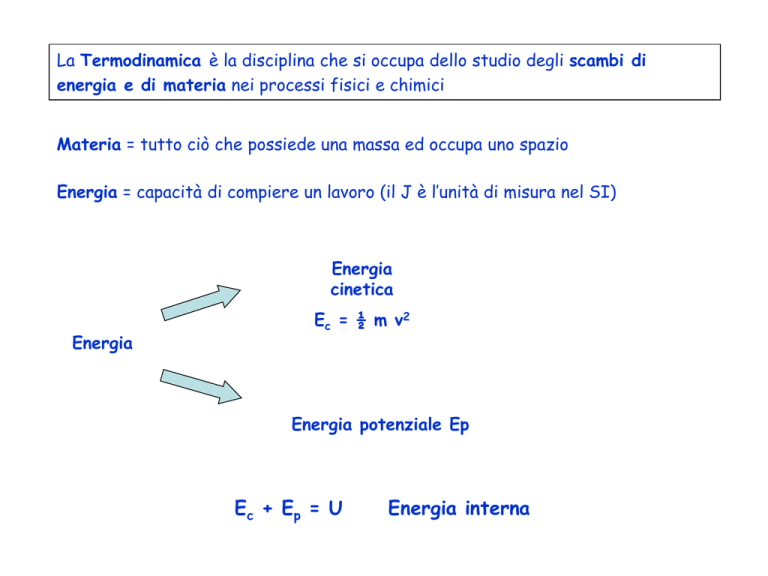
La Termodinamica è la disciplina che si occupa dello studio degli scambi di
energia e di materia nei processi fisici e chimici
Materia = tutto ciò che possiede una massa ed occupa uno spazio
Energia = capacità di compiere un lavoro (il J è l’unità di misura nel SI)
Energia
cinetica
Energia
Ec = ½ m v2
Energia potenziale Ep
Ec + E p = U
Energia interna
Legge di conservazione dell’energia
In una reazione chimica o in una trasformazione fisica l’energia non può essere
creata né distrutta
Legge di conservazione della materia
durante una reazione chimica o una trasformazione fisica non si osserva
variazione della quantità di materia
Legge di conservazione dell’energia e della materia
Nell’Universo la somma della quantità di energia e di materia è costante
E = m c2
Lavoro
w è un trasferimento di energ che può essere utilizzato, ad esempio,
per variare l’altezza di un peso (il J è l’unità di misura nel SI)
Calore
q è un trasferimento di energia che determina o utilizza un movimento
caotico di atomi o molecole
Primo Principio della Termodinamica
L’energia interna di un sistema isolato è costante
ΔU = q + w
Molte delle grandezze termodinamiche non hanno uno zero naturale e sono
arbitrarie, ma sono ugualmente utili perché ciò che interessa è solo la variazione
P, T e U sono funzioni di stato
q e w non sono funzioni di stato
V è funzione di P, T ed è quindi una funzione di stato V = nRT / P
P e T sono grandezze intensive, non dipendono dalla massa del sistema, V, U, q e
w sono grandezze estensive, dipendono dalla massa del sistema
La funzione di stato entalpia H è la quantità di calore scambiato da un sistema che
subisce una trasformazione chimica o fisica a pressione costante
•E’ una funzione di stato molto importante in chimica in quanto le reazioni sono
generalmente condotte a pressione costante (Pambiente)
•Non è possibile conoscere l’entalpia assoluta di un sistema, ma ciò che interessa sono
le variazioni
ΔH = Hf – Hi o
ΔH = ΣHprodotti – ΣHreagenti
•Dipende dalle interazioni interatomiche ed intermolecolari
•ΔH < 0 Hf < Hi
Prodotti più stabili dei reagenti, reazione esotermica
•ΔH >0 Hf > Hi
Prodotti meno stabili dei reagenti, reazione endotermica
•Il valore di H è legato al valore dell’energia interna
H = U+ PV
a P costante
Spesso i valori di ΔH sono riferiti allo stato standard
Stato standard, o condizioni standard, sono costituite
da sostanze pure, non mescolate, alla pressione di 1 bar.
La temperatura non entra nella definizione di stato standard
Generalmente si fa riferimento a T = 298 K (25 °C) (Temperatura convenzionale)
Se la Temperatura non è specificata si intende 298 K
L’entalpia standard di reazione, ΔH°, rappresenta il valore di ΔH quando i
reagenti, tutti nello stato standard, si trasformano completamente nei
prodotti, anch’essi tutti nello stato standard.
2H2(g) + O2(g)
2H2O(l)
L’entalpia standard di formazione
di un elemento nel suo stato di
riferimento è 0 per definizione
Stato di riferimento di alcuni elementi a
25°C
Idrogeno, azoto,
ossigeno, fluoro,
cloro
gas
Bromo, mercurio
liquidi
Tutti i metalli tranne
il mercurio
solidi
carbonio
grafite
ΔH°298 = -572 kJ
-572 kJ è la quantità di calore che si
sviluppa (segno meno) quando 2 moli di
idrogeno puro si combina con 1 mole di
ossigeno puro formando 2 moli di acqua
liquida. Come stato iniziale della reazione si
considera quando i reagenti non sono ancora
mescolati. I reagenti gassosi, all’inizio della
reazione, ed il prodotto liquido, al termine,
si trovano a T = 298 K e P = 1 bar
NH4NO3(s)
H2O
NH4+ + NO3-
ΔH > 0
La reazione è endotermica, quindi i prodotti sono meno stabili dei reagenti.
La reazione però avviene comunque: è una reazione spontanea in condizioni ambientali
•Una reazione è spontanea se è favorita verso i prodotti
•Una reazione è non spontanea se è favorita verso i reagenti
•In ciascuno di questi processi
aumenta il disordine del sistema.
L’aumento di disordine è la driving
force che li fa avvenire
• Il passaggio di un sistema da
uno stato di disordine minore ad
uno
di
disordine
maggiore
è
associato ad un aumento della
probabilità di accadimento dello
stato finale rispetto a quello di
partenza
Il disordine di un sistema viene misurato con la funzione entropia, S, e la variazione
di entropia di una trasformazione o di una reazione chimica è ΔS = Sf - Si
Secondo Principio della Termodinamica
•L’entropia di un sistema isolato aumenta in una trasformazione spontanea
•L’entropia dell’universo tende sempre ad aumentare
ΔSuniverso = ΔSambiente + ΔSsistema > 0
(in un processo spontaneo)
L’entropia, come l’entalpia, è una funzione di stato e, a differenza dell’entalpia
l’entropia, ha uno “zero naturale” e si può parlare di entropia assoluta, non
solo di variazioni
Cristallo perfetto
aT=0K
Un unico stato
possibile
Terzo Principio della Termodinamica
L’entropia di un cristallo perfetto è
zero a T = 0 K
•Entropia e temperatura sono collegate: un aumento della T determina una
aumento del disordine (aumenta l’Ec media), quindi determina un aumento
dell’entropia
•La scala termometrica assoluta (scala Kelvin) è collegata alla definizione di S
•Nella scala assoluta non esistono valori negativi
•Poiché S(0) = 0, S(T) di una sostanza è l’entropia assoluta di quella sostanza a
quella data temperatura (per un determinato valore di pressione)
•L’entropia molare standard, S°, di una sostanza è l’entropia di una mole di
quella sostanza alla pressione di 1 bar (generalmente data a T = 298 K)
Funzione Energia libera di Gibbs - G
E’ una funzione di stato termodinamica.
ΔG= ΔH - TΔS
La condizione per la
spontaneità di un
processo è ΔG < 0
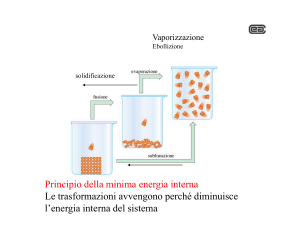
Principio di minima
energia libera
Il processo di evaporazione è legato ad un aumento
di entalpia (si devono rompere le interazioni tra
molecole in fase liquida) e un aumento di entropia
(aumento del disordine).
Il primo si oppone al passaggio liquido gas, il
secondo lo favorisce.
sistema all’equilibrio:
la pressione del gas
eguaglia la tensione di
vapor saturo
sistema fuori equilibrio:
la pressione parziale del gas
non raggiunge mai la tensione
di vapor saturo ed il liquido
evapora completamente
•All’inizio del processo (nessuna particella in fase gas) la variazione positiva di ΔS è
massima: TΔS > ΔH ovvero ΔG < 0
1) Le particelle in fase gas hanno moltissimo spazio a disposizione (molti possibili stati)
2) Presenza di due fasi maggiore disordine che per una singola fase
•Via via che il processo va avanti il guadagno in disordine si riduce: ad un certo punto di
avrà TΔS = ΔH
•TΔS = ΔH (ΔG = 0) è la condizione di equilibrio: il processo di evaporazione non è più
favorito di quanto non lo sia il processo di condensazione
•La situazione rimane macroscopicamente ferma fino a che non cambia la temperatura
del sistema
Transizione liquido-gas
•Le particelle sulla superficie del liquido con Ec > Einter
passano in fase gas
•Le particelle in fase gas con Ec < Einter ritornano in
fase liquida
Frazione di
particelle
che
condensano
•La temperatura determina la forma della curva di
distribuzione di Ec ed il valore di <Ec> determina il
numero di particelle che per unità di tempo possono
evaporare ed il numero di quelle che possono
condensare
•Il processo continua fino a che il numero di particelle
Frazione di
particelle
che
evaporano
che evaporano eguaglia il numero di particelle che
condensano: si è raggiunto l’equilibrio (equilibrio
dinamico)
•Le particelle in fase gas, in equilibrio con la fase
liquida, determinano una pressione che è detta
pressione del vapor saturo o tensione di vapore
•La posizione dell’equilibrio dipende dalla temperatura
Dipendenza della tensione di vapore di un liquido
Quando la tensione di vapore
raggiunge il valore della pressione
esterna lo sviluppo di gas si verifica
anche nella massa del liquido ed ha
luogo l’ebollizione. La T alla quale ha
luogo l’ebollizione di un liquido quando
la pressione esterna è 1 atm, è detta
Temperatura normale di ebollizione
Non dipende:
•dallo spazio a disposizione del gas
•dalla quantità di liquido, purché sufficiente
al raggiungimento dell’equilibrio,
•dalla superficie di separazione liquido-gas,
che influenza invece la velocità del processo
Dipende:
dalla T con andamento non lineare perché
nella funzione P = nRT/V aumentando T
aumenta anche n (maggiore <Ec> delle
particelle)
N.B. si può determinare l’ebollizione di un liquido a
T < Teb se lo si tiene in un recipiente chiuso in cui
venga fatto il vuoto
Transizione solido-gas
•Le considerazioni sono le stesse fatte per la transizione liquido-gas
•Il numero di particelle che sfuggono in fase gas è molto inferiore perché l’energia
di interazione nel solido è maggiore che nel liquido
•Si definisce una tensione di vapore del solido: pressione della fase gas di una
sostanza in equilibrio con la sua fase solida ad una certa temperatura
•Si definisce temperatura normale di sublimazione la temperatura alla quale la
tensione di vapore del solido raggiunge 1 atm.
Transizione solido-liquido
• E’ il fenomeno che normalmente si verifica scaldando un solido, perché la
tensione di vapore del solido non riesce a raggiungere la Pesterna
• Temperatura normale di fusione: è la temperatura alla quale, a Pamb = 1 atm, la
Pvap del solido = Pvap del liquido ed il solido passa alla sua fase liquida
Diagrammi di stato I diagrammi di stato di una sostanza rappresentano in un grafico
(T vs P): 1) le zone di esistenza delle varie fasi; 2) le curve di separazione delle varie fasi,
cioè il luogo dei punti (valori di T e P) per i quali si verifica coesistenza delle fasi – curve
di equilibrio; 3) i valori di T e P per i quali si verificano situazioni caratteristiche, come
ad es. il così detto punto triplo
Diagramma di stato dell’acqua
La curva
solido/liquido ha
pendenza
invertita rispetto
al normale
andamento
Punto triplo:
valori di T e P
per i quali le tre
fasi (solida,
liquida e gas)
coesistono
TNeb
TNfus
Al di sopra di
questi valori di
T e P il liquido
non è più
distinguibile dal
gas e si parla di
“fluido”
Curva della tensione di
vapore del liquido:
il gas è in equilibrio con il
suo liquido, e la P del gas è
la tensione di vapore
Diagramma di stato del diossido di carbonio
La curva solidoliquido ha pendenza
normale, cioè
positiva
Nel diagramma
della CO2 il punto
triplo è a pressioni
maggiori di 1 atm.
A temperature
sufficientemente
basse la CO2
gassosa brina