CCR
CARCINOMA DEL COLON RETTO
Vincenzo Stanghellini
051.636-4101
[email protected]
CCR lifetime risk
5%
Life habits
Hereditary factors
Epidemiologia
Nuovi casi / anno (incidenza)
Esofago
Nel mondo
In Italia
Colon-retto
150.000
670.000
970.000
2.000
10.000
32.000
Età max. incidenza
Rapporto M:F
Stomaco
6a - 7a decade di vita
3:1
2:1
1:1
INCIDENZA DI CANCRO IN EUROPA (N°/ANNO)
2%
4%
1%
GI (579542)
9%
Polmoni (301090)
32%
Mammella (291049)
Ginec (159922)
6%
Vescica (117346)
ORL (120101)
6%
Reni (66426)
9%
Brain (41354)
Mieloma (23239)
16%
15%
Altro (178217)
Source Globocan 2000
INCIDENZA DI CANCRO GI IN EUROPA (N°/ANNO)
6%
Colorettale (304687)
9%
Stomaco (130810)
10%
Pancreas (60139)
52%
Fegato (49574)
23%
Esofago (34332)
Source Globocan 2000
SOPRAVVIVENZA A 5 ANNI PER CANCRO GI IN ITALIA (%)
Colorettale (47)
Stomaco (24)
Esofago (8)
Fegato (4)
Pancreas (4)
Source Globocan 2000
BASSA PREVALENZA DI CCR EREDITARIO
Poliposi giovanile
Peutz-Jeghers
HNPCC
Sporadico
Turcot-Gardner
Bowden
FAP
FAP attenuata
Poliposi infiamm
Houston et al, BMJ 1990
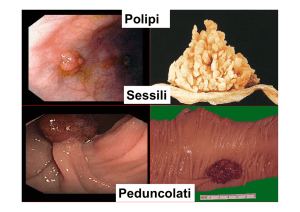
POLIPI E CCR
La maggior parte dei CCR originano da polipi adenomatosi, in seguito a
mutazioni che attivaziono oncogeni e inibiscono geni oncosoppressori
Probabilità di degenerazione maligna
1.
Forma
sessile
2.
Istologia
villoso > tubulo-villoso > tubulare
3.
X3
Dimensioni (>2.5 cm) > (1.5-2.5 cm) > (<1.5 cm)
10%
2-10%
> peduncolata
<2%
Polipi spesso non isolati ma associati ad altri polipi e/o CCR ( 30%)
CCR - FATTORI ESOGENI
Infiammazione cronica della mucosa intestinale
•
IBD: RCU, Crohn
•
anastomosi uretero-sigmoidea
•
FANS
Fattori dietetici
•
fibre vegetali
•
grassi animali
•
Ca++
ASPIRINA E MORTALITA’ PER CCR
RR 1,5
1,25
Popolazione US
Health professionals
1
0,75
Non consumatori di aspirina
0,5
0,25
Consumatori di aspirina
0
Incidenza CCR
Uso regolare sul lungo termine rischio nell’uomo
2-5 cp/wk
6-14 cp/wk
0.72
0.30
0.56-0.92
0.11-0.81
Chan et al. Gastroenterology 2008;134:21-8
Alimentazione e cancro
Argomento molto “caldo”
www.yahoo.com: 40.000.000 voci
Pubmed: 21.238 voci, 2157 nel 2006
CCR CHEMOPREVENZIONE: DIETA
RR
2
Grassi animali
1,5
1
Fibre vegetali
0,5
Consumo quotidiano
CCR CHEMOPREVENZIONE: DIETA RICCA DI FIBRE
Diluisce le sostanze cancerogene
Fermenta gli acidi grassi a catena corta
Accorcia il tempo di transito
Lega gli acidi biliari
Può contenere agenti anti-cancerogeni
CHEMOPREVENZIONE CCR
RAZIONALE DELL’APPORTO DI CALCIO
Elevato consumo CCR raro
Inibisce la proliferazione dell’epitelio nell’uomo
Previene la formazione di adenomi nei roditori
CONSUMO DI CALCIO E RISCHIO DI CCR
Casi /100,000
40
30
20
10
0
900
0
USA
Helsinki
Rural Denmark
1100
Copenhagen
Rural Finland
1300
1500
Consumo di Calcio
(mg/day)
1700
CCR - FATTORI GENETICI
RISCHIO DI CCR IN PARENTI DI PAZIENTI CON ADENOMA/CCR
Età del fratello con adenoma
n° di genitori o fratelli con cancro
9
9
6
6
3
3
RR
RR
0
0
<50
50-59
>60
0
1
>1
CCR - PATOGENESI MOLECOLARE
ONCOGENI
aumentata espressione, mut.puntiformi
ONCOSOPPRESSORI
inattivazione di entrambi gli alleli per delezione
cromosomica e/o mutazione puntiforme
METILAZIONE DNA
disattivazione (silenced expression) di geni che
vengono metilati (es.mismatch repair genes)
CCR - PATOGENESI MOLECOLARE
“tardivi”
ONCOGENI
- K-ras
Cr 18
mut.puntiformi 40-70% K – 5-50% adenomi
- c-myc
Cr 12
aumentata espressione 60-70% K
ONCOSOPPRESSORI (recessivi: entrambi alleli LOH loss of heterozigosity)
- APC
Cr 5
perdita allelica 20-50% K – 30% adenomi
- MMC
Cr 5
delezioni mut.puntiformi 55% K
- DCC
Cr 18
delezioni 70% K – raro adenomi
- Gene p53
Cr 17
perdita allelica 75% K – raro adenomi
Accumulo più che la sequenza il determinante principale della progressione neoplastica
APC K-ras progressione carcinogenetica in assenza di precursore adenomatoso (es. adenoCa in RCU)
Cr 5 - APC (adenomatous polyposis coli - tumor suppressor gene)
APC è stato clonato nel 1991 mediante: a) identificazione delezione interstiziale
sul cromosoma 5q in pz con FAP (LOH); b) studi di analisi del linkage
Studi successivi hanno dimostrato che APC è fondamentale anche in CCR
sporadici (>70% - caratteristica peculiare dei CCR)
>90% delle mutazioni del gene APC determinano un segnale di stop prematuro e
di conseguenza un prodotto genetico troncato ed inefficace. Tale proteina
troncata tipica di APC mutati viene impiegata per lo screening genetico
MODELLO MOLECOLARE DI PROGRESSIONE NEOPLASTICA DEL CRC
Delezione DCC
Cr 18
(displasia)
Inattivazione
Oncosoppressore APC
Cr 5
Normale
Epitelio
iperproliferativo
Attivazione
Oncogene Ras
Cr 18
Piccolo
adenoma
Inattivazione p53
Cr 17
Grande
adenoma
Cancro
Displasia
Lieve Moderata Severa
Altre anomalie
DNA-MMR etc.
Metastasi
APC/-CATENINA PATHWAY
APC proteina di grandi dimensioni che regola il legame di proteine
intracellulari (-catenina, -catenina, GSK-3, exina, tubulina, GB1, hDLG)
degradazione citosolica (fosforilazione)
-catenina proteina che favorisce l’aggregazione intercellulare
APC mutato accumulo citoplasmatico di -catenina
-catenina in eccesso al nucleo dove interagisce con il fattore di
trascrizione T-cell (Tcf) determinando up-regulation di vari oncogeni (C-Myc,
cyclin D1, PPAR-) (enterociti cripte della mucosa del colon)
APC/-CATENINA PATHWAY
Ruolo precoce della via APC/-catenina (riscontro di alterazioni della catenina, anche in polipi adenomatosi benigni)
Alterazioni di -catenina possono portare alla formazione di polipi anche in
presenza di APC normale, in quanto “successive” a quelle di APC
Peroxisome proliferator-activating receptor gene (PPAR). Inibito dai FANS
Oncogene?
Modulatore?
Codifica
per
recettori
nucleari
(regolatori
di
trascrizione di proteine che controllano il metabolismo dei lipidi e la crescita
cellulare).
Se attivato
neoplastiche
crescita cellulare, ma differenziazione in cellule
PATHOGENETIC MECHANISMS OF NSAID-GASTROPATHY
ARACHIDONIC ACID
COX-1
COX-2
costitutive
inducible
Protective Pg
PgI2
Pro-inflammatory Pg
PgE2, PgD2, PgF2a
Gastric mucosal protection
Platlet aggregation
Inflammation
PATHOGENETIC MECHANISMS OF NSAID-GASTROPATHY
ARACHIDONIC ACID
COX-1
costitutive
NSAIDS
COX-2
inducible
Protective Pg
PgI2
Pro-inflammatory Pg
PgE2, PgD2, PgF2a
Gastric mucosal injury
Platlet aggregation
Analgesic effect
Inflammation
Drosophila melangoster o mosca comune della frutta
Wnt = wingless / intern gene la cui
mutazione recessiva si caratterizza con
assenza di ali della drosophila melangaster
WNT1
WNT2, WNT2B
WNT3, WNT3A
WNT4
WNT5A, WNT5B
WNT6
WNT7A, WNT7B
WNT8A, WNT8B
WNT9A, WNT9B
WNT10A
WNT10B, WNT11
WNT16
Geni umani che codificano per proteine Wnt
Wnt signaling pathway è un insieme di proteine
designate al trasporto di informazioni dalla superficie
cellulare al nucledo coinvolte in comunicazioni tra
cellule sia nell’embrione che nell’adulto
Fz o FRZ (frizzled) = arricciato, increspato
DSH (dishevelled) = arruffato, scapigliato
Wnt (wingless intern gene)
Fz o FRZ (frizzled)
DSH (dishevelled)
The Wnt/wingless signaling pathway
Proteine Wnt si legano a recettori di
membrana (G-protein) della famiglia Frizzled
(Fz o FRZ) (polarità cellulare) proteine
della famiglia Dishevelled (DSH) (polarità e
differenziazione cellulare) β-Cat che può
raggiungere il nucleo (Arm) fattore di
trascrizione cellulare (T-cell factor = Tcf)
oncogeni
The Wnt/wingless signaling pathway
Dishevelled (DSH) è parte del compesso
recettoriale di membrana FRZ per proteine Wnt
Wnt/FzDSH axin/GSK/APC β-Cat nel
citoplasma β-Cat nel nucleo dove, legando il
fattore di trascrizione T-cell (Tcf) vari oncogeni
(COX-2, PPAR-, C-Myc, cyclin D1)
NSAIDS
?
Metilazione del DNA
Fondamentale fattore epigenetico. Possibile residuo di antiche infezioni
virali (normale meccanismo di identificazione self non-self nei virus)
Modificazione chimica del DNA (CH3) che può essere ereditata e
successivamente rimossa senza modificare la sequenza originale
Es: CH3-C5 dell’anello pirimidinico della citosina ( legame con proteine
trascrizionali) espressione genica (tipico di tutti i vertebrati)
Fisiologicamente coinvolto nello sviluppo (imprinting, inattivazione cr-X,
soppressione di elementi ripetitivi) ma anche carcinogenesi
Ipometilazione: precoce; instabilità cromosomica, imprinting loss (LOI)
Ipermetilazione: associata a promoters e spesso indotta da gene (oncogene
suppressor) silencing
Centinaia di migliaia di geni metilati in ciascuna cellula neoplastica
Cr 18 - Oncogene K-ras
H- K- N-ras. K-ras è più frequentemente coinvolto nel CCR
Codificano per una famiglia di piccole proteine di transmembrana simili a
G-proteins che agiscono come interrutori unidirezionali per la trasmissione
di stimoli extra-cellulari di accrescimento nucleare
In condizioni fisiologiche oscillano da una forma attiva (GTP-bound) ad una
inattiva (GDP-bound). Point-mutations resisetenza a GTP-ase e fissano
la forma attiva continuo stimolo proliferativo
Mutazioni di ras in CCR sporadici (50%), adenomi >1 cm (50%) e solo
raramente in adenomi piccoli.
Ras mutato nelle feci possibile test di screening (fasi precoci di CCR)
Cr 17 - Oncosoppressore p53
Gene più frequentemente mutato nelle neoplasie maligne dell’uomo,
raramente nelle forme benigne (es. adenomi)
In condizioni fisiologiche codifica per attivatore trascrizionale di geni
inibitori della crescita (>20) che interviene in condizioni di stress (es.
danneggiamento del DNA, O2) per facilitare la riparazione del DNA
Previene la propagazione di cellule con DNA danneggiato
“guardiano del genoma” (pro-apoptotico)
Indice prognostico quod vitam negativo
CCR – FORME FAMILIARI
SYNDROMI POLIPOSICHE GI EREDITARIE
(AUTOSOMICHE DOMINANTI)
Sindrome
sede
istotipo
pot. maligno
lesioni associate
HNPCC
colon
adenoma
comune
endometrio, ovaio, ecc.
FAP
“
“
“
UGI, CNS, tiroide, ecc.
Gardner’s
intestino
“
“
osteomi, fibromi, lipomi, cisti
epidermoidi, cancro ampollare
Turcot’s
colon
“
“
tumori cerebrali
Peutz-Jeghers
tratto GI
amartoma
raro
pigmentazione mucocutanea,
tumori di ovaio, mammella,
pancreas, endometrio
Poliposi giovanile “
amartoma
>adenoma
“
varie, congenite
FAP
familial adenomatous polyposis
•
1:8.300-14.025 nati vivi
•
Prevalenza 2.3 – 3.2 / 100.000
•
M:F = 1:1
•
>100 adenomi del colon e/o adenomi multipli + parente I° FAP
•
75-80% ha un genitore affetto
•
0.5-1% CCR (in calo per diagnosi precoce)
•
100% rischio di evoluzione maligna
•
Mutazioni APC (braccio lungo 5q) (tutte le cellule hanno un allele mutato - la malattia
adenomatosa inizia per delezione/mutazione dell’allele inizialmente sano)
ETA’ E SVILUPPO DELLA NEOPLASIA IN FAP
100
95% pts ha polipi a 35 aa
% con neoplasia
80
Età media alla comparsa 39 (34-43)
60
FAP
Cancro su
Adenoma
40
20
Sporadico
0
0
10
20
30
Età media all’esordio16 (7-36)
40
50
60
70
80
90 anni
Quando effettuare i test genetici?
1.
Persone con caratteristiche incerte di FAP (20 polipi, senza familiarità)
2.
Persone con FAP manifesta (100 polipi), ma senza altri casi noti nella
famiglia (paternità dubbia?)
3.
Parenti di soggetti affetti da FAP con mutazione genetica nota (stessa
mutazione in tutti i membri della famiglia – normale rischio di CCR)
N.B. La mancata evidenza di mutazioni genetiche
non esclude la presenza di FAP (10% falsi –vi)
HNPCC
hereditary nonpolyposis colorectal cancer
già sindrome di Lynch
•
•
•
•
•
0.8 - 1% CCR
Rari adenomi del colon in trasformazione maligna
45% sviluppa altri carcinomi colici o extra-colici entro 10 aa dal K colon
Instabilità microsatellitare (MSI)
Mutazioni MMR (MLH1 – MSH2 - …) >95% dei casi
HNPCC
Esordio
precoce
Localizzazioni
primitive multiple
Predominanza nel
colon destro
adenomi
pochi o assenti
Carattere autosomico
dominante
Cancro
dell’endometrio
CRITERI DI AMSTERDAM PER HNPCC
3. Tre o più membri
con CRC
2. Due o più
generazioni
80 anni
41 anni
K. endometrio
54 anni
22 anni
1. Un membro parente di
1° di altri due
1. In uno o più membri
diagnosi a < 50 anni
0. FAP è stata esclusa
Tutti i criteri devono essere soddisfatti per la diagnosi di HNPCC
TUMORI EXTRA-COLICI IN HNPCC
Keratoacanthoma / neoplasia delle ghiandole sebacee
(sindrome di Muir-Torre)
Epatobiliare
Stomaco
Tenue
Vie urinarie
Endometrio
Ovaie
HNPCC
Rischio di cancro (%)
100
CRC
50
Endometrio
0
0
10
20
30
40
Età
50
60
Mismatch repair (MMR) genes
Correggono accoppiamenti sbagliati delle basi e piccole inserzioni o
delezioni che avvengono durante la replicazione del DNA
hMSH2 e 6 (human mutS homolog 2 e 6), hMLH1 e 3 (human mutL
homolog 1 e 3), hPMS1 e 2 (human postmeiotic segregation 1 e 2) , hEXOI
(human exonuclease I)
In HNPCC (mutazioni / perdita allelica) e 20% di CCR sporadici
(metilazione regione promoter / loss of imprinting -LOI)
Imprinting = perdita selettiva dell’espressione di specifici geni parentali
indotta da metilazione di un allele
Struttura DNA
Polimero a doppia elica i cui monomeri sono desossiribonucleotidi :
Desossiribosio
Gruppo fosfato
Base azotata
puriniche
(adenina - guanina)
pirimidiniche
(citosina - timina)
Modello semplificato di mismatch repair umano
hMSH2 forma con hMSH6 un eterodimero che corre lungo la catena di DNA
per identificare errori
hMLH1 si unisce a PMS2 e, sotto l’effetto di ATP legano hMSH2-hMSH6
Il complesso di 4 proteine e 2 ATP attiva hEXOI ad effettuare la riparazione
Microsatellite instability (MSI)
Zone “microsatellitari” (sequenze ripetute di coppie di basi x 10-100)
Mutazioni
accumulo di errori nel genoma particolarmente
frequenti nelle zone “microsatellitari” che sono particolarmente
“pericolose” si trovano anche in geni che controllano la crescita
(es. BAX apoptosi) microsatellite instability (MSI)
LINEEGUIDA PER TEST GENETICI IN CCR
•
Forte anamnesi di CCR familiare
•
Risultati interpretabili adeguatamente
•
Possibilità di influenzare screening e gestione di pazienti e/o familiari
TEST GENETICI DISPONIBILI
•
FAP
•
HNPCC
•
Peutz-Jeghers syndrome (PJS)
•
Familial juvenile polyposis (JPS)
http://www.genetests.org consulenza genetica (anamnesi familiare, calcolo del rischio, selezione del test)
ROLE OF INTESTINAL MICROFLORA ON THE DEVELOPMENT OF
TUMOR IN MURINE MODEL FOR IBD OR IBD-CANCER
GPX- KNOCK-OUT MICE
Glutathion Peroxidase (GPx)
Chu, Cancer Res., 2004;64:962-8
Tumor induced in mouse ileum and colon
GPX- KO
Holoxenic
Germ-free
P53-/- TCRß -/- KNOCK-OUT
GPX
28/130 (21.5%)
0/84(0%)
0/28(0%)
0/11(0%)
Colon Adenocarcinoma
Kado et al, 2001;61:2395-8
Germ-free
Holoxenic
P-Value
Incidence %
0
70%
<0.05
N° of Adenoca./
mouse
0
0.8±0.8
<0.05
Human Microbiota
> x10 eucariote cells
A human supraorganism
~20,000
Genes protein-coding
encode
9x106 genes
450-fold more
than human genome
1000-1150
bacterial species identified
Each individual harbours 1-1.5 Kg
of microbiota
Each individual
harbours >160 species
>57 species common to
>90% of individuals
Turnbaugh et al, Nature 2007; Qin et al, Nature 2010
Effetti del microbiota nell’uomo
Patologici
Fisiologici
•
•
•
•
•
•
•
Normale sviluppo GI
Adattamento immunologico
Protezione da patogeni
Digestione polisaccaridi
Assorbimento lipidico
Metabolismo di carcinogeni
…
•
•
•
•
•
•
•
•
•
•
•
•
Alterate funzioni digestive
CCR
IBD
SIBO
IBS
Colite da antibiotici
Enterite necrotizzante
Steatosi epatica
Obesità
Abnorme percezioni dolorose
Turbe psicologiche
…