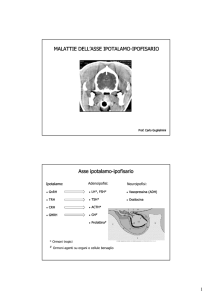
Ipotalamo e ipofisi posteriore
• L’ipotalamo è la regione cerebrale che fornisce
risposte neuro endocrine integrando segnali
provenienti dall’ambiente, da altre aree cerebrali
e dagli organi periferici. Trasforma impulsi
nervosi in informazioni ormono mediate
• L’ipotalamo influenza numerosi aspetti della vita
quotidiana: l’introito alimentare, il dispendio
energetico, il peso corporeo, l’introito di liquidi, la
pressione arteriosa, la sete, la temperatura
corporea, il ciclo sonno veglia
• L’ipotalamo regola l’attività secretoria
dell’ipofisi che a sua volta regola altre
ghiandole (tiroide, corteccia surrenalica,
gonadi)
• Il controllo è attivato da due meccanismi: la
secrezione di neuropeptidi ipotalamici
trasportati lungo il peduncolo ipofisario
all’ipofisi posteriore
• e la secrezione di peptidi che mediano la
secrezione ormonale adenoipofisaria
Anatomia funzionale
• L’ipotalamo è una parte del diencefalo
localizzata sotto il talamo e tra la lamina
terminale e i corpi mammillari che formano le
pareti e il pavimento del 3° ventricolo.
• Sul pavimento del terzo ventricolo le due
halves dell’ipotalamo si riuniscono a dare una
struttura nota come eminenza mediana.
• L’eminenza mediana è importante in quanto è
la sede dove hanno termine gli assoni che
originano dai neuroni ipotalamici. È la sede
dove sono secreti i neuropeptidi coinvolti nel
controllo della funzione adenoipofisaria.
L’eminenza mediana forma la porzione
infundibolare della neuroipofisi; è attraversata
dagli assoni che terminano nell’ipofisi posteriore
Nuclei ipotalamici
Nell’ipotalamo i corpi neuronali sono organizzati
in nuclei: i magnocellulari (sopraottico e
paraventricolare) secernono ossitocina e
vasopressina; i parvicellulari secernono
neurormoni ad azione stimolatoria o inibitoria
dell’adenoipofisi
Vascolarizzazione
• L’ipotalamo è irrorato dai rami arteriosi derivati
dal poligono cerebrale di Willis, il sangue refluo
è drenato in parte dal sistema portale ipofisario
e in parte dalla vena basale di Rosenthal
• Il network capillare che fornisce un adeguato
apporto ematico all’eminenza mediana, al
peduncolo ipofisario e all’ipofisi ha un ruolo
chiave nel trasporto dei neurormoni ipotalamici
all’adenoipofisi
Regolazione della secrezione
ormonale
• L’ipotalamo riceve e integra segnali
provenienti da molteplici aree cerebrali.
• Alcuni di questi segnali afferenti
trasportano informazioni sensoriali
provenienti dall’ambiente esterno quali
luce, calore, freddo, rumore. Altri segnali
percepiti dall’ipotalamo provengono da
organi interni quali intestino,cuore, fegato
e stomaco.
• I segnali vengono trasmessi grazie a neurotrasmettitori (dopa, noradrenalina, serotonina)
• Gli ormoni circolanti prodotti dagli organi bersaglio
e i substrati (quali il glucosio) regolano la funzione
• La regolazione della secrezione ormonale è un
evento dinamico. Si adatta di continuo a
modificazioni ambientali e a modificazioni del
milieu interno di un soggetto
Funzioni non endocrine
• Temperatura corporea: regolata
prevalentemente da meccanismi nervosi di
feedback che operano quasi tutti
attraverso centri termoregolatori situati
nell’ipotalamo.
• Nella regione pre ottica e dell’ipotalamo
anteriore sono situati neuroni sensibili che
ricevono da recettori periferici gli stimoli.
• Febbre- tumori
• Appetito: controllo assunzione di cibo in
risposta al consumo energetico. Centro
della sazietà localizzato nel nucleo
ventromediale e centro della fame
localizzato nell’ipotalamo laterale.
• Nell’ipotalamo ci sono neuroni sensibili ai
livelli di glucosio e in risposta
all’ipoglicemia inducono l’aumento degli
ormoni controregolatori (GH) e tramite il
sistema nervoso autonono stimolano la
glicogenolisi e la neoglucogenesi al livello
epatico
• Bilancio idroelettrolitico: ottenuto dal
bilancio di due attività: una il centro
antidiuretico che promuove la sintesi e il
rilascio di vasopressina, l’altra il centro
della sete.
• Ritmo sonno-veglia: lesioni nell’area
ipotalamica mesencefalica causano
ipersonnia o inversione del ritmo
sonnoveglia
• Memoria: l’ipotalamo è strettamente
correlato alle strutture nervose associate
alla memoria
• Funzione cardiovascolare: la stimolazione
dell’area preottica, causa bradicardia,
ipotensione e alterazioni ECG, mentre una
sua lesione può provocare ipertensione
(l’ipotalamo potrebbe intervenire nella
ipertensione e aritmie legati all’emozione)
• Funzione gastrointestinale: connessioni
ipotalamo con intestino tramite il vago
(fase cefalica della digestione)
• Ritmi biologici: l’integrità delle vie
retinoipotalamiche è essenziale per il
mantenimento dei ritmi circadiani
Ormoni ipotalamici
• GHRH: stimola la sintesi e la secrezione di
GH da parte delle cellule somatotrope
dell’adenoipofisi. Deriva da un precursone
il pre-proGH il cui gene è localizzato sul
cromosoma 20. I neuroni deputati sono nel
nucleo arcuato, ma è presente anche in
altre aree ipotalamiche, nel GE e nella
placenta.
• Secreto in modo pulsatile, agisce dopo il
legame col recettore specifico attivamdo
un meccanismo AMPc dipendente
• Somatostatina: inibisce la secrezione di
GH e TSH, le cellule secernenti sono
localizzate nel nuclo arcuato,
periventricolare e ventromediale, ma
anche GE , pancreas, tiroide, ghiandole
salivari e apparato urinario.
• Breve emivita, riduce la produzione di
AMPc e la diminuzione dell’introito di
calcio nella cellula. inibisce inoltre la
secrezione di insulina, glucagone e di
molti ormoni intestinali
• farmaco
• GnRH: gonadotropin releasing Hormone
(gene localizzato sul cromosoma 8), la
maggiror parte localizzato sul nucleo
arcuato, secreto in maniera pulsatile
stimola la secrezione di LH e in minor
misura di FSH interviene nella
gametogenesi e nella steroidogenesi.
• E’ responsabile del comportamento
sessuale
• Farmaci: utilizzati (gli analoghi )
nell’ipogonadismo, nell’induzione di
fertilità; gli antagonisti: castrazione
farmacologica, carcinoma della prostata
• TRH: sintetizzato dai neuroni parvicellulari,
gene localizzato sul cromosoma 3.
• L’interazione col recettore promuove
l’idrolisi dell’inositolo trifosfato e
l’attivazione della proteinchinasi C con
mobilizzazione del calcio all’interno della
cellula.
• Ha emivita molto breve: stimola la
secrezine di TSH, inibisce il GH e stimola
la prolattina.
• farmaco
• CRH: corticotropin releasing Hormone.
Gene localizzato sul cromosoma 8
• Stimola la sintesi e la secrezione di ACTH
inducendo un aumento di AMPc
• È identificato anche in altre aree cerebrali
dove agisce come neuro trasmettitore
nella regolazione della risposta allo stress
• Farmaco
• PIH: prolactin inhibiting hormone: il
controllo ipotalamico sulla secrezione della
prolattina è prevalentemente di tipo
inibitorio. L’ipotalamo esercita una azione
inibitoria essenzialmente tramite la
dopamina
• PRH: numerosi peptidi regolano la
secrezione di prolattina agendo
direttamente sulle cellule lattotrope
• MSH. Melanocito stimolante
Malattie ipotalamiche
Malformazioni displasia setto-ottica, encefalocele
Tumori: craniofaringioma, glioma, amartoma,
disgerminoma, meningioma…
Traumi: patologie iatrogene (chirurgia e
radioterapia)
Infezioni: encefaliti e meningiti
Malattie infiltrative: sarcoidosim istiocitosi X, TBC
Idrocefalo
Malattie familiari (Prader Willi, Kallmann)
Segni e sintomi dei tumori
ipotalmamici
• Sistema endocrino: bassa statura, ritardo di
crescita, diabete insipido, ipogonadismo,
pubertà ritardata o precoce, iperprolattinemia
• Sistema vegetativo: amnesia, disturbi del
comportamento, ipersonnia, sete diminuita o
aumentata, alterazione della fame e peso
corporeo, alterazione dell’omeostasi termica
• Alterazioni dovute all’effetto massa: ipertensione
endocranica, diminuzione dell’acuità visiva,
segni neurologici (emiparesi)
Ipofisi posteriore
• L’Ossitocina e vasopressina (o ormone
antidiuretico) sono sintetizzati come preormoni
nel RE dei N. magnocellulari dell’ipotalamo.
Inclusi in granuli secretori del Golgi e trasportati
lungo il peduncolo ipofisario. Nel corso di tale
trasporto i pre ormoni vengono processati a dare
l’ormone con la specifica neurofisina. Il
contenuto delle vescicole neurosecretorie viene
rilasciato per esocitosi in corrispondenza
dell’ipofisi posteriore con l’apertura di canali di
Ca++
Ossitocina
• Secreta durante l’allattamento e durante il
parto
• I due principali organi bersaglio sono la
mammella e l’utero.
• Stimola la secrezione del latte e induce
ritmiche contrazioni dell’utero, promuove
la regressione dell’utero al termine del
parto, ha effetti sul comportamento
materno e l’amnesia
Controllo
• La secrezione di ossitocina è principalmente
indotta dalla stimolazione meccanica della
cervice uterina ad opera del feto al termine
della gestazione. L’attività contrattile dell’utero
agisce con un meccanismo di feed back
positivo durante il parto sulla secrezione di
ossitocina.
• L’aumentata responsività uterina è anche
dovuta all’aumentata formazione di gap-junction
tra le fibre muscolari lisce e l’aumentata sintesi
di prostaglandine
• La secrezione di ossitocina viene indotta dalla
stimolazione dei recettori tattili localizzati sui
capezzoli durante la suzione nel corso
dell’allattamento
• La secrezione di ossitocina viene inibita dal
dolore, dall’aumento della temperatura
corporea, dal rumore
• Recettori: gli effetti fisiologici si manifestano
dopo il legame con un recettore accoppiato alla
proteina G
Arginina vasopressina
• Peptide prodotto da neuroni magnocellulari.
Agisce sul riassorbimento di acqua
aumentando la permeabilità dell’acqua dei
tubuli contorti distale e dei dotti collettori.
• Il risultato è la produzione di un ridotto
volume di urine maggiormente concentrate.
• Determina anche l’aumento delle resistenze
vascolari
• Il tubulo prossimale è responsabile del
riassorbimento di circa il 90% dell’acqua filtrata.
Il riassorbimento del restante 10% nei dotti
collettori distali è sotto il controllo dell’AVP.
• L’importanza dell’AVP è evidente se si
considera al quantità di urine che verrebbe
escreta in sua assenza.
• Controllo
– L’AVP è secreta in risposta all’aumento
dell’osmolarità plasmatica o alla riduzione del
volume ematico
– La secrezione di AVP è stimolata da una riduzione
della PA del 10%
recettori
• Gli effetti dell’AVP sono mediati dal
legame dell’ormone con recettori
accoppiati alle proteine G.
Diabete insipido
È caratterizzato dall’escrezione di abnormi volumi di urine diluite e da
sete eccessiva
• Ridotta secrezione di AVP: centrale o neurogeno
per cause traumatiche, infiammatorie o infettive
e neoplastiche
• Ridotta sensibilità renale all’AVP: forme
acquisite (ipokaliemia, poliuria post ostruttiva,
trattamento con litio) o congenite (queste legati
al cromosoma X alterazioni di un gene
codificante per il recettore V2R)
• Eccesso di introito d’acqua
Meccanismi patogenetici
1. Deficit di solito non assoluto di AVP:
diabete insipido ipotalamico o centrale
2. Resistenza parziale o totale all’AVP:
diabete insipido nefrogenico
3. Eccesiva introduzione di liquidi:
diabete insipido dipsogeno o polidipsia primaria
Diabete insipido centrale e chirurgia ipofisaria
50-60% dei pazienti presenta un diabete insipido transitorio entro le prime 24 h dall’intervento
La resezione completa del peduncolo ipofisario può portare al cosiddetto “diabete insipido
trifasico”, che può essere permanente o divenire parziale o clinicamente inapparente
10% dei pazienti presenta solo una fase di iponatremia transitoria ~ 7 gg dopo un intervento di
chirurgia ipofisaria, detta anche “isolated second phase “
Diabete insipido centrale e traumi cranici
I pazienti traumatizzati possono sviluppare anch’essi il pattern del
diabete insipido trifasico
I pazienti incoscienti non possono beneficiare del normale
senso di sete
Il rischio di non riconoscere la seconda fase del diabete insipido
trifasico è maggiore in tali pazienti in quanto l’ipoNa+ può indurre edema
cerebrale e peggiorare gli edemi causati dal trauma
Maggiore incidenza di insufficienza ipofisaria anteriore in associazione
al diabete insipido
Diabete insipido nefrogenico
Quadro clinico
Comparsa precoce, entro primo anno
Poliuria, polidipsia, disidratazione, vomito,
stipsi, episodi febbrili, pianto continuo, ritardo
dell’accrescimento staturo-ponderale,
megavescica, idronefrosi
Diagnosi
Poliuria ipostenurica
Ipernatriemia e iperosmolarità plasmatica
Test DDAVP: mancato aumento dell’osmolarità urinaria (< 200 mOsm/kg)
Analisi genetica del probando e della famiglia
Diabete insipido nefrogenico
Le forme acquisite di DI nefrogenico sono molto più frequenti delle forme congenite
Farmaci
•Litio
meccanismo AVP dipendente e AVP indipendente
Si scambia con Na+ intracellulare
AVP
subunità Gα del recettore V2
eliminazione di Na+ e H2O
di AQ2
adenilato ciclasi di membrana
•Demeclociclina
Li
Inibizione adenilato ciclasi
Altri meccanismi
•Diuretici osmotici: glucosio, mannitolo, (alimentazione iperproteica naso-gastrica)
•Antivirali
Ipopotassiemia (associata a iperkaliuria)
Ipercalcemia (associata a ipercalciuria)
Sindrome paraneoplastica
Anemia falciforme
Sarcoidosi: Di centrale, DI nefrogenico
S.Sjögren
Gravidanza:
vasopressinasi placentare nel 3° trimestre
clearance di AVP
AMPC
AQ2
Diagnosi di diabete insipido
Non esistono caratteristiche cliniche specifiche in grado di orientare
sulla possibile eziologia di una poliuria
Test di prima linea per confermare la presenza di diabete insipido:
•Volume urinario delle 24 h (elevato sospetto con un volume > 3L/die)
•Esame chimico-fisico delle urine: peso specifico, se è
ci permette di
escludere la presenza di una poliuria osmotica (es. diabete mellito)
•Osmolarità urinaria e plasmatica
•In base all’anamnesi: funzione ipofisaria (cortisolo, PRL, TSH, steroidi
sessuali ecc.), marker tumorali (es. β-hCG nel sospetto di germinoma)
Diagnosi
• Determinazione livelli circolanti di AVP
• Test dell’assetamento
• Infusione di desmopressina
Diagnosi differenziale
Osmolarità
plasmatica
(v.n. 280-295
mOsm/kg)
Osmolarità urinaria
ADH
(v.n. 600-900 mOsm/kg) (v. .n 1-5 pg/ml)
DI
neurogenico
≥
<
<
DI
nefrogenico
≥
<
≥
Polidipsia
nervosa
<
<
<
NB: il dosaggio dell’arginina-vasopressina è praticato in modo affidabile
in pochi laboratori
Test di deprivazione idrica seguito dalla
somministrazione di desmopressina
•Eseguire preferibilmente al mattino
•Interrompere l’idratazione 2-3 h prima del test
•Tenere sotto controllo il paziente per evitare l’introduzione di liquidi
(polidipsie psicogene)
•Somministrare la desmopressina (1 µg sc o 10 in)
almeno del 2% del peso corporeo
o una differenza nell’osmolarità urinaria al 10% in 2-3 raccolte consecutive
NB: Il test va sospeso in caso di
del peso corporeo > 5% o di Na+ > 145 mmol/L
Terapia del diabete insipido
Obbiettivi principali
1. Correzione del deficit idrico
2. Riduzione delle perdite idriche urinarie
La terapia specifica varia in rapporto
alla diversa situazione clinica
Terapia del diabete insipido
Idratazione adeguata
Riduzione del carico osmolare alimentare
Risoluzione dei possibili fattori scatenanti
Farmaci
a) Risparmiatori di acqua
Arginin-vasopressina
Desmopressina
Clorpropamide > rilascio centrale di AVP
> Azione renale di AVP
Indometacina (anti PG) < diuresi 50-70%
Sindrome da inappropriata
secrezione di ADH
• Caratterizzata da ipoosmolarità
plasmatica, iposodiemia da emodiluizione
e osmolarità urinaria inappropriatamente
elevata.
• Come conseguenza di un tumore
secernente AVP.
• Può aver sede nell’encefalo, ma anche
nel polmone
Table 9–3. Common Causes of Syndrome of Inappropriate
Antidiuretic Hormone Secretion
Tumors
1. Pulmonary-mediastinal (bronchogenic carcinoma; mesothelioma;thymoma)
2. Nonchest (duodenal; pancreatic; ureteral/prostate; uterine;nasopharyngeal)
Central Nervous System Disorders
1. Mass lesions (tumors; brain abscesses; subdural hematoma)
2. Inflammatory diseases (encephalitis; meningitis; systemic lupus;
3. Degenerative-demyelinative diseases (Guillain-Barre´; spinal cord lesions)
4. Miscellaneous (subarachnoid hemorrhage; head trauma; hydrocephalus)
Drug Induced
1. Stimulated AVP release (nicotine; phenothiazines; tricyclics)
2. Direct renal effects and/or potentiation of AVP antidiuretic effects
(dDAVP; oxytocin; prostaglandin synthesis inhibitors)
3. Mixed or uncertain actions (angiotensin-converting enzyme,Ecstasy…)
Pulmonary Diseases
1. Infections (tuberculosis; acute bacterial and viral pneumonia;…)
2. Mechanical-ventilatory
Other
1. AIDS,2. Prolonged strenuous exercise,3. Senile atrophy,4. Idiopathic
AVP,arginine vasopressin; COPD, chronic obstructive pulmonary disease;
dDAVP,1-deamino(8- D-arginine) vasopressin.
Clinica della SIADH
• Sodio ematico > o= 125 mEq/l:
asintomatica
• Sodio ematico< 125 mEq/l: anoressia,
nausea, vomito, cefalea, irratabilità,
depressione, letargia, confusione,
convulsioni, coma





![MATEMATICA DI PRIMAVERA [6] A. Utilizzando la formula diretta e](http://s1.studylibit.com/store/data/000877889_1-bb89aa9dad05c1f6555758a9b74714eb-300x300.png)