H
H
C
O
N
H
C
C
N
C
S
H
H
H
H
C
X
C
H
C
C
H
H
Furano (X = O)
Tiofene (X = S)
Pirrolo
3
4
2
5
N1
H
N
N
N
N
N
H
H
H
H
H
Sintesi di Paal-Knorr
H 2C
CH3
C
O
CH 2
H
C
H 2C
+
HO
CH3
C H3
H 3N
CH3
C
C
+O
O
HC
C
CH 2
NH 2
C
O
H 2C
CH 2
C H3
C H3
CH3
O
H 2C
CH 2
H
C
C
+
HO
C H3
CH3
NH 3 O
+
CH 2
C
C
NH 2
O
C H3
H
+
H
H
HC
+
C
CH 3
CH 2
NH 2
C
HO
+
HC
C H3
C
CH 3
CH 2
+
N
HC
+
C
C H3
OH
H H
H
H 2C
+
H 2O
C
CH 3
NH 2
C
CH 3
CH 2
N
C
OH
H
C H3
CH 2
C
O
C H3
Sintesi pirrolica di Knorr
CH3
EtOOC
C
CH
COOEt
O
CH3
H 2C
NH 2
C
O
C H3
EtOOC
O
C
H
CH3
OH
+
N
CH
+
COOEt
H 2C
C
CH3
EtOOC
H
COOEt
OH
+ CH
C
C
H
C
N
CH3
H
H
CH3
HO
EtOOC
COOEt
C
C
H
C
N
C
H
+
CH3
H
CH3
+ C
H 2O
C
EtOOC
H
C
N
C
CH3
COOEt
CH3
H+
CH 3
C
EtOOC
C
N
COOEt
CH3
OH
CH 2
O
H
C
C
COOC 2 H 5
CH 3
H+
COOC 2 H 5
CH 3
C
CH
COOC 2 H 5
NaNO2
CH 3COOH
OH 2
O
H
C
C
N
O
C
C
H
N O
CH 3
C
H
O
CH 3
C
H 2O
COOC 2 H 5
+
OH
O
C
COOC 2 H 5
N
OH
Zn
CH 3COOH
CH 3
C
CH
NH2
COOC 2 H 5
+
H3 O
CH3
HO
EtOOC
COOEt
C
C
C
+
N
H
H
C
H
CH3
Sintesi di Hantzsch
O
CH 3
C
CH 2
C
O C 2H5
+
NH 3
CH 3
O
EtOOC
C
C
CH3
EtOOC
CH3
C
CH 2
C
CH 3
O C 2H5
NH
H
NH 2
CH2
C
Cl
EtOOC
Cl
C
CH3
EtOOC
CH 2
NH 2
C
O
C H3
CH
C
C H3
O
C
O
O
H 2O
C
C
CH3
H
CH 2
+
N
EtOOC
O
C
H
CH3
CH3
CH
C
O C 2H5
NH 2
+
H
CH2
+
C
NH 2
O
C
EtOOC
C H3
EtOOC
CH
C
CH3
CH 2
C
NH
C
C H3
C
CH3
CH 2
NH 2
O
C
C
CH 2
N
H
C CH
3
OH
EtOOC
H
+
CH3
C H3
O
C
C
C
CH 2
N
H
EtOOC
C
C H3
OH 2
+
CH3
C
C
C
N
H
C
H
CH3
Sostituzioni elettrofile aromatiche
O
O
HNO 3 + CH 3 C
O
O
O
O
CH 3 C
C CH3
O
NO 2 + CH 3 C
CH 3 C O NO 2
OH
( CH 3 CO ) 2O
N
H
nitrato di acetile
N
H
NO 2
2-nitropirrolo
O
O
+
N O
+ O
+
N O
CCH3
N
H
O
N
H
+
+
O
O
H
CCH3
+
N
H
O
O
NO 2
O
H
+
N
H
NO 2
CH3C
O
N
H
O
CH3 CO
H
N
NO 2
H
N
NO 2
OH
H
O
NO 2
N
H
NO 2
N
H
H
H
N
H
CH3C
+
NO 2
N
H
CH 3CO
NO 2
H
N
H
NO 2
H
NO 2
CH3C
O
+
O
+
N S
O
N
SO3
N
O
H
N+
H
H
SO3
N
N+
+
HCl
N
H
H
SO3H
+
H
acido 2-pirrolsolfonico
+
N
( CH3CO ) 2 O
O
CH3 COONa
+
a caldo
N
H
CH3C
OH
CH 3
C
O
Reazione di Mannich
H
O
O
C
H + ( CH3 ) 2NH + CH3 C
O
+
CH 2 N ( CH3 )2 CH3 C
ione imminio
OH
+
CH 2
+
N ( CH3 ) 2
H
N
N
H
H
CH 2
H
N ( CH3 ) 2
O
+
N
H
C H 2N (C H 3 ) 2
N + Cl
H
In presenza di acidi forti il pirrolo si trasforma in trimero:
H
H
H
N
H
H
H
+
H
+
H
H
N
+
N
H
H
H
N+
H
N
N
H
H
H
+
N+
N
N
H
H
H
H+
H
N
N
+
N
N
N
H
H
H
H
H
N
H
N
N+
H
H
H
N
N
N
H
H
H
N
N
H
H
+
PIRROLIDINE
3
4
5
2
N1
H
Farmaci a struttura pirrolidinica
Diversi derivati pirrolidinici esibiscono attività farmacologica. Ad esempio, (a) enalapril inibitore dell’enzima di
conversione da angiotensina I a II, cioè ACE inibitore, (b) sulpiride, antispasmodico, antiemetico e antipsicotico,
(c) sultopride, antiemetico e antidepressivo, (d) captopril, antipertensivo, ACE inibitore, (e) fosinopril,
antipertensivo, ACE inibitore, (f) prociclidina, antiparkinsoniano, (g) lisinopril, inibitore dell’enzima di
conversione dell’angiotensina, (h) ramipril, antipertensivo, ACE inibitore, (i) piracetam, cerebrostimolante:
CH3CH2 O
C
O
CH3
N
H
C
N
O
O
C
H
N
O
COOH
O
N
CH3
CH2 NH C
N
CH3
C2H5
O
H3C
SO2NH2
S
O
H3CO
sulpiride
enalapril
sultopride
N
O
COOH
C
O
SH
CH3
H3C
O
C
P
O
N
C
COOH
N
CH3 O
O
O
CH2 CO NH2
CH3
captopril
fosinopril
COOH
NH2
N
N
H
C
OH
piracetam
C
N
O
lisinopril
C
C
H
N
OCH2CH3
HN
N
CO2H
COOH
H
prociclidina
CH3
O
O
CH2
H2C
Ramipril
O
CH2 CO NH2
Piracetam
Farmaci a struttura pirrolica
CH2 COOH
O
C
N
H
CH3
H3C
CH3
N
N
H3C
CH3
F
OH
Cl
OH
clopirac
COOH
C
N
O
CH3
C
CH2COOH
COOH
N
O
Ketorolac
Tolmetin
atorvastatina
Sintesi del tolmetin
La reazione di Mannich dell’1-metilpirrolo con formaldeide e dimetilammina dà il 2-dimetilamminometil-1-metilpirrolo
CH3I
N
HN(CH3)2
CH2O
N
CH3
CH2N(CH3)2
NaCN
in eccesso
N
CH3
CH3
AlCl3
C
O
Cl
I
H3C
CH2CN
CH3
2
1
H3C
N
CH2N(CH3)3
3
H3C
1. NaOH, H2O
C
N
O
CH3
CH2CN
2. H
C
N
O
CH3
tolmetin
CH2COOH
Sintesi di clopirac
CH2 N(CH3)2
NH2
H2C
H3C C
H3C
C
O O
CH3
N
CH2
HN(CH3)2
CH3
O
H3C
N
CH3
CH2
Cl
5
Cl
6
Cl
CH2
CH2 N
CH2 N(CH3)2
7
I
CH3
CH3
H3C
N
CH3
CH3I
H3C
N
in eccesso
Cl
Cl
7
8
CH3
CH2 COOH
CH2 CN
NaCN
H3C
N
CH3
1. NaOH, H2O
2. H
H3C
N
Cl
Cl
9
clopirac
CH3
H2 O
Sintesi della prociclidina
1. Preparazione della base di Mannich da acetofenone, formaldeide e pirrolidina:
C
CH3
H2CO
C CH2 CH2 N
HN
O
O
2. Trattamento della base di Mannich con bromuro di fenilmagnesio per ottenere l’alcool:
MgBr
C CH2 CH2 N
OH
C CH2 CH2 N
O
3. L’intermedio si sottopone a idrogenazione catalitica e la reazione si ferma dopo la riduzione di un solo anello
benzenico per ottenere prociclidina:
OH
C CH2 CH2 N
H2
PtO2
OH
C CH2 CH2 N
prociclidina
Si può anche trattare la base di Mannich con bromuro di cicloesilmagnesio per ottenere direttamente prociclidina:
MgBr
C CH2 CH2 N
OH
C CH2 CH2 N
O
prociclidina
3
4
5
2
O
O
O1
O
O
O
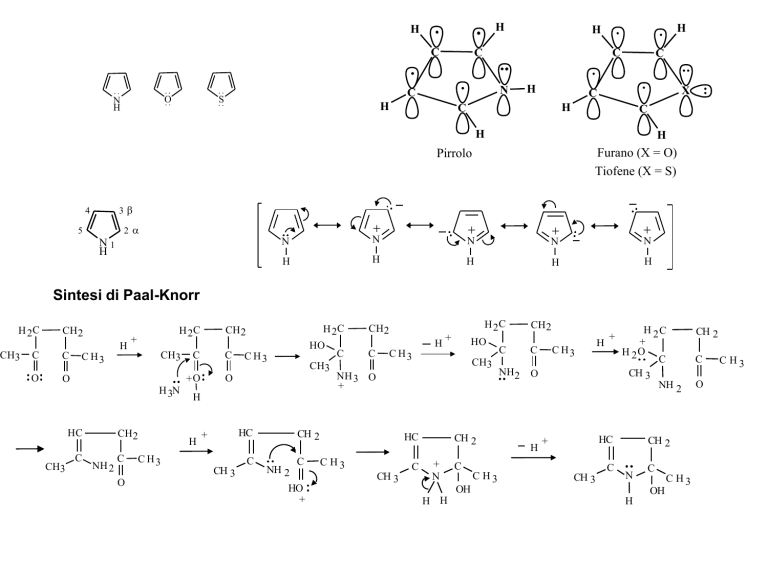
Sintesi di Paal-Knorr
H2C
CH3
C
HC
CH 2
C
O
O
CH 3
CH 3
C
CH2
C
O
O
H
HC
H+
CH 3
C
CH 3
CH 2
HC
OH
C
CH3
C
+
O
H
C
CH 3
CH3
CH 2 +
OH 2
C
O
CH 3
+
OH
C
CH 2
+
O
C
CH3
O
H
HC
HC
CH2
OH
C
CH 3
CH 3
H
H
C
HC
H 2O
CH3
H
H
HC
+
C+
C
O
CH 3
CH
C
CH3
C
O
CH 3
Sintesi di Feist-Benary
O
CH 3
O
C
CH
C
O
O
H2 O
O CH 2 CH 3
CH 3
C
CH
O CH 2 CH 3
C
Na +
H
+
OH Na
O
O
C 2 H 5O C
H
H
C
C
H 2C
C
O
CH3
C 2H 5 O C
O
C
Cl
O
C
H
Cl
C
O
32
31
+ H
H
H
+
C 2H 5 O C
+
CH3
H
C
OH
C
C
C
O
33
H
Cl
H
34
O
O
H
C 2H 5 O C
CH3
C
NaOH, H 2O
CH3
O
H H
C
C
C
C
O
H
H
C 2H 5 O C
OH
C
C
OH
+
Cl
C
H
CH3
O
34
Cl
CH 2
35
O
O
H
C 2H 5 O C
C
C
C
CH3
O
OH
CH 2
H
+
O
H
C 2H 5 O C
C
C
+
OH2
C 2H 5 O C
H
C
C
+
C
CH3
O
CH 2
C
CH3
C
O
30
H
+
H3O
Sostituzioni elettrofile aromatiche del furano
O
O
NO 2
CCH3
+
H
O
CH3C
O
O
NO 2
O
H
O
O
CCH3
+
O
O
+
O
+ O
+
N O
O
O
CH3C
O
+
N O
NO 2
H
O
CH 3 C O
H
O
CH 3 C O
O
NO 2
H
O
H
N
NO 2
O
+ CH3C
+
N
O
H
O
+N
+
S
O
O
O
SO3
O
+
N
H
SO3
O
+
N
H
+
O
( CH3CO ) 2 O
O
H 3 PO 4
oppure
BF3
O
C
O
CH 3 +
CH3 C
OH
+
+
HCl
O
SO3H
+
N
H
Cl
Preparazione commerciale del furfurolo
CHO
CHOH
Idrolisi
Pentosani
HO
CHOH
H 3O
CHOH
+
HOHC
O
CHO
CH 2
H 2C
C
CHO
C
O
H 3O
HC
+
O
HC
CHO
NaOH
O
O
C
+
COO Na
O
CHO
O
H
C
O
C
+O
H
OH
C
H
O
CH 2 O
H 2C
C
O
O
CHO
H
CH
CHO
C
O
+
OH 2
H 2O
H+
O
CHO
CHO
+
CH2 OH
O
C
O
H
O
C
O
OH
O
C
O
H
O
OH +
CH
CHO
OH
H 2C
O
O
H 2O
O
O
OH
O
HC
+
CH
H
H
2
C
H 3O
O
HC
H 2C
O
H
CH 2
CHO
+
OH
C
CHO
H 2C
O
H
CH
H 2C
HOHC
O
H
CH
H 2C
OH
C
CHO
O
Furfurolo
O
H
HC
3 H 2O
CHO
HOHC
CH
H 2C
H 2O
HO
+
Aldopentosi
CH2OH
H 2C
H 3O
CHOH
CHOH
HOHC
OH
HO
C
O
O
+
O
CH 2OH
OH +
O
CH 2 O
Farmaci a struttura furanica
Esempi di farmaci a struttura furanica sono (a) ranitidina, antiulcera peptica, antagonista dei recettori H2, (b) furosemide,
diuretico, (c) nifuratel e furazolidone, chemioterapici, usati nel trattamento della tricomoniasi, (d) dantrolene, farmaco che
provoca il rilassamento muscolare, antispasmodico:
COOH
CH3
H3C
H
N
NO2
N
S
N
H
O
N
H
O
O
CH3
NH2
S
O
ranitidina
furosemide
CH2 S
O2N
Cl
CH
O
N
N
CH3
O
O
nifuratel
O
O2N
O
C
H
N
O
N
N
O
N
O
Furazolidone
H
N
O
O2N
Dantrolene
Sintesi della ranitidina
CH3
H3C
CH3
N
CH2OH
O
HSCH2CH2NH2
HCl
H3C
38
CH3
CH3
S
N
H3CS
NH2
O
NHCH3
H
H3C
SCH3
S
N
N
H
O
C
+
38
H
H2O
NH2
O
37
36
H3C
S
N
C
H
O
C
NHCH3
C
O
N
N
O
O
40
39
CH3
H3C
H
S
N
N
O
+ CH3SH
NHCH3
C
C
H
O
N
L’alcool 5-(dimetilammino)-furfurilico 36 si può preparare con
la reazione di Mannich:
O
ranitidina
CH3
H3C
N
CH3
O
H
CH2
O
41
CH2OH
H3C
H2O
N
O
36
CH2OH
Il furano presenta due strutture parzialmente ridotte, il 4,5-diidrofurano e il 2,5-diidrofurano.
3
4
2
5
3
4
2
5
O1
O1
Farmaci a struttura diidrofuranica
Esempi di farmaci a struttura diidrofuranica sono (a) rofecoxib, farmaco antinfiammatorio utilizzato nel
trattamento dell’osteoartrite e dell’artrite reumatoide. Inibisce selettivamente la cicloossigenasi-2 (COX-2) e riduce
gli effetti secondari gastrointestinali provocati da altri antinfiammatori, ad esempio l’aspirina, (b) griseofulvina,
antibiotico usato per il trattamento delle infezioni da funghi, antimicotico per uso dermatologico:
CH3
O
S
O
O
H3C
O
O
Rofecoxib
CH3
CH3
O O
O
O
O
Cl
H3C
Griseofulvina
TIOFENI
3
4
2
5
S
S
S1
S
S
S
Sintesi di Paal dei tiofeni
H2C
R
C
O
CH 2
O
C
H2C
P2 S5
R
calore
R
C
O
S
52
H
CH 2
C
R
C
R C
CH2
O
C
SH
R
54
53
H
H
C
H
H
C
H
C
OH
R C
C
S
C
C
O
O
C 2H 5 ONa
C 2H 5 OH
S
CH2 COOEt
C 6H 5 C
C C
C 6H5
EtOOC
C
C
C
C
S
C
C 6H 5
HC
+
OH 2
R
R
CH
C
C
S
55
C 6H5
+
EtOOCCH2
+
C
S
H
Sintesi di Hinsberg
C 6H5
R C
R
H
C
C 6H5
+
COO Na
HC
H 2S
Ba(OH)2
C 6H5
CH
C
C
S
C 6H5
+
+ H3O
R
Nitrazione
NO2
O
CH3C
S
O
NO2
10 °C
NO2
S
S
95%
5%
Solfonazione
H2SO4 95%
SO3H
S
S
Acilazione
O
(CH3CO)2O
S
H3PO4
S
COCH3
CH3C
OH
Farmaci a struttura tiofenica
Diversi derivati del tiofene sono farmacologicamente attivi come (a) ticlopidina e clopidogrel che inibiscono
l’aggregazione piastrinica, (b) tinoridina, analgesico e antinfiammatorio, (c) l’antipsicotico olanzapina con l’anello
tiofenico condensato con l’anello 1,5-benzodiazepinico,
O
N
H2
C
S
Cl
N
C
OCH3
Cl
CH
S
ticlopidina
clopidogrel
H
N
H3C
S
CH3
O
O
C
N
N
H2N
S
tinoridina
N
C
H2
N
olanzapina
CH3












