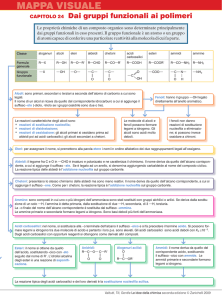
Propedeutica Biochimica
Acidi carbossilici e loro derivati
Si possono ulteriormente suddividere in:
1)
2)
3)
4)
5)
Mocarbossilici alifatici saturi
Monocarbossilici alifatici insaturi
Acidi dicarbossilici saturi
Acidi bi- e policarbossilici insaturi
Acidi carbossilici aromatici
Acidi grassi
Propedeutica Biochimica
Nomenclatura
Le regole IUPAC consentono diversi sistemi di nomenclatura a seconda della complessità
della molecola.
Gli acidi carbossilici che derivano dagli alcani per sostituzione del gr.metilico con il gr.
Carbossilico, vengono denominati sostituendo la –o del nome dell’alcano con il suffisso –oico il
HCOOHdal termine acido.
Acido formico (ac. metanoico)
tutto preceduto
CHdel
Acido
acetico (ac.
etanoico)
3COOH
Il carbonio
gr.carbossilico viene sempre
numerato
come
C1.
CH3CH2COOH
Ac. propionico (ac. propanoico)
CH3CH2CH2COOH
Ac. butirrico (ac. butanoico)
HOOCCOOH
Ac. ossalico (ac. etandioico)
HOOCCH2COOH
Ac. malonico (ac. propandioico)
Poiché gli acidi
carbossilici
sono stati traAc.
le molecole
isolate e purificate, le
HOOCCH
succinicoper
(ac.prime
butandioico)
2CH2COOH
regole IUPAC permettono molte eccezioni nell’uso di nomi comuni.
H2C=CHCOOH
Ac. acrilico (ac. propenoico)
Propedeutica Biochimica
I composti che possiedono il gruppo carbossilico legato ad un anello, sono
denominati utilizzando il suffisso –carbossilico legato al nome del composto
chimico, il tutto preceduto dal termine acido
Diffusione, struttura e proprietà degli acidi carbossilici
Importanza fondamentale in natura. L’acido colico, che è un acido carbossilico costituito da
quattro cicloalcani fusi è il costituente principale della bile epatica, e gli acidi alifatici a
catena lunga come l’acido oleico, sono precursori importanti di grassi e altre sostanze.
L’aceto è costituito da una soluzione diluita di acido acetico
Propedeutica Biochimica
Il gruppo carbossilico è caratterizzato dal doppio legame tra C e O, dove il primo è
sicuramente ibridato sp2 .
In soluzione le molecole degli acidi carbossilici formano legami H, che ha un marcato
effetto sulla temperatura di ebollizione: a parità di peso molecolare, gli acidi
carbossilici bollono a temperature maggiori dei rispettivi alcani.
Acidità degli acidi carbossilici
Sono molecole ovviamente acide che reagiscono con basi forti come l’idrossido di sodio
per dare i rispettivi Sali dei metalli, detti carbossilati.
Sono acidi molto più forti degli alcoli che pur hanno un gruppo –OH, perché lo ione
carbossilato è molto più stabile per risonanza
La carica negativa è ugualmente dispersa sui due atomi di ossigeno, quindi ogni atomo di
ossigeno dello ione carbossilato ne porta solo metà.
Propedeutica Biochimica
Un gruppo accettore di elettroni legato al carbossile attirerà gli elettroni verso di se,
contribuendo alla stabilizzazione della carica negativa sull’anione e aumentando così l’acidità.
Un gruppo donatore avrà l’effetto opposto.
Propedeutica Biochimica
Reazioni degli acidi carbossilici
1) Riduzione: trasformazione degli acidi in alcoli
Acido carbossilico → alcol primario
2) Trasformazione degli acidi in esteri
Possono essere sintetizzati per mezzo di una reazione di sostituzione nucleofila acilica
tra un acido carbossilico e un alcol con rilascio di acqua
Propedeutica Biochimica
Esteri
Sono i composti di maggior importanza e diffusione in natura. Diversi esteri a basso peso
molecolare sono liquidi profumati responsabili della fragranza di frutti e fiori. Inoltre il
legame estereo è presente nei grassi animali ed in altre molecole di importanza biologica.
Nomenclatura
La nomenclatura è simile a quella dei sali: prima si mette il nome della componente acida
cambiando il suffisso –ico con il suffisso –ato, poi quello del radicale R del gruppo -OR
Propedeutica Biochimica
Reazioni degli esteri
1)
2)
3) Riduzione degli esteri in alcoli primari
Propedeutica Biochimica
Ammidi
La nomenclatura prevede l’uso della radice dell’acido carbossilico da cui deriva con
aggiunta del suffisso -ammide
Propedeutica Biochimica
Ammine
Sono composti organici derivati dall’ammonica.
Possono essere classificate in primarie RNH2, secondarie R2NH o terziarie R3N a
seconda del numero di sostituenti legati all’azoto
1)
Esistono anche composti che presentano quattro gruppi organici legati all’atomo di azoto, ma
in questo caso è presente su N una carica +: Sali di ammonio quaternario
Possono essere sia alchil- che aril- sostituite
Nomenclatura
2)
Le ammine primarie possono essere denominate nel sistema IUPAC in due modi diversi;per
quelle più semplici, viene aggiunto il suffisso –ammina al nome del sostituente organico.
Le ammine che presentano più di un gruppo funzionale vengono denominate considerando il
gr. –NH2 come un sostituente amminico della molecola
Propedeutica Biochimica
Le ammine secondarie e terziarie simmetriche vengono denominate con l’aggiunta del
prefisso di-, tri- al gruppo alchilico
Le ammine secondarie e terziarie asimmetriche vengono denominate come ammine primarie
N-sostituite. Il gruppo organico più grande è considerato come catena principale mentre gli
altri gruppi sono considerati come N-sostituenti
Propedeutica Biochimica
Le ammine eterocicliche sono composti in cui l’azoto si trova all’interno di un anello. Tali
ammine sono abbastanza comuni e ogni diverso sistema eterocilcico presenta un nome
proprio. In tutti i casi si considera che l’atomo di azoto occupi la posizione 1.
Analogo
eterociclico del
benzene, ma il
doppietto
elettronico non fa
parte dell’anello
aromatico:
piridossale e
piridossina , vit.B6
È aromatico (6 e-), non è
basico
La fusione di quattro
anelli è la base del
gruppo prostetico
dell’emoglobina e dei
citocromi
Struttura Base di due amminoacidi
Propedeutica Biochimica
Proprietà delle Ammine
I legami presenti nelle ammine sono simili a quelli dell’ammoniaca. L’atomo di azoto presenta
ibridazione sp3. Il quarto orbitale ibrido ospita il doppietto non condiviso.
Sono composti fortemente polari perciò presentano punti di ebollizione alti. Le ammine con
meno di 5 atomi di carboni sono ben solubili in acqua.
Un’altra loro caratteristica è l’odore, la 1,4-butandiammina che ha nome comune putrescina
ne è un esempio piuttosto eloquente.
La chimica delle ammine è strettamente legata alla presenza del doppietto non condiviso,
che le rende dei composti basici e nucleofili.
Sono molto più basiche degli alcoli, degli eteri e dell’acqua
Propedeutica Biochimica
Reazioni delle ammine