AMMINOACIDI
PEPTIDI
PROTEINE
Classificazione degli
Amminoacidi
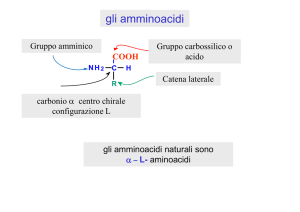
Anche se il nome implica la presenza di un
gruppo amminico —NH2 e di un gruppo
carbossilico —CO2H, in realtà sono presenti i
gruppi —NH3+ and —CO2–.
Sono classificati come a, b, g, ecc. ammino acidi
in funzione del carbonio che porta la funzione
ammonio
+
NH3
a
CO2–
+
–
H3NCH2CH2CO2
b
+
–
H3NCH2CH2CH2CO2
g
un a-amminoacido intermedio
nella biosintesi dell’etilene
un b-amminoacido componente
del coenzima A
un g-amminoaacido coinvolto
nella trasmissione dell’impulso
nervoso
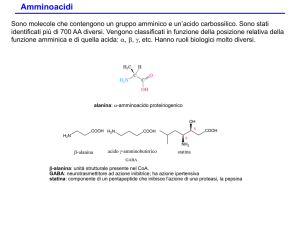
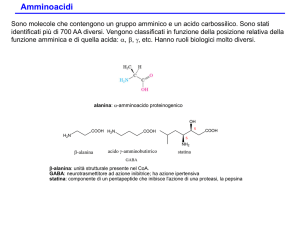
Sono noti 700 amminoacidi naturali
20 ammino acidi, tutti a-amminoacidi, sono i
componenti delle proteine.
I 20 amminoacidi differiscono per il gruppo
legato al carbonio a.
H
+
H3N
C
R
O
C
O
–
H
+
H3N
Glicina
(Gly or G)
H
+
H3N
C
C
O
C
O
–
H
O
C
CH3
Alanina
(Ala or A)
H
O
–
+
H3N
C
O
C
O
CH(CH3)2
Valina
(Val or V)
–
H
+
H3N
C
O
H
O
C
–
+
H3N
CH2CH(CH3)2
Leucina
(Leu or L)
C
O
–
CH3CHCH2CH3
H
+
H3N
C
O
C
O
C
CH3SCH2CH2
Metionina
(Met or M)
O
–
Isoleucina
(Ile or I)
H
+
H2N
C
O
C
CH2
H2C
C
H2
–
O
H
+
H3N
C
O
C
CH2
Prolina
(Pro or P)
Fenilalanina
(Phe or F)
O
–
H
+
H3N
C
CH2
O
C
H
O
–
+
H3N
C
O
C
H2NCCH2
O
N
H
Triptofano
(Trp or W)
Asparagina
(Asn or N)
O
–
H
+
H3N
C
O
C
H
O
+
H3N
–
H2NCCH2CH2
(Gln or Q)
C
O
–
CH2OH
O
Glutammina
C
O
Serina
H
+
H3N
C
O
C
CH3CHOH
Treonina
(Thr or T)
O
–
(Ser or S)
H
+
H3N
–
C
O
C
H
O
–
OCCH2
O
Acido Aspartico
(Asp or D)
+
H3N
–
C
O
C
O
–
OCCH2CH2
O
Acido Glutammico
(Glu or E)
H
+
H3N
C
O
C
O
–
CH2
H
H
+
H3N
C
O
C
CH2
OH
Tirosina
(Tyr or Y)
N
NH
Istidina
(His or H)
+
H3N
O
–
C
O
C
CH2SH
Cisteina
(Cys or C)
O
–
H
+
H3N
C
O
C
H
O
–
+
H3N
+
CH2CH2CH2CH2NH3
Lisina
(Lys or K)
C
O
C
O
–
CH2CH2CH2NHCNH2
Arginina
(Arg or R)
+ NH2
Stereochimica degli
Amminoacidi
La Glicina è achirale. Tutti gli altri ammino
acidi presenti nelle proteine hanno
L-configurazione al carbonio a.
–
CO2
+
H3N
H
R
Proprietà Acido-Base degli
Amminoacidi
Proprietà della Glicina
Alto punto di fusione (si decompone a 233°C)
Solubilità in acqua
consistente con
•• O ••
+
H3NCH2C
•• •–
O•
••
zwitterione o ione dipolare
•• O ••
••
H2NCH2C
••
OH
••
In soluzione fortemente acida, diciamo a pH =
1, la glicina esiste nella forma protonata.
•• O ••
+
H3NCH2C
••
OH
••
Se si innalza il pH per aggiunta di una base
quale protone sarà allontanato? Quello legato
all’azoto o all’ossigeno? Basta confrontare i pKa
Tipico ione
ammonio:
pKa ~9
•• O ••
+
H3NCH2C
••
OH
••
Tipico acido
carbossilico:
pKa ~5
La forma neutra più stabile della glicina è lo
ione dipolare
•• O ••
+
H3NCH2C
•• •–
O•
••
Il pKa sperimentale della glicina è 2.34.
L’acidità maggiore di quella di un tipico acido
carbossilico si giustifica con l’azione
elettronattrattrice stabilizzante del gruppo
ammonio.
Incrementando il pH si può allontanare il
protone legato all’azoto
•• O ••
+
H3NCH2C
•• •–
O•
••
HO
–
•• O ••
••
H2NCH2C
Il pKa per questo protone è 9.60.
•• •–
O•
••
Punto isoelettrico pI
•• O ••
+
H3NCH2C
••
OH
••
pKa = 2.34
•• O ••
+
H3NCH2C
•• •–
O•
••
pKa = 9.60
•• O ••
••
H2NCH2C
•• •–
O•
••
Il pH a cui la
concentrazione dello
zwitterione è massima
è chiamato punto
isoelettrico. Il pI della
glicina è 5,97.
Questo valore è la
media dei pKa.
Al pI le concentrazioni
delle forme anionica e
cationica sono uguali
Amminoacidi con catena neutra
H
Glicina
Alanina
+
H3N
+
H3 N
O
C
C
H
H
O
C
CH3
C
–
pKa1 = 2.34
pKa2 = 9.60
pI = 5.97
–
pKa1 = 2.34
pKa2 = 9.69
pI = 6.00
O
O
H
Valina
+
H3N
C
O
C
O
–
pKa1 = 2.32
pKa2 = 9.62
pI = 5.96
CH(CH3)2
H
Leucina
Isoleucina
O
+
H3N
C
+
H3N
CH2CH(CH3)2
H O
–
C C O
C
O
–
CH3CHCH2CH3
pKa1 = 2.36
pKa2 = 9.60
pI = 5.98
pKa1 = 2.36
pKa2 = 9.60
pI = 5.98
O
H
Metionina
+
H3N
C
C
O
–
pKa1 = 2.28
pKa2 = 9.21
pI = 5.74
CH3SCH2CH2
H
Prolina
+
H2N
C
O
C
CH2
H2C
C
H2
O
–
pKa1 = 1.99
pKa2 = 10.60
pI = 6.30
O
H
Fenilalanina
+
H3N
C
C
–
pKa1 = 1.83
pKa2 = 9.13
pI = 5.48
–
pKa1 = 2.09
pKa2 = 9.10
pI = 5.60
O
CH2
H
Treonina
+
H3N
C
O
C
CH3CHOH
O
O
H
Triptofano
+
H3N
C
C
–
pKa1 = 2.83
pKa2 = 9.39
pI = 5.89
–
pKa1 = 2.21
pKa2 = 9.15
pI = 5.68
O
CH2
N
H
H
Serina
+
H3N
C
O
C
CH2OH
O
H
Glutammina
+
H3N
C
O
C
–
pKa1 = 2.17
pKa2 = 9.13
pI = 5.65
–
pKa1 = 2.02
pKa2 = 8.80
pI = 5.41
O
H2NCCH2CH2
O
H
Asparagina
+
H3N
C
H2NCCH2
O
O
C
O
Amminoacidi con catena ionizzabile
H
+
Acido aspartico H3N
–
C
OCCH2
O
O
C
O
–
pKa1 =
pKa2 =
pKa3 =
pI =
1.88
3.65
9.60
2.77
O
H
+
Acido glutammico H3N
–
Tirosina
C
C
O
OCCH2CH2
O
+
H3N
H
C
CH2
OH
–
pKa1 =
pKa2 =
pKa3 =
pI =
2.19
4.25
9.67
3.22
O
C
O
–
pKa1 =
pKa2 =
pKa3 =
pI =
2.20
9.11
10.07
5.66
H
Tyrosine
+
H3N
C
CH2
OH
O
C
O
–
pKa1 =
pKa2 =
pKa3 =
pI =
2.20
9.11
10.07
5.66
O
H
Cisteina
+
H3N
C
C
O
–
CH2SH
H
+
H3N
Lisina
C
O
C
O
–
+
CH2CH2CH2CH2NH3
pKa1 =
pKa2 =
pKa3 =
pI =
1.96
8.18
10.28
5.07
pKa1 =
pKa2 =
pKa3 =
pI =
2.18
8.95
10.53
9.74
O
H
+
H3N
Arginina
C
C
O
–
CH2CH2CH2NHCNH2
pKa1 =
pKa2 =
pKa3 =
pI =
2.17
9.04
12.48
10.76
pKa1 =
pKa2 =
pKa3 =
pI =
1.82
6.00
9.17
7.59
+ NH2
H
Istidina
+
H3N
C
CH2
N
NH
O
C
O
–
Curva di titolazione per
l’Alanina
Sintesi degli Amminoacidi
Dagli acidi a-alogeno carbossilici
O
CH3CHCOH + 2NH3
Br
H2O
O
–
CH3CHCO + NH4Br
+NH3
(65-70%)
Sintesi di Strecker
O
CH3CH
NH4Cl
NaCN
CH3CHC
N
NH2
1. H2O, HCl, calore
2. HO–
O
–
CH3CHCO
+NH3
(52-60%)
Sintesi acetoammidomalonica
O O
CH3CH2OCCCOCH2CH3
H
CH3CNH
O
1. NaOCH2CH3
2. C6H5CH2Cl
O O
CH3CH2OCCCOCH2CH3
CH3CNH
O
CH2C6H5
(90%)
O
HCCOH
(65%)
CH2C6H5
H3 N
+
HBr, H2O, calore
O O
CH3CH2OCCCOCH2CH3
CH3CNH
O
CH2C6H5
Reazioni degli
Amminoacidi
Acilazione del gruppo amminico
Il gruppo amminico con un agente acilante
viene trasformato in ammide.
O
O O
+
– +
H3NCH2CO
CH3COCCH3
O
O
CH3CNHCH2COH
(89-92%)
Esterificazione del gruppo carbossilico
O
+
–
H3NCHCO
CH3
+ CH3CH2OH
HCl
O
Cl
–
+
H3NCHCOCH2CH3
CH3
(90-95%)
Test alla Ninidrina
O
O
OH
+
+ H3NCHCO–
OH
R
O
O
O–
O
RCH + CO2 + H2O +
N
O
O
Risoluzione enzimatica degli amminoacidi
COO
COO
H3N
H
H
R
Enantiomeri
L (S) R
-
Ac2O
H
R
H3C
COOH
H
NHAc
R
O
D (S)-
Ac2O
COOH
AcHN
NH3
= Ac2O
O
2
COOH
AcHN
COOH
H
H
R
NHAc
R
acilasi
COOH
COOH
H2 N
H
R
H
NHAc
R
Risoluzione chimica degli amminoacidi
COO
COO
H3N
H
H
R
Enantiomeri
L (S)- R
Ac2O
H
R
H3C
COOH
H
NHAc
R
O
D (S)-
Ac2O
COOH
AcHN
NH3
= Ac2O
O
2
*
R NH2
COO
AcHN
H
R
*
R NH2
R*-NH3
COO
NHAc R*-NH3
H
R
Sali
diasteroisomerici
NaOH, H2O
separazione
COO
COO
H3N
H
R
H
NH3
R
Peptidi
Peptidi
I peptidi sono composti in cui un legame
ammidico (legame peptidico) lega il gruppo
amminico di un a-ammino acido con il gruppo
carbossilico di un altro.
Alanina e Glicina
H
+
H3N
C
O
C
H
–
O
+
H3N
CH3
C
–
O
H
H
+
H3N
C
O
C
CH3
H
O
C
N
C
H
H
O
C
–
O
dipeptide
Alanilglicina
H
+
H3N
N-terminale
C
CH3
H
O
C
N
C
H
H
Ala—Gly
AG
O
C
–
O
C-terminale
H
+
H3N
C
C
CH3
H
+
H3N
C
H
H
O
N
C
H
H
H
O
C
N
C
H
CH3
O
C
–
O
Alanilglicina
Ala—Gly
AG
–
O
Glicilalanina
Gly—Ala
GA
O
C
Isomeri costituzionali
Alanilglicina
H
+
H3N
C
CH3
H
O
C
N
C
H
H
O
C
–
O
Il legame
peptidico ha
geometria
planare.
H H
N
H3C
H2N
COOH
H H
N
H2N
OH C
3
H
O
N
H2N
O
H
N
H H
O
R H
Ala-Gly
H H
O
H3C
DIPEPTIDE
COOH
H
TRIPEPTIDE
R H
H
O
N
N
H R
H
O
H R
PENTAPEPTIDE
R
N
H
Ala-Gly-Ala
H
COOH
NH2Ala-Gly-PheCOOH
H
Ala + Gly + Phe
H2O
NH2Ala-Gly-PheCOOH
NH2Ala-Phe-GlyCOOH
NH2Gly-Ala-PheCOOH
NH2Gly-Phe-AlaCOOH
NH2Phe-Gly-AlaCOOH
NH2Phe-Ala-GlyCOOH
TETRAPEPTIDE
24 SEQUENZE (ISOMERI)
POLIPEPTIDE INFINITE SEQUENZE
Determinazione della
struttura di un Peptide
Struttura primaria
La struttura primaria è data dalla sequenza di
amminoacidi e dai ponti disolfuro
Strategia (Sanger)
Premio Nobel per la Chimica
1958 e 1980
Sequenza dei peptidi
1. Determinazione degli amminoacidi
presenti e loro rapporto molare.
2. Scissione del peptide in frammenti e
determinazione della composizione
amminoacilica dei frammenti.
3. Identificazione degli amminoacidi Nterminale e C-terminale nel peptide e nei
frammenti.
4. Organizzzione delle informazioni fino a
defenire la sequenza.
L’idrolisi acida del peptide peptide (6 M HCl, 24
hr) porta alla miscela degli amminoacidi.
La miscela può essere smistata nei suoi
componenti mediante cromatografia a scambio
ionico, che dipende dal pI degli amminoacidi.
Gli amminoacidi sono evidenziati mediante
ninidrina.
Un analizzatore automatico richiede solo10-5 10-7 g di peptide.
L’idrolisi acida scinde tutti i legami peptidici, per
ottenere frammenti bisogna condurre un’idrolisi
parziale mediante enzimi.
Carbossipeptidasi
La carbossipeptidasi è un enzima proteolitico che
catalizza l’idrolisi delle proteine scindendo
selettivamente il legame peptidico che coinvolge
l’amminoacido C-terminale.
O
O
+
H3NCHC
R
proteina
C
O
–
NHCHCO
R
Tripsina
La tripsina scinde selettivamente il legame peptidico
Che impegna il gruppo carbossilico della lisina o
dell’arginina.
O
O
O
NHCHC
NHCHC
NHCHC
R
R'
R"
lisina o arginina
Chimotripsina
La chimotripsina scinde selettivamente i legami
Peptidici che impegnano il gruppo carbossilico di
amminoacidi aromatici.
O
O
O
NHCHC
NHCHC
NHCHC
R
R'
R"
fenilalanina, tirosina, triptofano
Amminoacido N-terminale
La sequenza amminoacilica è ambigua fino a
che non si definiscono gli amminoacidi N- e
C- terminali.
L’amminoacido C-terminale può essere
determinato mediante idrolisi enzimatica con
carbossipeptidasi.
E’ possibile determinare l’amminoacido Nterminale sfruttando il maggior carattere
nucleofilo dedll’N terminale rispetto agli N
ammidici.
Metodo di Sanger
Il reagente è l’1-fluoro-2,4-dinitrobenzene.
L’1-fluoro-2,4-dinitrobenzene reagisce come
nucleofilo nella sostituzione aromatica.
NO2
O2N
O
O
F + H2NCHC
NHCHC
NHCH2C
O2N
O
O
O
NHCHC
NHCHC
NHCH2C
CH(CH3)2 CH2C6H5
–
NHCHCO
CH3
CH(CH3)2 CH2C6H5
NO2
O
O
O
–
NHCHCO
CH3
NO2
O2N
O
NHCHC
O
NHCHC
O
O
NHCH2C
–
NHCHCO
CH3
CH(CH3)2 CH2C6H5
H 3 O+
NO2
O2N
O
O
O
O
+
+
+
NHCHCOH + H3NCHCO– + H3NCH2CO– + H3NCHCO–
CH(CH3)2
CH2C6H5
CH3
Insulina
L’insulina è un polipeptide costituito da 51
amminoacidi.
Ha due catene: quella A formata da 21
amminoacidi e quella B formata da 30
amminoacidi.
FVNQHLCGSHLVGALYLVCGERGFFYTPKA
Catena B
La fenilalanina (F) è N terminale.
FVNQHLCGSHL
SHLV
LVGA
VGAL
ALY
YLVC
VCGERGF
GFFYTPK
YTPKA
Struttura Primaria dell’insulina
bovina
N terminale
A
S
S
C terminale
A
15
5
E Q C
V
C S L Y Q L
I
F
E N
20
C
V
YC
A S
S
10
N
S
S
H
L
N Q
V
S
C
F
G S H L V G A L Y L V
5
C
15
G 20
10
N terminale
E
B
G R
F
F
Y
K P T
A
C terminale
25
30
B
Degradazione di Edman
1. Metodo per la determinazione
dell’amminoacido N-terminale.
2. Può essere utilizzato in sequenza per
determinare i primi 20 amminoacidi a partire
dall’N-terminale.
3. Richiede campioni di solo 10-10 g.
4. E’ stato automatizzato.
N
C
S
Fenil isotiocianato
O
C6H5N
C
S
+
+ H3NCHC
NH
peptide
R
S
O
C6H5NHCNHCHC
R
NH
peptide
S
O
C6H5NHCNHCHC
peptide
NH
R
HCl (anidro)
S
C6H5NH
C
C
+
N
CH
R
tiazolone
O
+
H3N
peptide
Il tioazolone isomerizza
a feniltioidantoina che
viene identificata mentre
il residuo peptidico può
essere sottoposto ad
una seconda
degradazione di Edman.
C6H5
S
N
C
C
O
CH
HN
R
S
C6H5NH
C
C
N
CH
R
O
+
+
H3N
peptide
Meccanismo della
Degradazione di Edman
Phe
H3C
N C S
H2N
H H
N
pH 9
S
N C
H2N
H H
N
COOH
H
Phe
O
H
N
H H
O
H
N
H H
O
H3C
O
COOH
H
Phe
S
H
N C
H3C
HN
H H
N
O
O
H H
H
N
H
COOH
Phe
H H
N
S H3C
H
N C
AcOH
N
N
H2N
O
N
N
H
N
COOH
H
CH3
H
S
HO
H
N
OH H H
H
H
N
OH
COOH
CH2Phe
O
H
COOH
CH2Phe
H
N
N
S
O
CH3
H
Struttura Secondaria
delle Proteine
Struttura Primaria =
sequenza di
amminoacidi e
ponti disolfuro.
Struttura
secondaria =
relazione
conformazionale fra
amminoacidi
spazialmente vicini:
a elica e foglietto
b pieghettato
La struttura b è molto comune con proteine
costituite da amminoacidi con piccole catene
laterali (glicina, alanina, serina).
La fibroina (principale proteina della seta) è
caratterizzata dalla sequenza ripetuta:
—Gly—Ser—Gly—Ala—Gly—Ala
Le catene adiacenti sono antiparallele
Legami idrogeno fra N—H e O=C delle
catene
a Elica
a elica di una proteina formata
solo da L-alanina.
L’elica è destrorsa con 3.6
amminoacidi per giro.
I legami idrogeno sono interni
alla catena.
Proteine dei muscoli (miosina) e
della lana(a-cheratina) hanno
una struttura a-elica.
Carboxypeptidase
Disulfide bond
Zn2+
Arg-145
N-terminus
C-terminus
tube model
ribbon model
Sintesi dei peptidi
Il problema della sintesi dei peptidi è legato al
fatto che devono reagire fra loro molecole
bifunzionali per cui per ottenere la voluta
sequenza non basta mettere insieme i due
amminoacidi.
Se ad esempio volendo la sequenza Phe—Gly
mettessimo insieme fenil alanina e glicina
otterremmo i quattro dipeptidi:
Phe—Phe Gly—Gly Phe—Gly Gly—Phe
Bisogna proteggere il gruppo anmminco
dell’amminoacido che dovrà essere quello Nterminale ed il gruppo carbossilico di quello che
sarà C-terminale
N-Protetto
fenilalanina
C-Protetto
glicina
O
X
O
NHCHCOH
H2NCH2C
CH2C6H5
X
O
O
NHCHC
NHCH2C
CH2C6H5
Y
Y
X
O
O
NHCHC
NHCH2C
Y
CH2C6H5
O
+
H3NCHC
O
–
NHCH2CO
CH2C6H5
Phe-Gly
Protezione gruppo amminico
Benzilossicarbonil cloruro
O
O
CH2OCCl
+
+
–
H3NCHCO
CH2C6H5
1. NaOH, H2O
2. H+
O
CH2OC
O
NHCHCOH
CH2C6H5
(82-87%)
O
CH2OC
O
NHCHCOH
CH2C6H5
O
abbreviato:
ZNHCHCOH
o
Z-Phe
CH2C6H5
Rimozione:
a) idrogenolisi
b) scissione con HBr in acido acetico
O
CH2OC
O
NHCHCNHCH2CO2CH2CH3
CH2C6H5
H2, Pd
O
CH3
CO2
H2NCHCNHCH2CO2CH2CH3
CH2C6H5
(100%)
O
CH2OC
O
NHCHCNHCH2CO2CH2CH3
CH2C6H5
HBr
O
CH2Br
CO2
+
H3NCHCNHCH2CO2CH2CH3
–
Br
CH2C6H5
(82%)
tert-Butossicarbonilazide
O
(CH3)3COC
O
NHCHCOH
CH2C6H5
abbreviato:
O
BocNHCHCOH
CH2C6H5
o Boc-Phe
O
(CH3)3COC
O
NHCHCNHCH2CO2CH2CH3
CH2C6H5
HBr
O
H3C
C
H3C
CH2
CO2
+
H3NCHCNHCH2CO2CH2CH3
–
CH2C6H5 Br
(86%)
Protezione del gruppo Carbossilico
Deprotezione degli esteri avviene per idrolisi
basica.
Gli esteri benzilici possono essere subire
idrogenolisi.
Il gruppo carbossilico viene protetto come
estere.
O
O
C6H5CH2OC
O
NHCHCNHCH2COCH2C6H5
CH2C6H5
H2, Pd
O
C6H5CH3
CO2
+
–
H3NCHCNHCH2CO
CH2C6H5
(87%)
CH3C6H5
Formazione del legame peptidico
DCC
O
O
ZNHCHCOH
+ H2NCH2COCH2CH3
CH2C6H5
DCC, cloroformio
O
ZNHCHC
O
NHCH2COCH2CH3
CH2C6H5
(83%)
O
+
ZNHCHCOH
C6H11N
C
CH2C6H5
H
C6H11N
O
C
C6H11N
OCCHNHZ
CH2C6H5
NC6H11
O
H
C6H11N
C
O +
ZNHCHC
O
NHCH2COCH2CH3
CH2C6H5
C6H11NH
O
H2NCH2COCH2CH3
H
C6H11N
O
C
C6H11N
OCCHNHZ
CH2C6H5
Estere attivo
O
O
ZNHCHCO
NO2 +
H2NCH2COCH2CH3
CH2C6H5
cloroformio
O
ZNHCHC
O
NHCH2COCH2CH3 + HO
CH2C6H5
(78%)
NO2
Sintesi in fase solida:
Merrifield
Premio Nobel in Chimica: 1984
Supporto
CH2
CH
CH2
CH
CH2
CH
Copolimero stirene divinilbenzene
CH2
CH
Supporto
CH
2
CH
CH2
CH
CH2
CH
CH2
CH
Trattando il polimero con ClCH2OCH3 e SnCl4 si
funzionalizzano alcuni anelli benzenici con ClCH2.
CH2
CH
CH2
CH
CH2
CH
CH2
CH2Cl
CH
CH2
CH
CH2
CH
CH2
CH
CH2
CH
O
–
BocNHCHCO
R
CH2Cl
CH2
CH
CH2
CH2
CH
O
BocNHCHCO
R
CH
CH2
CH2
CH
CH2
CH
CH2
O
CH
CH2
O
+
H3N peptide C NHCHC
R'
O
NHCHCO
R
CH
CH2
CH2
CH
CH2
CH
CH2
CH
CH2
CH
CH2
CH2Br
O
O
+
H3N peptide C NHCHC
R'
O
–
NHCHCO
R
CH