Amminoacidi
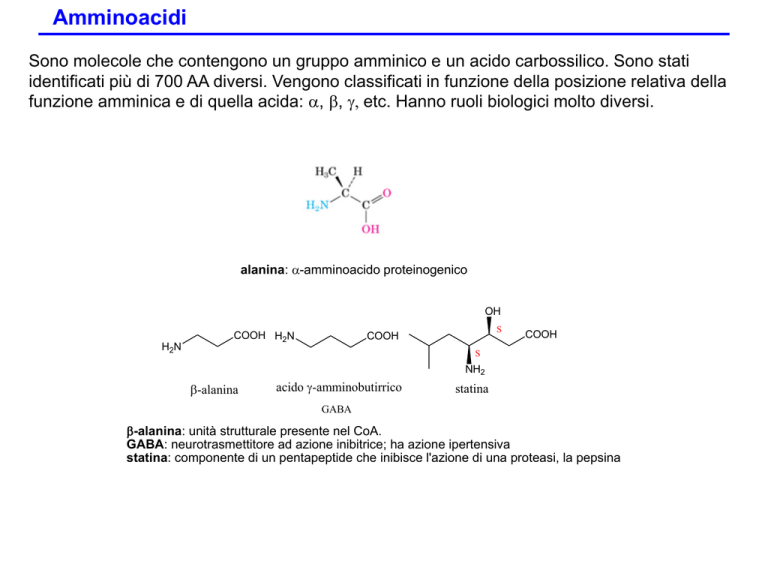
Sono molecole che contengono un gruppo amminico e un acido carbossilico. Sono stati
identificati più di 700 AA diversi. Vengono classificati in funzione della posizione relativa della
funzione amminica e di quella acida: a, b, g, etc. Hanno ruoli biologici molto diversi.
alanina: a-amminoacido proteinogenico
OH
H2N
COOH H2N
S
COOH
COOH
S
NH2
b-alanina
acido g-amminobutirrico
statina
GABA
b-alanina: unità strutturale presente nel CoA.
GABA: neurotrasmettitore ad azione inibitrice; ha azione ipertensiva
statina: componente di un pentapeptide che inibisce l'azione di una proteasi, la pepsina
Aminoacidi
A parte la glicina tutti gli amminoacidi proteinogenici sono chirali e, negli organismi
superiori, le proteine sono formate solo da amminoacidi della serie L.
Negli organismi inferiori (batteri) si trovano anche amminoacidi della serie D e
amminoacidi non chirali come l’AiB (acido a-amminoisobutirrico)
Aminoacidi
OH
H3N
O
H3N
O
O
pKa = 2.35 (4.76 HAc)
O
H3N
O
H2N
O
O
pKa = 9.78 (10.7 RNH3+)
Punto Isoelettrico (pI)
E’ il valore di pH al quale la carica netta di
una certa specie è zero.
Il pI è la media dei valori di pKa dei gruppi
carbossilico e ammonio.
(9.78+2.35)/2 = 6.06
Aminoacidi: istidina e arginina
pKa = 6.95
pKa = 6.10
N
N
H
imidazolo
NH
H2 N
H+
NH2
NH2
H2N
NH2
pKa = 13.6
TEA (trietil ammina) pKa = 10.75
Titolazioni di amminoacidi: ALANINA
Titolazioni di amminoacidi: Arginina
O
H3N
pKa1
OH
O
H3N
2.01
HN
HN
pKa2
O
O
H2N
9.04
HN
NH3
HN
pKa3
O
O
H2N
12.48
HN
NH3
HN
O
HN
NH3
pI = 10.7
HN
NH2
Titolazioni di amminoacidi: Acido Aspartico
O
H3N
O
OH
pKa1
OH
2.10
O
H3N
O
OH
pI = 2.98
pKa2
O
3.86
O
H3N
O
O
pKa3
O
9.82
O
H2N
O
O
O
Elettroforesi
Amminoacidi: reazioni
Reazioni del gruppo amminico:
• acilazione
• alchilazione
CH3I
H2N-CHR-COOH
(H3C)3N-CHR-COO
(eccesso)
- reazione
_
+
betaina
di Sanger
F
NH-CHR-COOH
O2N
O2N
+
H2N-CHR-COOH
NO2
+
NO2
- reazione di Edman
Ph-N=C=S
+
H2N-CHR-COOR'
Ph-NH-CS-NH-CHR-COOR'
HF
Amminoacidi: reazioni
Reazioni del gruppo carbossilico:
Formazione di esteri:
CH3OH
CH3OH
+
H3N-CHR-COOH
_
Cl
H2N-CHR-COOH
HCl
+
H3N-CHR-COOCH3
_
Cl
HCl
NaHCO3
H2N-CHR-COOCH3
H2O
NB: gli esteri degli a-amminoacidi sono instabili. Più stabili i loro cloridrati.
H
N
NH2
CO
CO2CH3
+
OC
H3CO2C
2 CH3OH
N
H
H2N
2,5-dichetopiperazina
Riduzione del gruppo estereo:
LAH
H2N-CHR-COOCH3
H2N-CHR-CH2OH
dietiletere
b-amminoalcol
+ CH3OH
Amminoacidi: reazioni
Reazione con la ninidrina
Amminoacidi: sintesi
Ammonolisi di acidi a-bromocarbossilici
Amminoacidi: sintesi
Sintesi di Gabriel
Amminoacidi: sintesi
Sintesi di Strecker
KCN, NH4Cl
Alchilazione della glicina N-funzionalizzata
1. LDA
Ph
Ph
H3O
2. RX
NCHRCO2Et
NCH2CO2Et
_
Ph
78 °C
Ph
( +_ )
+
_
+
H3NCHRCO2
( +_ )
Brucina (2,3-dimetossistricnina)
morfina
Amminoacidi: sintesi enantioselettiva
_
RCOCO2H
+
2
*
PhCHCH3NH2
_
H2O
R
N
ottic.attivo
+ *
H3NCHCH3Ph
CO2
R = CH3, CH2Ph, etc.
PH
*
CH3
ottic.attivo
Pd(OH)2/C/ H2
_
RCHNH2CO2
ottic.attivo
+
NH4
Pd/C/H2
etanolo
_ 2 PhCH CH
2
3
R
*
HN
_
+ *
CO2 H3NCHCH3Ph
*
PH
CH3
ottic.attivo
_
+
RCHNH3CO2
ottic.attivo
Ad es. utilizzando la (S)-(–)-1-fenetilammina, dopo la idrogenazione del doppio legame
imminico, si ottengono due diastereomeri salini in proporzioni diverse che possono essere separati
per cristallizzazione frazionata, sottoposti ad idrogenolisi per dare l'amminoacido che sarà
otticamente attivo.