Percorsi di chimica organica - Soluzioni degli esercizi del testo
CAPITOLO 14
1.
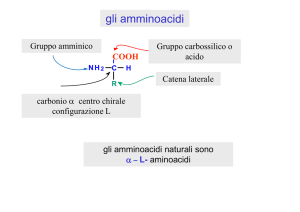
Il prefisso α negli α-amminoacidi sta ad indicare che il gruppo amminico, -NH2, si
trova sul carbonio alfa (carbonio legato al gruppo carbossilico).
2.
a) cisteina
b) fenilalanina
f) acido aspartico
3.
c) valina
g) glutammina
d) prolina
h) lisina
e) triptofano
i) alanina
l) glicina
a) Legame ammidico che si forma tra il gruppo carbossilico di un amminoacido e il
gruppo amminico in alfa di un altro amminoacido.
b) Amminoacidi che non possono essere sintetizzati dall’uomo e che vanno assunti con
la dieta
c) Molecola formata da due amminoacidi legati con legame peptidico.
4.
a) Configurazione degli amminoacidi chirali naturali, riferita alla l-gliceraldeide
COOH
CHO
HO
H
H2N
R
CH2OH
L-gliceraldeide
H
L-amminoacido
b) Ione dipolare o zwitterione è un sale interno. presenta contemporaneamente una
carica positiva e una carica negativa.
c) Valore di pH in corrispondenza del quale l’amminoacido esiste in forma
zwitterionica con carica complessiva uguale a zero.
5.
Perché possono comportarsi sia da acidi che da basi.
6.
Perché le cisteine formano tra loro ponti disolfuro che inducono il ripiegamento e
l’avvolgimento della catena peptidica (struttura terziaria).
Paolo De Maria - Percorsi di chimica organica © Zanichelli Editore
Percorsi di chimica organica - Soluzioni degli esercizi del testo
2
7.
COOH
(S) 4
H
1
H2N
CH2CHCH3
3
CH3
8.
COOH
COOH
a)
H2N
b)
H
H
CH2OH
CH2OH
COOH
c)
H2N
NH2
COOH
d)
H
H
NH2
CH2
CH2
OH
OH
9.
COOH
HN
10.
a)
CH3
H
CH COO + HCl
CH3
NH3
b)
CH3
CH COO + NaOH
NH3
CH COOH
NH3
CH3
CH COO
NH2
Paolo De Maria - Percorsi di chimica organica © Zanichelli Editore
Percorsi di chimica organica - Soluzioni degli esercizi del testo
11.
a)
b)
H3N CH2 COO
H3N
CH COO
CH2OH
c)
H3N
d)
CH COO
H3N
CH COO
CH2
CH2
NH
OH
12.
a)
NH3
b)
HOH2C
CHCOO
NH3
c)
CH2CH2CHCOO
HOH2C
+ NaOH
+ H2O
NH3
idrogeno più acido
CHCOO
+ H2O
NH2
idrogeni più acidi
(CH3)2CHCHCOO
(CH3)2CHCHCOOH + NaOH
NH3
d)
HOOC
CH2CH2CHCOOH + NaOH
HOOC
+ H2O
NH3
idrogeno più acido
H2N
H2N
C
NHCH2CH2CH2CHCOO
H2N
+ NaOH
C
NHCH2CH2CH2CHCOO
HN
NH2
NH2
idrogeni più acidi
13.
a)
CH3CH
OH
CHCOO
NH3
+ HCl
CH3CH
OH
CHCOOH + Cl
NH3
Paolo De Maria - Percorsi di chimica organica © Zanichelli Editore
+ H2O
Percorsi di chimica organica - Soluzioni degli esercizi del testo
b)
OOCCH2CHCOO
HOOCCH2CHCOO + Cl
+ HCl
NH3
NH3
COOH
14.
COOH
H2N
H
H2N
H3C
H
H
H
CH3
CH2CH3
CH2CH3
L-isoleucina
15.
diastereomero dell’ L-isoleucina
La treonina contiene due centri stereogeni.
H
(S)
HOOC
H
NH2
CH3
(R)
H
NH2
(S)
HOOC
16.
H
HO
OH
CH3
(S)
COOH
(R)
H2N
H
CH2SH
17.
Il gruppo -NH3+ ha effetto induttivo elettron-attrattore che aumenta l’acidità
dell’acido rispetto a quello non sostituito.
18.
a) Amminoacido che, in un peptide, ha il gruppo -NH3+ libero.
b) Catena costituita da meno di 50 amminoacidi legati tra loro mediante legami
peptidici.
c) Amminoacido che, in un peptide, ha il gruppo -COO- libero.
19.
a)
O
H3NCHCNHCH2COO
CH3
O
b)
H3NCHCNHCHCOO
H3C
CH
CH3
HN
Paolo De Maria - Percorsi di chimica organica © Zanichelli Editore
Percorsi di chimica organica - Soluzioni degli esercizi del testo
O
c)
H3N
CH C
NH
CH COO
CH(CH3)2
HN
O
d)
H3N
CH C
O
NH
CH2
C
NH
CH3
CH3
O
20.
a)
H3N
CH COO
CH2 C
O
NH
CH
C
NH
CH COO
CH(CH3)2
HN
O
b)
H3N
CH C
O
NH
CH
C
NH
CH(CH3)2
CH COO
CH3
HN
O
c)
H3N
CH2 C
O
NH
CH
CH3
21.
C
NH
CH COO
CH3
a) Val-Leu-Ser; Val-Ser-Leu; Leu-Val-Ser; Leu-Ser-Val; Ser-Val-Leu; Ser-Leu-Val
b) Ser-Pro-Leu; Ser-Leu-Pro; Pro-Ser-Leu; Pro-Leu-Ser; Leu-Pro-Ser; Leu-Ser-Pro
22.
La prolina non è presente nei tratti ad α-elica delle proteine a causa dell’anello rigido
di cui fa parte l’azoto, che impedisce la giusta rotazione del legame N-C e quindi causa
una distorsione dell’elica. Inoltre, l’azoto, impegnato nel legame peptidico, non ha
idrogeni per formare legami idrogeno con gli altri residui amminoacidici.
Paolo De Maria - Percorsi di chimica organica © Zanichelli Editore
Percorsi di chimica organica - Soluzioni degli esercizi del testo
23.
S-A-V-Y; S-A-Y-V; S-V-A-Y; S-V-Y-A; S-Y-A-V; S-Y-V-A; A-S-V-Y; A-S-Y-V;
A‑V‑S-Y; A-V-Y-S; A-Y-S-V; A-Y-V-S; V-S-A-Y; V-S-Y-A; V-A-S-Y; V-A-Y-S;
V-Y-S-A; V-Y-A-S; Y-S-A-V; Y-S-V-A; Y-A-S-V; Y-A-V-S; Y-V-S-A; Y-V-A-S.
O
24.
H3N
CH
O
C
NH
CH2
O
C
NH
CH2
C
O
NH
CH
CH2
C
NH
CH
CH2
COO
CH2CH2SCH3
OH
25.
a)
O
H3N
CH
O
C
NH
CH2CH(CH3)2
CH
O
O
C
H2O
O
H3N
CH
CH2OH
CO
H3N
+
CH
CO
CH2OH
CH2CH(CH3)2
b)
O
H3N
CH
C
O
NH
CH3
CH
C
O
O
H2O
O
H3N
CH2CH8CH3)2
CH
CO
+
H3N
CH
CO
CH2CH(CH3)2
CH3
c)
O
O
O
H3N CH C NH CH C NH CH C O
CH2
OH
26.
CH2OH
O
H2O
CH2CH2SCH3
H3N CH CO + H3N
CH2
O
O
CH CO + H3N
CH CO
CH2OH
CH2CH2SCH3
OH
Le proteine globulari hanno una struttura spaziale praticamente sferica, dovuta ai
ripiegamenti delle catene polipeptidiche (struttura terziaria). In questa struttura la
catena dispone residui apolari verso l’interno (core idrofobico) e i residui polari
Paolo De Maria - Percorsi di chimica organica © Zanichelli Editore
Percorsi di chimica organica - Soluzioni degli esercizi del testo
all’esterno, a contatto con l’ambiente acquosa. La struttura secondaria può essere ad
α-elica e, in alcune porzioni della catena, a β-foglietto.
27.
a) superficie b) centro c) superficie d) superficie e) centro f) centro
g) superficie h) superficie
28.
La struttura secondaria delle proteine fibrose è ad α-elica oppure a β-foglietto. Le
catene si dispongono lungo un asse così che la proteina assume forma allungata.
29.
a) Il DNA ,o acido desossiribonucleico, è un polimero costituito da monomeri detti
nucleotidi formati da una base azotata, desossiribosio (uno zucchero) e un gruppo
fosfato. Contiene il codice genetico dell’individuo.
b) Coppia di basi azotate complementari, tenute insieme da legami idrogeno. Nel DNA
le coppie di basi complementari sono: adenina-timina e guanina-citosina:
H
CH3
N
O
H
H
H
N
N
N
N
N
O
H
H
N
N
O
O
N
N
H
N
N
N
N
N
H
accoppiamento timina-adenina
accoppiamento citosina-guanina
c) La replicazione è il processo di duplicazione semiconservativa del DNA in cui un
nuovo filamento complementare viene sintetizzato su un vecchio filamento usato come
stampo. In questo modo la cellula in via di divisione raddoppia il proprio materiale
genetico in modo da trasmetterne una copia ad ognuna delle cellule figlie.
d)La trascrizione è il processo grazie al quale l’informazione genetica contenuta nel
DNA, necessaria alla sintesi proteica, viene trasferita sull’RNA che viene
sintetizzato come unico filamento, usando come stampo un filamento del DNA.
30.
Timina: 32%; Citosina: 18% perché la timina è complementare all’adenina e la
citosina è complementare alla guanina.
Paolo De Maria - Percorsi di chimica organica © Zanichelli Editore
Percorsi di chimica organica - Soluzioni degli esercizi del testo
31.
C-T-T-C-A-A-G-T-A-C-G
32.
a)
NH2
N
N
N
HO
N
O
O
H
O
H
H
O
H
NH
H
O-
P
N
O
O
O
H
O
H
H
O
H
H
O-
P
O-
O
N
NH
N
b)
NH2
N
O
HO
O
H
H
O
H
O
P
H
NH
H
N
O-
O
O
O
H
O
H
H
O
H
P
H
O-
O-
Paolo De Maria - Percorsi di chimica organica © Zanichelli Editore
Percorsi di chimica organica - Soluzioni degli esercizi del testo
NH2
c)
N
N
HO
O
NH2
O
H
H
O
H
O
H
N
H
N
O-
P
N
O
N
O
H
O
H
H
O
H
H
O-
P
O-
33.
a)
NH2
N
N
N
HO
N
O
O
H
H
O
H
O
P
H
NH
H
N
O-
O
O
O
H
O
H
H
O
H
P
H
O-
O-
Paolo De Maria - Percorsi di chimica organica © Zanichelli Editore
Percorsi di chimica organica - Soluzioni degli esercizi del testo
O
b)
N
NH
N
HO
O
O
H
O
H
H
O
H
NH
H
O-
P
NH2
N
N
O
O
O
H
O
H
H
O
H
H
O-
P
O-
NH2
c)
N
N
N
HO
N
NH2
O
H
O
H
H
O
H
N
H
N
O-
P
O
O
O
H
O
H
H
O
H
P
H
O-
O-
Paolo De Maria - Percorsi di chimica organica © Zanichelli Editore
Percorsi di chimica organica - Soluzioni degli esercizi del testo
34.
a) ambiente basico
NH2
N
O
N
N
NH2
NH
+
+
N
H
N
N
H
N
N
NH2
N
H
O
+
H
O
OH
OH
HO
H
H
OH
H
+
O
P
H
O-
OH
OH
O-
b) ambiente acido
NH2
N
O
N
N
NH2
NH
+
+
N
H
35.
N
N
H
N
N
NH2
N
H
HO
O
+
O
H
H
H
OH
H
+
H
O
P
OH
OH
Perché l’analisi dei contenuti di basi puriniche e pirimidiniche nel DNA dei diversi
organismi ha mostrato in tutti i casi che la percentuale di adenina è uguale a
quella della timina e la percentuale di guanina è uguale a quella della citosina. questo è
interpretabile in termini di complementarietà di basi e struttura a doppia elica.
36.
NH
N
OH
NH
N
H
N
N
H
N
N
N
NH2
tautomero dell’adenina
tautomero della guanina
NH
OH
NH
N
H
N
O
tautomero della citosina
N
H
O
tautomero della timina
Paolo De Maria - Percorsi di chimica organica © Zanichelli Editore
Percorsi di chimica organica - Soluzioni degli esercizi del testo
37.
H
H
N
N
N
38.
H
N
N
N
H
O
N
N
No, perché l’azoto è legato ad un gruppo metilico e non può perdere un idrogeno nella
formazione del glicoside.
Paolo De Maria - Percorsi di chimica organica © Zanichelli Editore